Журнал «Почки» 1 (15) 2016
Вернуться к номеру
Руководства консорциума по внедрению клинической фармакогенетики (CPIC) для генотипа CYP3A5 и дозировки такролимуса
Рубрики: Нефрология
Разделы: Официальная информация
Версия для печати
Статтю опубліковано на с. 57-61
Бібліографічні джерела
Birdwell K.A., Decker B., Barbarino J.M., Peterson J.F., Stein C.M., Sadee W., Wang D., Vinks A.A., He Y., Swen J.J., Leeder J.S., van Schaik R.H.N., Thummel K.E., Klein T.E., Caudle K.E., MacPhee I.A.M. Clinical Pharmacogenetics Implementation Consortium (CPIC) guidelines for CYP3A5 genotype and tacrolimus dosing // Clin. Pharmacol. Ther. — 2015 Jul. — 98(1). — 19-24. [40 references] PubMed
Рекомендації
Основні рекомендації
Сила терапевтичних рекомендацій (сильні, помірні, необов’язкові) визначається в кінці поля «Основні рекомендації».
Інтерпретація генетичних тестів
Кожна названа * алель визначається генотипом в одному або більше конкретних однонуклеотидних поліморфізмів (див. табл. S1 — поле «Наявність супровідної документації»). Функції, пов’язані з цими варіантами алелей узагальнені в табл. S2. Розподіл фенотипу, імовірно, цитохрому P450 (CYP) 345 (CYP3A5) базується на основі * диплотипів алелей, що наведено в табл. 1. Алелі CYP3A5 були добре вивчені у групах із різним географічним походженням (див. табл. S3). Одним з обмежень, властивих лише для генотипного тесту, є те, що рідкісні або de novo варіанти не можуть бути включені в комерційно доступні генотипові тести.
Терапевтичні рекомендації
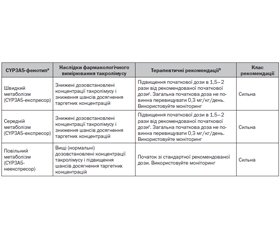
Це керівництво не призначене для заохочення чи застерігання від тестування генотипу CYP3A5 у трансплантації. Поточні дані щодо користі генотипування CYP3A5 для створення керівництва з дозування такролімусу обмежуються впливом CYP3A5 на фармакокінетичні параметри такролімусу, без прямих доказів поліпшення клінічної імунодепресивної дії. Як наслідок, автори не створюють рекомендацій з приводу того, варто чи ні проводити тест генотипування CYP3A5 при трансплантації, але вони дають рекомендації про те, як використовувати інформацію про генотип CYP3A5, якщо він встановлений. Оскільки досягнення цільових концентрацій у крові є стандартною клінічною практикою, автори рекомендують індивідуалізувати початкове лікування такролімусом, використовуючи генотип CYP3A5 для дозування, як зазначено в табл. 2, якщо генотип CYP3A5 відомий. Реципієнти трансплантата із фенотипом повільного метаболізму (табл. 1) повинні отримувати стандартну дозу препарату, зазначену в інструкції. Реципієнти із швидким або середнім фенотипом метаболізму загалом потребуватимуть підвищення дози такролімусу для досягнення терапевтичних концентрацій препарату. Автори рекомендують дозу, що в 1,5–2 рази вища від стандартної, але не вища ніж 0,3 мг/кг/день, із подальшим моніторингом препарату (ПМП), враховуючи ризик артеріальної вазоконстрикції, гіпертензії та нефротоксичності, що можуть виникнути при концентрації такролімусу, вищій від терапевтичної.
Крім того, супутні препарати, порушення функції печінки або наявність клінічних станів, таких як діарея, повинні бути взяті до уваги при дозуванні такролімусу (див. розділ «Інші міркування» в оригінальному керівництві).
З огляду на наявність ПМП генетичне тестування дуже корисне на початку лікування з метою більш швидкого досягнення концентрації терапевтичної дози. Це було показано в рандомізованому контрольованому дослідженні, у якому цільові концентрації такролімусу в крові були досягнуті раніше в нових реципієнтів ниркового трансплантата, у яких доза базувалася на підставі генотипуванні CYP3A5, на відміну від контрольної групи, у якій дозування такролімусу визначали на підставі маси тіла. У цьому дослідженні пацієнти отримали індукційну терапію базиліксимабом або антитимоцитарним глобуліном. У групі зі швидким метаболізмом на підставі генотипування призначали дози такролімусу до 0,3 мг/кг/добу, у той час як пацієнти із повільним метаболізмом отримували до 0,15 мг/кг/день, контрольна група — 0,2 мг/кг/добу. ПМП було використано в обох групах. Через три дні після початку лікування такролімусом значно більше реципієнтів трансплантата з групи генотипування досягли цільового рівня порівняно з контрольною групою (близько 43,2 проти 29,1 % відповідно). Однак слід зазначити, що такролімус не призначався до сьомого дня в очікуванні результатів тесту генотипування, що може відрізнятися від стандартних схем лікування, коли такролімус призначається під час трансплантації. Не було жодних відмінностей у виживанні пацієнтів, нефротоксичності або частоті гострого відторгнення транспланта між цими групами протягом наступних трьох місяців спостереження.
З цього дослідження, що є єдиним з опублікованих рандомізованих контрольованих, випливає, що потрібно більше даних для розуміння, чи впливає дозування такролімусу на підставі генетичного тестування на клінічні результати. Однак останні дані метааналізу, у тому числі 21 дослідження, які оцінювали вплив поліморфізму CYP3A5 на реципієнта ниркового трансплантата, дозволили дійти висновку, що є значно підвищений ризик відторгнення трансплантата в пацієнтів із генотипом CYP3A5*1/*1 або CYP3A5*1/*3 (P = 0,04; відношення шансів = 1,32). Крім того, у хворих із генотипом CYP3A5*3/*3 (неекспресори) встановлені дози були скореговані в концентрації, в 1,8–2,5 раза вищій, ніж у CYP3A5-експресорів, протягом першого року після трансплантації.
Таким чином, на даний момент не існує переконливих доказів для твердження, що генотип-кероване дозування такролімусу впливає на віддалені клінічні результати. Однак є вагомі докази для підтримки його впливу на досягнення цільової концентрації у крові, що є рутинною клінічною практикою для більшості центрів (див. табл. S4). Крім початкової дози, генотип-кероване дозування може також бути корисним для пацієнтів, у яких є складним досягнення терапевтичної концентрації, у таких випадках генотип може надати деяку додаткову інформацію для розуміння його причини.
У реципієнтів трансплантата печінки генотип CYP3A5 донора може не бути таким же, як генотип CYP3A5 кишечника реципієнта. У цих випадках, можливо, при визначенні дози буде необхідно враховувати генотипи як донора, так і реципієнта. Однак дослідження на сьогодні були безрезультатними щодо встановлення взаємного впливу генотипів донорів і реципієнтів і з’ясування того, чи генотипи донорів печінки й генотипи кишечника реципієнтів вступають у невідповідність у різні моменти після трансплантації. Хоча деякі дослідження показують, що генотип донора впливає на концентрації призначених доз на першому тижні після трансплантації, інші показали, що генотип перестає відігравати провідну роль до досягнення другого тижня або навіть шостого місяця після трансплантації.
Докази також неоднозначні щодо кишкового генотипу реципієнта: кілька досліджень показують, що він ніколи не має значного впливу на концентрації такролімусу, тоді як інші показують, що його вплив на концентрації є істотним лише до тієї точки, на якій генотип донора стає суттєвим. Через невелику кількість досліджень, присвячених аналізу цих випадків, а також некоректні результати ця рекомендація включає лише поради для пацієнтів після трансплантації нирок, серця, легень і стовбурових клітин гемопоезу, а також пацієнтів із трансплантатом печінки, у яких генотип збігається з генотипом донора.
Педіатрія
Ефект генотипу CYP3A5 на концентрації такролімусу зі скорегованими дозами в педіатричній практиці був вивчений у декількох клінічних ситуаціях, включаючи трансплантацію серця та печінки, але найширше — при трансплантації нирки.
На жаль, наявні дані варіюють в плані тривалості дослідження після трансплантації і включення додаткових факторів, що впливають на зв’язок дози та ефекту. У цілому хоча зв’язок доза — ефект змінюється з плином часу незалежно від генотипу концентрації скорегованої дози такролімусу в 1,5–2 рази вищі в пацієнтів із пересадженою ниркою при генотипі CYP3A5*3/*3 порівняно з пацієнтами з генотипом CYP3A5*1/*1 або *1/*3 протягом перших двох-чотирьох тижнів після трансплантації, через шість місяців і протягом першого року після трансплантації. Однак вік пацієнта й супровідне лікування також сприяють варіабельності зв’язку дози та ефекту такролімусу в дітей. Наприклад, у постпубертаті пацієнти з трансплантованою ниркою (вік > 12 років) мають більш високі кореговані дози концентрації такролімусу порівняно з дітьми молодшого віку в перші два-три тижні післятрансплантаційного періоду або протягом першого року після трансплантації, що свідчить про потребу в більш низькій дозі для досягнення цільових концентрацій, придатних для порівняння. Таким чином, для дітей та підлітків із принаймні однією алеллю CYP3A5*1 рекомендація підвищення дози в 1,5–2 рази з подальшим контролем ПМП, як для дорослих, здається доречною.
http://www.guideline.gov/content.aspx?f=rss&id=49492&osrc=12
Переклад: к.м.н. Іванова М.Д.

/58.jpg)
/59.jpg)