Международный эндокринологический журнал 8 (72) 2015
Вернуться к номеру
Ремоделирование миокарда у пациентов с сахарным диабетом 2-го типа в сочетании с неалкогольной жировой болезнью печени
Авторы: Кравчун Н.А., Черняева А.А. - ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины», г. Харьков
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
З метою вивчення особливостей ранніх кардіоваскулярних ускладнень у хворих на цукровий діабет (ЦД) 2-го типу в поєднанні з неалкогольною жировою хворобою печінки (НАЖХП) проведено вивчення частоти серцево-судинних захворювань і зіставлення клініко-метаболічних параметрів із даними ехокардіографічного і допплерівського дослідження сонних артерій.
Було обстежено 70 хворих на ЦД 2-го типу, із них 27 пацієнтів без НАЖХП, 24 — із ЦД 2-го типу та НАЖХП із нормальною діастолічною функцією і 19 — із ЦД 2-го типу та НАЖХП з порушеною діастолічною функцією.
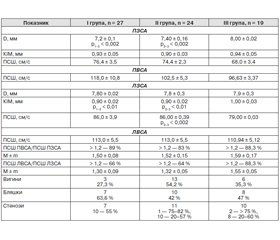
Установлено роль запалення вісцеральної жирової тканини в генезі кардіоваскулярних ускладнень у всіх хворих на ЦД 2-го типу та вплив мезенхімального запалення в печінці на ризик виникнення даних ускладнень у пацієнтів із ЦД 2-го типу та НАЖХП за даними рівня трансаміназ. Виявлено збільшення частоти гіпертрофії міокарда лівого шлуночка у хворих на ЦД 2-го типу в поєднанні з НАЖХП більше ніж утричі порівняно з хворими без НАЖХП. До того ж збільшення частоти гіпертрофії міокарда лівого шлуночка було прямо пропорційно наростанню маси тіла (45–88 %) у хворих із поєднаною патологією і порушеною діастолічною функцією. У хворих на ЦД 2-го типу в поєднанні з НАЖХП зареєстровано ремоделювання міокарда лівого шлуночка за типом гіпертрофії і порушення діастолічної функції, що свідчить про більш виражений атеросклеротичний процес у даної категорії хворих порівняно з пацієнтами без НАЖХП.
Також установлено збільшення фактора некрозу пухлини α у хворих на ЦД 2-го типу в поєднанні з НАЖХП порівняно з хворими без НАЖХП.
Виявлено виражені атеросклеротичні зміни в міокарді і сонних артеріях при використанні високочутливих інструментальних методів, а саме: гіпертрофія міокарда лівого шлуночка реєструвалася в 60 % хворих на ЦД 2-го типу, у 83 % — із ЦД 2-го типу в поєднанні з НАЖХП, при цьому 44 % із них мали порушену діастолічну функцію міокарда та потовщення комплексу інтима-медіа зі звуженням і вже наявністю атеросклеротичних бляшок в області гирла і біфуркації сонних артерій.
Отримані результати свідчать про необхідність включення до переліку обов’язкових діагностичних досліджень у хворих на ЦД 2-го типу протягом перших двох років із моменту встановлення діагнозу ехокардіографії серця і допплерографії сонних артерій, а також встановлення рівня фактора некрозу пухлини α, що відіграє важливу роль у прогресуванні серцево-судинних ускладнень у хворих на поєднану патологію.
С целью изучения особенностей ранних кардиоваскулярных осложнений у больных CД 2-го типа и неалкогольной жировой болезнью печени (НАЖБП) проведены изучение частоты сердечно-сосудистых заболеваний и сопоставление клинико-метаболических параметров с данными эхокардиографического и допплеровского исследования сонных артерий.
Было обследовано 70 больных СД 2-го типа, из них 27 пациентов без НАЖБП, 24 — с СД 2-го типа и НАЖБП с нормальной диастолической функцией и 19 — с СД 2-го типа и НАЖБП с нарушенной диастолической функцией.
Установлена роль воспаления висцеральной жировой ткани в генезе кардиоваскулярных осложнений у всех больных СД 2-го типа и влияние мезенхимального воспаления в печени на риск возникновения данных осложнений у пациентов с СД 2-го типа и НАЖБП по данным уровня трансаминаз. Выявлено увеличение частоты гипертрофии миокарда левого желудочка у больных с СД 2-го типа и НАЖБП более чем в 3 раза по сравнению с больными без НАЖБП. При этом увеличение частоты гипертрофии миокарда левого желудочка было прямо пропорционально нарастанию массы тела (45–88 %) у больных с сочетанной патологией и нарушенной диастолической функцией. У больных СД 2-го типа и НАЖБП зарегистрировано ремоделирование миокарда левого желудочка по типу гипертрофии и нарушения диастолической функции, что свидетельствует о более выраженном атеросклеротическом процессе у данной категории больных по сравнению с пациентами без НАЖБП.
Также установлено увеличение фактора некроза опухоли α у больных СД 2-го типа и НАЖБП по сравнению с больными без НАЖБП.
Выявлены выраженные атеросклеротические изменения в миокарде и сонных артериях при использовании высокочувствительных инструментальных методов, а именно: гипертрофия миокарда левого желудочка регистрировалась у 60 % больных СД 2-го типа, у 83 % — с СД 2-го типа и НАЖБП, при этом 44 % из них имели нарушенную диастолическую функцию миокарда и утолщение комплекса интима-медиа с сужением и уже наличием атеросклеротических бляшек в области устья и бифуркации сонных артерий.
Полученные результаты свидетельствуют о необходимости включения в перечень обязательных диагностических исследований у больных СД 2-го типа на протяжении первых двух лет с момента установления диагноза эхокардиографии сердца и допплерографии сонных артерий, а также установление уровня фактора некроза опухоли α, играющего важную роль в прогрессировании сердечно-сосудистых осложнений у больных с сочетанной патологией.
In order to investigate the peculiarities of early cardiovascular complications in patients with type 2 diabetes mellitus (DM) associated with non-alcoholic fatty liver disease (NAFLD), we have determined the incidence of cardiovascular diseases and compared clinical metabolic parameters with the echocardiographic and Doppler studies of carotid arteries.
We have examined 70 patients with type 2 DM, among them 27 individuals without NAFLD, 24 — with type 2 DM and NAFLD with normal diastolic function, and 19 — with type 2 DM and NAFLD with diastolic dysfunction.
The role of visceral fatty tissue inflammation in the genesis of cardiovascular complications in all patients with type 2 DM and the impact of mesenchymal inflammation in the liver on the risk of the development of these complications in patients with type 2 DM and NAFLD has been established according to the transaminases level. More than 3-fold increase of the incidence of left ventricular myocardial hypertrophy in patients with type 2 DM and NAFLD has been revealed compared to the patients without NAFLD. Meanwhile, the rise of the incidence of left ventricular myocardial hypertrophy was directly proportional to the increase of the body mass (45–88 %) in patients with combined pathology and diastolic dysfunction. The patients with type 2 DM associated with NAFLD demonstrated remodeling of left ventricular myocardium according to the hypertrophy type and diastolic dysfunction that proves the more significant atherosclerotic process in this cohort of patients compared to the patients with no evidence of NAFLD.
An increase of tumor necrosis factor α level was also determined in type 2 DM patients with NAFLD compared to those without NAFLD.
Marked atherosclerotic changes in the myocardium and carotid arteries were detected when using highly sensitive instrumental methods, namely left ventricular myocardial hypertrophy was registered in 60 % of type 2 DM patients; in 83 % — with type 2 DM combined with NAFLD; meanwhile, 44 % of them had diastolic dysfunction of the myocardium and intima-media complex thickening with narrowing and even presence of atherosclerotic plaques in the region of orifice and bifurcation of carotid arteries.
The findings suggest the need to include echocardiography of the heart and carotid arteries Doppler ultrasound into the list of mandatory diagnostic tests in patients with DM 2 in the first two years from the time of diagnosis, as well as to establish the levels of tumor necrosis factor α, which plays an important role in the progression of cardiovascular complications in patients with comorbidity.
ремоделювання міокарда, цукровий діабет 2-го типу, неалкогольна жирова хвороба печінки, фактор некрозу пухлини α.
ремоделирование миокарда, сахарный диабет 2-го типа, неалкогольная жировая болезнь печени, фактор некроза опухоли α.
myocardium remodeling, type 2 diabetes mellitus, non-alcoholic fatty liver disease, tumor necrosis factor α.
Статтю опубліковано на с. 88-94
Вступ
Матеріали та методи
Результати дослідження
Обговорення
Висновки
1. International Diabetes Federation (IDF). Diabetes Atlas. — 7th ed. — Brussels. — 2015.
2. American Diabetes Association (ADA) Standards of Medical Care in Diabetesd 2014 / ADA // Diabetes Care. — January 2014. — Vol. 37, Suppl. 1. — P. 14-80.
3. Ritchie S.A. The link between abdominal obesity, metabolic syndrome and cardiovascular disease / S.A. Ritchie, J.M. Connell // Nutr. Metab. Cardiovasc. Dis. — 2007. — Vol. 17(4). — P. 319-326.
4. Day C.P. Non-alcoholic fatty liver disease: current concepts and management strategies / C.P. Day // Clin. Med. — 2006. — Vol. 6(1). — P. 19-25.
5. Nonalcoholic fatty liver disease and the metabolic syndrome / G. Marchesini, R. Marzocchi, F. Agostini et al. // Current Opinion in Lipidology. — 2005. — Vol. 16(4). — P. 421-427.
6. McCullough A.J. Pathophysiology of nonalcoholic steatohepatitis / A.J. McCullough // J. Clin. Gastroenterol. — 2006. — Vol. 40, Suppl. 1. — P. 17-29.
7. Harrison S.A. Liver disease in patients with diabetes mellitus / S.A. Harrison // J. Clin. Gastroenterol. — 2006. — Vol. 40(1). — P. 68-76.
8. Evaluation of metabolic syndrome frequency and carotid artery intima-media thickness as risk factors for atherosclerosis in patients with nonalcoholic fatty liver disease / C. Aygun, O. Kocaman, T. Sahin et al. // Dig. Dis. Sci. — 2008. — Vol. 53(5). — P. 1352-1357.
9. Insulin resistance, insulin response, and obesity as indicators of metabolic risk / E. Ferrannini, B. Balkau, S.W. Coppack et al. // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92(8). — P. 2885-2892.
10. Targher G. Non-alcoholic fatty liver disease and increased risk of cardiovascular disease / G. Targher, G. Arcaro // Atherosclerosis. — 2007. — Vol. 191(2). — P. 235-240.
11. Pickup J.C. Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes / J.C. Pickup // Diabetes Care. — 2004. — Vol. 27(3). — P. 813-823.
12. Nonalcoholic fatty liver disease and metabolic syndrome: equality of pathogenetic mechanisms and therapeutic approaches / E.I. Tkachenko, I.P. Uspenskiĭ, L.N. Belousova et al. // Eksp. Klin. Gastroenterol. — 2008. — Vol. 2. — P. 92-96.
13. Zahorska-Markiewicz B. Serum NO (nitric oxide) and TNF-α in obesity / B. Zahorska-Markiewicz, M. Olszanecka-Glinianowicz, J. Janowska et al. // Int. J. Obes. — 2001. — Vol. 25, Suppl. 2. — P. 129.
14. Kovalyova O. Left ventricular remodeling and tumor necrosis factor-alpha on hypertension / O. Kovalyova, O. Nyzhegorodtseva // Eur. J. Echocardiography. — 2002. — Vol. 3, Suppl. 1. — P. 15.
15. Bishop J. E. Regulation of cardiovascular collagen synthesis by mechanical load / J.E. Bishop, G. Lindahl // Cardiovasc. Res. — 2008. — Vol. 42. — P. 27-44.
16. Transcellular activation of platelets and endothelial cells by bioactive lipids in platelet microparticles / O.P. Barry, D. Pratico, J.A. Lawson et al. // J. Clin. Invest. — 1997. — Vol. 99(9). — P. 2118-2127.
17. Gene expression of tumor necrosis factor alpha and TNF-receptors, p55 and p75, in nonalcoholic steatohepatitis patients / J. Crespo, A. Cayὁn, P. Fernández-Gil et al. // Hepatology. — 2001. — Vol. 34(6). — P. 1158-1163.
1. International Diabetes Federation (IDF). Diabetes Atlas. 7th ed. // Brussels, 2015.
2. American Diabetes Association (ADA) Standards of Medical Care in Diabetes. Diabetes Care 2014; 37:14-80.
3. Ritchie SA. The link between abdominal obesity, metabolic syndrome and cardiovascular disease. Nutr. Metab. Cardiovasc. Dis. 2007; 17 (4):319-26.
4. Day CP. Non-alcoholic fatty liver disease: current concepts and management strategies. Clin. Med. 2006; 6 (1):19-25.
5. Marchesini G, Marzocchi R, Agostini F. Nonalcoholic fatty liver disease and the metabolic syndrome. Current Opinion in Lipidology. 2005; 16 (4): 421-7.
6. McCullough AJ. Pathophysiology of nonalcoholic steatohepatitis. J. Clin. Gastroenterol. 2006; 40:17-29.
7. Harrison SA. Liver disease in patients with diabetes mellitus. J. Clin. Gastroenterol. 2006; 40 (1): 68-76.
8. Aygun C, Kocaman O, Sahin T. Evaluation of metabolic syndrome frequency and carotid artery intima-media thickness as risk factors for atherosclerosis in patients with nonalcoholic fatty liver disease. Dig Dis Sci. 2008; 53 (5): 1352-7.
9. Ferrannini E, Balkau B, Coppack SW. Insulin resistance, insulin response, and obesity as indicators of metabolic risk. J. Clin. Endocrinol. Metab. 2007;92 (8): 2885-92.
10. Targher G. Non-alcoholic fatty liver disease and increased risk of cardiovascular disease. Atherosclerosis.2007; 191 (2): 235-40.
11. Pickup JC. Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes. Diabetes Care. 2004; 27 (3): 813-23.
12. Tkachenko EI, Uspenslij IP, Belousova LN. Nonalcoholic fatty liver disease and metabolic syndrome: equality of pathogenetic mechanisms and therapeutic approaches. Eksp. Klin. Gastroenterol. 2008; 2: 92-6.
13. Zahorska-Markiewicz B. Serum NO (nitric oxide) and TNF-α in obesity. Int. J. Obes. 2001; 25: 129.
14. Kovalyova O. Left ventricular remodeling and tumor necrosis factor-alpha on hypertension. Eur. J. Echocardiography. 2002;3:15.
15. Bishop JE. Regulation of cardiovascular collagen synthesis by mechanical load. Cardiovasc Res. 2008; 42: 27-44.
16. Barry OP, Pratico D, Lawson JA. Transcellular activation of platelets and endothelial cells by bioactive lipids in platelet microparticles. J. Clin. Invest.. 1997; 99 (9): 21-2127.
17. Crespo J, Cayon A, Fernandez-Gil P. Gene expression of tumor necrosis factor alpha and TNF-receptors, p55 and p75, in nonalcoholic steatohepatitis patients. Hepatology. 2001;34 (6):1158-63.

/91.jpg)
/92.jpg)