Журнал «Здоровье ребенка» 6 (66) 2015
Вернуться к номеру
Активированные азотсодержащие метаболиты организма человека при заболеваниях органов дыхания. Генераторы и генерация (часть 1)
Авторы: Абатуров А.Е. - ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»; Волосовец А.П. - Национальный медицинский университет им. А.А. Богомольца, г. Киев; Борисова Т.П. - ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В обзоре литературы изложена история открытия монооксида азота, рассмотрена характеристика нитрооксидсинтаз, представлены современные данные об активированных азотсодержащих метаболитах человеческого организма при заболеваниях органов дыхания.
В огляді літератури викладена історія відкриття монооксиду азоту, розглянута характеристика нітрооксидсинтаз, представлені сучасні дані щодо активованих азотовмісних метаболітів людського організму при захворюваннях органів дихання.
This literature review outlines the history of the discovery of nitric oxide, considers the characteristics of nitric oxide synthases, presents current data about the activated nitrogen-containing metabolites of the human body in diseases of the respiratory system.
активированные азотсодержащие метаболиты, легкие.
активовані азотовмісні метаболіти, легені.
activated nitrogen-containing metabolites, lungs.
Статья опубликована на с. 147-152
Введение
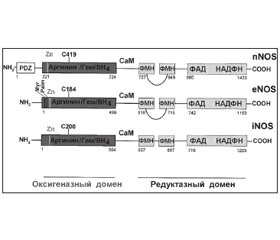
Характеристика нитрооксидсинтаз
/149.jpg)
Активированные азотсодержащие метаболиты
1. Абатуров А.Е. Роль монооксида азота в системе неспе-цифической защиты респираторного тракта // Здоровье ребенка. — 2009. — № 1 (16). — С. 130-137.
2. Козина О.В., Огородова Л.М. Образование и биологическая роль NO при аллергическом воспалении // Бюллетень сибирской медицины. — 2009. — № 3. — C. 95-105.
3. Agorreta J. Effects of Acute Hypoxia and Lipopolysaccharide on Nitric Oxide Synthase-2 Expression in Acute Lung Injury / J. Agorreta, M. Garayoa, L.M. Montuenga, J.J. Zulueta // Am. J. Respir. Crit. Care Med. 2003 Aug 1;168(3):287-96. doi: 10.1164/rccm.200209-1027OC.
4. Alderton W.K., Cooper C.E., Knowles R.G. Nitric oxide synthases: structure, function and inhibition // Biochem. J. 2001 Aug 1; 357(Pt 3): 593-615. PMID: 11463332.
5. Allain A. Role of nitric oxide in developmental biology in plants, bacteria, and man / A. Allain, V.T. Hoang, G.F. Lasker et al. // Curr. Top. Pharmacol. 2011; 15(2): 25-33. PMID: 24563585.
6. Arzumanian V., Stankevičius E., Laukevičienė A., Kėvelaitis E. Mechanisms of nitric oxide synthesis and action in cells // Medicina (Kaunas). 2003; 39(6): 535-41. PMID: 12829875.
7. Atochina-Vasserman E.N., Beers M.F., Gow A.J. Review: Chemical and structural modifications of pulmonary collectins and their functional consequences // Innate Immun. 2010 Jun; 16(3): 175-82. doi: 10.1177/1753425910368871.
8. Attia M.S., Lass E,. Loch Macdonald R. Nitric oxide synthases: three pieces to the puzzle? // Acta Neurochir Suppl. 2015; 120: 131-5. doi: 10.1007/978-3-319-04981-6_22.
9. Bieńkowska-Haba M. Tlenek azotu wytwarzany przez leukocyty płucne w astmie oskrzelowej // Postepy Hig. Med. Dosw (Online). 2005; 59: 584-601. PMID: 16407797.
10. Bogdan C. Nitric oxide synthase in innate and adaptive immunity: an update // Trends Immunol. 2015 Mar; 36(3): 161-78. doi: 10.1016/j.it.2015.01.003.
11. Bokhari A.R., Murrell G.A. The role of nitric oxide in tendon healing // J. Shoulder Elbow Surg. 2012 Feb; 21(2): 238-44. doi: 10.1016/j.jse.2011.11.001.
12. Cobos Barroso N. Óxido nítrico exhalado en niños: un indicador no invasivo de la inflamación de las vías aéreas / N. Cobos Barroso, E.G. Pérez-Yarza, O. Sardón Prado, C. Reverté Bover, S. Gartner, J. Korta Murua // Arch. Bronconeumol. 2008 Jan; 44(1): 41-51. PMID: 18221726.
13. Culotta E., Koshland D.E., Jr. NO news is good news // Science. 1992 Dec 18; 258(5090): 1862-5. doi:10.1126/science.1361684.
14. Doucet M.V., Harkin A., Dev K.K. The PSD-95/nNOS complex: new drugs for depression? // Pharmacol. Ther. 2012 Feb; 133(2): 218-29. doi: 10.1016/j.pharmthera.2011.11.005.
15. Evangelista A.M., Kohr M.J., Murphy E. S-nitrosylation: specificity, occupancy, and interaction with other post-translational modifications // Antioxid. Redox. Signal. 2013 Oct 10; 19(11): 1209-19. doi: 10.1089/ars.2012.5056.
16. Fleming I. Molecular mechanisms underlying the activation of eNOS // Pflugers Arch. 2010 May; 459(6): 793-806. doi: 10.1007/s00424-009-0767-7.
17. Förstermann U., Münzel T. Endothelial nitric oxide synthase in vascular disease: from marvel to menace // Circulation. 2006 Apr 4; 113(13): 1708-14. doi: 10.1161/CIRCULATIONAHA.105.602532.
18. Förstermann U., Sessa W.C. Nitric oxide synthases: regulation and function // Eur. Heart J. 2012 Apr; 33(7): 829-37, 837a-837d. doi: 10.1093/eurheartj/ehr304.
19. Furchgott R.F., Zawadzki J.V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine // Nature. 1980 Nov 27; 288(5789): 373-6. PMID: 6253831.
20. Giulivi C., Kato K., Cooper C.E. Nitric oxide regulation of mitochondrial oxygen consumption I: cellular physiology // Am. J. Physiol. Cell. Physiol. 2006 Dec; 291(6): C1225-31. doi: 10.1152/ajpcell.00307.2006.
21. Goodrum K.J., Poulson-Dunlap J. Cytokine Responses to Group B Streptococci Induce Nitric Oxide Production in Respiratory Epithelial Cells // Infect. Immun. 2002 Jan; 70(1): 49-54. doi: 10.1128/IAI.70.1.49-54.2002.
22. Knott A.B., Bossy-Wetzel E. Nitric oxide in health and disease of the nervous system // Antioxid. Redox. Signal. 2009 Mar; 11(3): 541-54. doi: 10.1089/ARS.2008.2234.
23. Kone B.C. Protein interactions with nitric oxide synthases: controlling the right time, the right place, and the right amount of nitric oxide/ B.C. Kone, T. Kuncewicz, W. Zhang, Z.-Y. Yu // Am. J. Physiol. Renal. Physiol. 2003 Aug; 285(2): F178-90. doi: 10.1152/ajprenal.00048.2003.
24. Krumenacker J.S., Hanafy K.A., Murad F. Regulation of nitric oxide and soluble guanylyl cyclase // Brain Res. Bull. 2004 Feb 15; 62(6): 505-15. doi:10.1016/S0361-9230(03)00102-3.
25. Lee K.S. Differential effects of substrate-analogue inhibitors on nitric oxide synthase dimerization/ K.S. Lee, D.K. Lee, D. Jeoung, H. Lee, J. Choe, K.S. Ha, M.H. Won, Y.G. Kwon, Y.M. Kim // Biochem. Biophys. Res. Commun. 2012 Feb 3; 418(1): 49-55. doi: 10.1016/j.bbrc.2011.12.123.
26. Levine A.B., Punihaole D., Levine T.B. Characterization of the role of nitric oxide and its clinical applications // Cardiology. 2012; 122(1): 55-68. doi: 10.1159/000338150.
27. Li D. Regulation of the Monomer-Dimer Equilibrium in Inducible Nitric-oxide Synthase by Nitric Oxide/ D. Li, E.Y. Hayden, K. Panda, D.J. Stuehr, H. Deng, D.L. Rousseau, S.-R. Yeh // J. Biol. Chem. 2006 Mar 24; 281(12): 8197-204. doi: 10.1074/jbc.M507328200.
28. Li H., Poulos T.L. Structure-function studies on nitric oxi-de synthases // J. Inorg. Biochem. 2005 Jan; 99(1): 293-30. doi:10.1016/j.jinorgbio.2004.10.016.
29. Li J., Billiar T.R. The role of nitric oxide in apoptosis // Semin. Perinatol. 2000 Feb; 24(1): 46-50. PMID: 10709859.
30. Luo S. Molecular mechanisms of endothelial NO synthase uncoupling / S. Luo, H. Lei, H. Qin, Y. Xia // Curr. Pharm. Des. 2014; 20(22): 3548-53. PMID: 24180388.
31. Marsh N., Marsh A. A short history of nitroglycerine and nitric oxide in pharmacology and physiology // Clin. Exp. Pharmacol. Physiol. 2000 Apr; 27(4): 313-9. doi: 10.1046/j.1440-1681.2000.03240.x.
32. Nagy G. Nitric oxide, mitochondrial hyperpolarization and T-cell activation/ G. Nagy, A. Koncz, D. Fernandez, A. Perl // Free Radic. Biol. Med. 2007 Jun 1; 42(11): 1625-31. doi: 10.1016/j.freeradbiomed.2007.
33. Paige J.S., Jaffrey S.R. Pharmacologic manipulation of nitric oxide signaling: targeting NOS dimerization and protein-protein interactions // Curr. Top. Med. Chem. 2007; 7(1): 97-114. PMID: 1726659.
34. Pautz A. Regulation of the expression of inducible nitric oxi-de synthase / A. Pautz, J. Art, S. Hahn, S. Nowag, C. Voss, H. Klei-nert // Nitric. Oxide. 2010 Sep 15; 23(2): 75-93. doi: 10.1016/j.niox.2010.04.007.
35. Pereira A.C. Nitric oxide synthesis and biological functions of nitric oxide released from ruthenium compounds / A.C. Pereira, M. Paulo, A.V. Araújo, G.J. Rodrigues, L.M. Bendhack // Braz. J. Med. Biol. Res. 2011 Sep; 44(9): 947-57. http: //dx.doi.org/10.1590/S0100-879X2011007500084.
36. Persson M.G. Single-breath nitric oxide measurements in asthmatic patients and smokers / M.G. Persson, O. Zetterstrom, V. Agrenius, E. Ihre, L.E. Gustafsson // Lancet. 1994 Jan 15; 343(8890): 146-7. PMID: 7904005
37. Predonzani A. Spotlights on immunological effects of reactive nitrogen species: When inflammation says nitric oxide / A. Predonzani, B. Calì, A.H. Agnellini, B. Molon // World J. Exp. Med. 2015 May 20; 5(2): 64-76. doi: 10.5493/wjem.v5.i2.64.
38. Rao K.M.K. Molecular mechanisms regulating iNOS expression in various cell types // J. Toxicol. Environ. Health B Crit. Rev. 2000 Jan-Mar; 3(1): 27-58. doi: 10.1080/109374000281131.
39. Ricciardolo F.L.M. Multiple roles of nitric oxide in the airways // Thorax. 2003 Feb; 58(2): 175-82. doi: 10.1136/thorax.58.2.175.
40. Ricciardolo F.L.M., Sterk P.J., Gaston B., Folkerts G. Nitric Oxide in Health and Disease of the Respiratory System // Physiol. Rev. 2004 Jul; 84(3): 731-65. doi: 10.1152/physrev.00034.2003.
41. Saini R. Nitric oxide synthase localization in the rat neutrophils: immunocytochemical, molecular, and biochemical studies / R. Saini, S. Patel, R. Saluja, A.A. Sahasrabuddhe, M.P. Singh, S. Habib, V.K. Bajpai, M. Dikshit // J. Leukoc. Biol. 2006 Mar; 79(3): 519-28. doi: 10.1189/jlb.0605320.
42. Stuehr D.J. Update on Mechanism and Catalytic Regulation in the NO Synthases / D.J. Stuehr, J. Santolini, Z.-Q. Wang, -C.-C. Wei, S. Adak // J. Biol. Chem. 2004 Aug 27; 279(35): 36167-70. doi: 10.1074/jbc.R400017200.
43. Su Y. Regulation of endothelial nitric oxide synthase activity by protein-protein interaction // Curr. Pharm. Des. 2014; 20(22): 3514-20. PMID: 24180383.
44. Sugiura H., Ichinose M. Nitrative stress in inflammatory lung diseases // Nitric Oxide. 2011 Aug 1; 25(2): 138-44. doi: 10.1016/j.niox.2011.03.079.
45. Tejedo J.R. Low concentrations of nitric oxide delay the differentiation of embryonic stem cells and promote their survival / J.R. Tejedo, R. Tapia-Limonchi, S. Mora-Castilla et al. // Cell. Death. Dis. 2010 Oct 7; 1: e80. doi: 10.1038/cddis.2010.57.
46. Witte M.B., Barbul A. Role of nitric oxide in wound repair // Am. J. Surg. 2002 Apr; 183(4): 406-12. doi: http: //dx.doi.org/10.1016/S0002-9610(02)00815-2.
47. Xu W., Zheng S., Dweik R.A., Erzurum S.C. Role of epithelial nitric oxide in airway viral infection / W. Xu, S. Zheng, R.A. Dweik, S.C. Erzurum // Free Radic. Biol. Med. 2006 Jul 1; 41(1): 19-28. doi:10.1016/j.freeradbiomed.2006.01.037.

/148.jpg)
/149_2.jpg)
/150.jpg)
/151.jpg)