Статтю опубліковано на с. 15-18
Вступ
Харчова алергія (ХА) впливає на рівень захворюваності та смертності й є стартовою ознакою «алергічного маршу» [3]. Для харчової гіперчутливості характерними тяжкі реакції з можливими летальними наслідками. Клінічні прояви ХА можуть бути ізольованими та виступати складовою частиною генералізованої анафілактичної реакції [4]. Найбільш загальною реакцією при ХА є шкірні прояви від гострої кропив’янки чи ангіоневротичного набряку до короподібного сверблячого висипання. Респіраторні прояви ХА характеризуються ринореєю, чиханням, свербінням очей, бронхоспазмом, набряком гортані. Порушення бронхіальної прохідності внаслідок виникнення хронічного персистуючого алергічного запалення бронхіального дерева [2], що визначає перебіг бронхіальної астми (БА), є однією з найчастіших клінічних ознак ХА, коли провокуючими факторами є компоненти їжі [5]. І незважаючи на те, що потенційними алергенами можуть бути численні види харчових продуктів та їх компоненти [6], насправді харчові алергічні реакції є результатом дії лише небагатьох із них [7]. Діагностика БА в ранньому віці складна та в більшості повинна ґрунтуватися на клінічній картині, оцінці симптомів і фізикальних даних [8–10]. Ефективним методом підтвердження діагнозу БА у дітей є пробна терапія бронходилататорами та інгаляційними глюкокортикостероїдами. Клінічне покращення під час лікування та погіршення після відміни свідчить про БА.
Результати та обговорення
Клінічна діагностика БА у дітей базується на виявленні таких симптомів, як епізодична експіраторна задишка, свистячі хрипи, стиснення у грудях, кашель. Діагностика БА у дітей, особливо в ранньому віці, має значні труднощі, тому що періодичні епізоди бронхіальної обструкції можуть бути проявом різної патології органів дихання (муковісцидоз, шлунково-стравохідний рефлюкс, сторонній предмет у трахеї та бронхах, вади розвитку, порушення функції ціліарного епітелію, стиснення середостіння збільшеним тимусом або пухлиною). Зважаючи на виявлені клінічні особливості перебігу БА на фоні ХА, видалося доцільним вивчити їх діагностичну цінність і показники епідеміологічного ризику як тести з виявлення замаскованої ХА при надходженні до стаціонару.
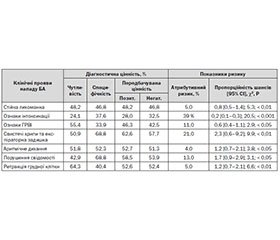
У табл. 1 наведені показники клініко-епідеміологічного ризику та діагностичної цінності окремих клінічних даних при надходженні дітей до стаціонару щодо виявлення в них замаскованої ХА.
Отже, жодній вивченій клінічній ознаці тяжкості бронхобструктивного синдрому (БОС) при надходженні дітей до стаціонару не притаманні достатня чутливість і/або специфічність у виявленні замаскованої ХА. Хоча й вірогідно, але незначно підвищувалися як атрибутивний ризик, так і пропорційність шансів у виявленні ХА в цих пацієнтів при наявності вивчених нами ознак, за винятком порушення свідомості та комбінації свистячих хрипів з експіраторною задишкою. Решта факторів, що входять до «Клінічної системи бальної оцінки обструкції дихальних шляхів у дітей раннього віку» [1], нами також оцінені, але вони виявилися ще менш специфічними та чутливими при статистично невірогідному зростанні ризику виявлення у пацієнтів замаскованої ХА.
Таким чином, у виявленні замаскованої ХА вищенаведені клінічні ознаки, взяті окремо, є непридатними. Тому запропоновано шляхом констеляції найбільш значимих показників сформувати три основні синдромологічні групи, які б відображали:
1) інтоксикацію — порушений стан свідомості, знижений м’язовий тонус, гепатоспленомегалію, тахікардію, що не відповідає підвищенню температури тіла;
2) гіпоксію — ціаноз, частоту дихання, вищу за вікову норму, аритмічне дихання, ретракцію грудної клітки, інспіраторні хрипи;
3) БОС — кашель, співвідношення «вдих/видих», перкуторно коробковий відтінок звуку, експіраторні свистячі хрипи.
У табл. 2 наведені динамічні показники тяжкості стану пацієнтів груп порівняння, оцінені за запропонованою констеляційною системою впродовж перебування у стаціонарі.
За констеляційною системою оцінки тяжкості стану дітей із БА виявлено, що у 1, 4 та 7-й дні перебування у стаціонарі тяжкість пацієнтів І групи була вірогідно вищою порівняно з однолітками, які входили до ІІ клінічної групи. Темпи покращення стану пацієнтів основної групи були більш швидкими, і на 4-ту добу перебування в клініці оцінка тяжкості загального стану зменшилась у середньому на 10 балів, а у пацієнтів ІІ групи — лише на 3,8 бала. Однак у подальшому зниження тяжкості стану відбувалося приблизно з однаковим темпом, хоча на 7-му добу госпіталізації стан пацієнтів І групи був тяжчим.
Нами досліджено відмінності у розподілі частоти випадків тяжкого стану пацієнтів груп порівняння на 1-шу, 4-ту і 7-му добу щодо середнього для них бального показника тяжкості. Так, на 1-й день середній показник тяжкості загального стану пацієнтів І групи становив 18,3 ± 1,9 бала. Кількість пацієнтів, стан яких оцінювався у 18 і більше балів, у І групі дорівнювала 53,6 ± 4,7 %, у ІІ групі — 42,2 ± 3,7 % спостережень (Р < 0,05). Показники клініко-епідеміологічного ризику наявності замаскованої ХА у дітей, стан яких на 1-шу добу дорівнював 18 балів і вище, були такими: AR = 12 %, RR — 1,27 (95% CI 1,0–1,6) i OR — 1,58 (95% CI 0,9–2,7), χ2 = 3,1, Р < 0,05. На 4-ту добу лікування тяжчим вважали стан дітей І групи із середнім показником 10,1 ± 1,5 бала. Кількість пацієнтів І групи, тяжкість загального стану яких на 4-й день оцінювалася у 10 балів і вище, становила 53,6 ± 4,7 %, а у ІІ групі таких дітей було 27,5 ± 4,3 % (Р < 0,05). Показники клініко-епідеміологічного ризику виявлення замаскованої ХА у таких пацієнтів були ще більш значущими і дорівнювали: AR — 27 %, RR — 1,68 (95% CI 1,2–2,4), OR — 3,04 (95% CI 1,8–5,3), χ2 = 17,0, P < 0,001. На 7-му добу перебування у стаціонарі середній показник тяжкості загального стану пацієнтів І групи був 5,1 ± 0,6 бала, тому нами оцінені відмінності у розподілі показника тяжкості, що дорівнював 6 балам. Так, на 7-му добу лікування пацієнтів із оцінкою у 6 балів і вище в І клінічній групі було 58,9 ± 4,6 %, у ІІ групі — 42,2 ± 4,7 % (Р < 0,05). Показники епідеміологічного ризику виявлення замаскованої ХА у дітей, хворих на БА, тяжкість загального стану яких на 7-му добу оцінювалася в 6 балів і вище, такі: AR — 17 %, RR — 1,4 (95% CI 1,1–1,8), OR — 1,97 (95% CI 1,1–3,4), χ2 = 7,5, P < 0,01.
Слід зауважити, що у дітей із ХА, перебіг БА характеризується також більшою і тривалішою тяжкістю загального стану при більш швидких темпах дезобструкції, що характеризується переважанням пацієнтів із показниками бальної оцінки, вищими за середньогрупові на 4-й і 7-й дні госпіталізації. Можливо, це відображує відносну резистентність цих пацієнтів до традиційного лікування без урахування необхідності проведення елімінаційних заходів.
Нами вивчено діагностичну цінність щодо виявлення ХА-компонентів умовно виділених нами клінічних симптомокомплексів. Так, найбільшим ризиком наявності замаскованої ХА серед ознак гіпоксії при надходженні до стаціонару виявлялися ознаки інспіраторної задухи. Зокрема, AR становив 28 %, RR — 0,5 (95% CI 0,3–0,9), OR — 0,3 (95% CI 0,2–0,6), χ2 = 3,6, Р < 0,05. Серед ознак умовно названого інтоксикаційного синдрому тахікардія мала такі показники епідеміологічного ризику наявності ХА: AR = 24 %, RR = 1,5 (95% CI 1,0–2,3), OR = 2,74 (95% CI 1,5–4,9), χ2 = 6,9, Р < 0,01. Серед показників бронхіальної обструкції найбільші діагностичні значення у виявленні ХА мала наявність експіраторних сухих хрипів: AR = 40 %, RR = 2,1 (95 % CI 1,4–3,3), OR = 5,6 (95 % CI 3,0–10,5), χ2 = 32,7, Р < 0,001.
Оцінка умовно виділених нами симптомокомплексів, що зумовлювали тяжкість загального стану, в динаміці лікування дозволила дійти висновку, що, зокрема, діагностична та епідеміологічна значущість гіпоксемічного синдрому у виявленні ХА збільшувалася в динаміці лікування (табл. 3).
Отже, у процесі лікування наявність гіпоксемії як тесту у виявленні ХА зменшувала свою чутливість, натомість зростали та набували вірогідності такі її якості, як специфічність, передбачувана цінність та показники клініко-епідеміологічної значущості. Це дозволяє припустити, що наявність на 7-му добу лікування ознак гіпоксемії у хворих на БА пацієнтів із достатньою специфічністю свідчить на користь присутності причинно-значущого алергену, який підтримує збереження тяжкості загального стану. Одним із таких алергенів слід вважати харчовий алерген, що вимагає корекції традиційної терапії нападного періоду БА.
Аналогічні закономірності виявлені нами щодо тяжкого БОС, який характерний для БА, тобто для хворих дітей І та ІІ груп у процесі лікування. Показники клініко-епідеміологічного ризику та діагностичної значущості у виявленні ХА ознак бронхіальної обструкції в динаміці лікування наведені в табл. 4.
Таким чином, як і при оцінці гіпоксемічних ознак, під час лікування БОС як тест у виявленні ХА поступово втрачав чутливість та набував специфічності й вірогідності, хоча показники епідеміо-логічного ризику зменшувалися. На нашу думку, це пов’язано з позитивними клінічними зсувами у перебігу нападу БА під впливом традиційної дезобструктивної терапії, що зменшувало діагностичну значущість БОС у виявленні ХА, а велика частка як хибно позитивних, так і хибно негативних результатів даного тесту на 4-ту і 7-му добу госпіталізації на дозволяє використовувати його у виявленні ХА.
Водночас вірогідне клініко-епідеміологічне значення у виявленні ХА ознаки умовно названого інтоксикаційного синдрому (порушення свідомості, м’язова гіпотонія, тахікардія, гепатоспленомегалія) мали лише на 4-ту добу перебування у стаціонарі. Так, як тест із виявлення ХА, цей синдром на 4-ту добу лікування мав такі показники ризику: Se — 63,4 %, Sp — 48,6 %, PV(+) — 55,9 %, PV(–) — 56,1 %, Acc — 56,1 %, Prev — 50,7 %, AR = 12 %, RR = 1,27 (95% CI 1,0–1,6), OR = 1,6 (95% CI 1,0–2,7), χ2 = 4,3, Р < 0,05. Але як і у попередніх випадках, на 7-му добу лікування специфічність цього тесту з виявлення ХА зросла до 83,5 %, а чутливість зменшилась до 21,4 %, позитивна передбачувана цінність становила 57,1 %, негативна — 50,8 %, точність методу — 52,0 %, поширеність — 50,7 %.
Тобто для І групи характерною була більш швидка дезобструкція у поєднанні зі збереженням синдромів інтоксикації, бронхообструктивного та гіпоксії, що, можливо, пояснювалося впливом трофалергенів при невиявленій ХА в дітей, які не отримували елімінаційної дієти. На нашу думку, саме цим і можна було пояснити високу специфічність у виявленні замаскованої ХА наявності цього клінічного симптомокомплексу впродовж лікування у госпіталі.
Ознаки інтоксикаційного синдрому та/або гіпоксемії, що зберігаються в процесі лікування пацієнтів, хворих на БА, можуть із достатньою специфічністю та посередньою точністю використовуватися як тести з виявлення замаскованої ХА. Це, на нашу думку, вимагає проведення поетапної (на 4-й і 7-й день) оцінки тяжкості загального стану хворих за констеляційною бальною системою для розв’язання питання про можливість причинної ролі у розвитку БОС ХА і відповідної корекції лікувальної тактики.
Висновки
1. У виявленні замаскованої ХА окремі клінічні ознаки стали непридатними.
2. У дітей із ХА перебіг БА характеризується більшою і тривалішою тяжкістю загального стану при більш швидких темпах дезобструкції,
3. Ознаки інтоксикаційного синдрому та/або гіпоксемії, що зберігаються в процесі лікування пацієнтів, хворих на БА, можуть із достатньою специфічністю та посередньою точністю використовуватися як тести з виявлення замаскованої ХА.

/16.jpg)
/17.jpg)