Статья опубликована на с. 106-111
Дисциркуляторная энцефалопатия (ДЭ) — синдром хронического прогрессирующего поражения головного мозга сосудистой этиологии, который развивается в результате повторных острых нарушений мозгового кровообращения и/или хронической недостаточности мозгового кровоснабжения. На сегодняшний день установлено, что при хроническом прогрессирующем поражении мозга в первую очередь страдает метаболизм ацетилхолина, что проявляется нарушением таких когнитивных функций, как память, интеллект, праксис, гнозис, речь и внимание. Также многочисленными исследованиями доказана значительная роль метаболического синдрома (МС) в возникновении и прогрессировании сосудистых когнитивных нарушений.
10–11 сентября в Киеве состоялся Международный конгресс «Человек и лекарство — Украина», в рамках которого были рассмотрены актуальные вопросы клиники, диагностики и фармакотерапии различных заболеваний у людей пожилого возраста. В том числе рассматривался вопрос оказания помощи пациентам с дисциркуляторной энцефалопатией и метаболическим синдромом.
С докладом «Холинергическая стратегия лечения когнитивных нарушений при дисциркуляторной энцефалопатии и метаболическом синдроме» выступила Копчак Оксана Олеговна (ГУ «Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины»).
Развитие когнитивных нарушений у людей пожилого и старческого возраста является одной из наиболее актуальных проблем современной нейрогериатрии и ведущей причиной инвалидизации населения этих возрастных групп вследствие развития деменции. На сегодняшний день в мире насчитывается 24,3 миллиона человек с деменцией, а ежегодный прирост данной патологии составляет 4,6 млн новых случаев (Ferri C.P. et al., 2005; Kolaria R.N. et al., 2008). По данным Всемирной организации здравоохранения, к 2020 году количество пациентов, страдающих деменцией, увеличится вдвое, к 2050 году — возрастет втрое и превысит 115 миллионов, причем 70 % из этого количества составят жители развивающихся стран.
Деменция — тяжелое бремя для экономики государства. Так, в США ежегодно на лечение и реабилитацию пациентов, страдающих деменцией, выделяется 604 млрд долларов, что составляет 1 % ВВП; лечение одного больного обходится в сумму от 18 500 до 27 000 долларов в год (Prince M. et al., 2013).
Синдром деменции связывают с целым рядом состояний. К наиболее часто встречающимся вариантам деменции относятся болезнь Альцгеймера (70 %), сосудистая деменция (20 %), деменция с тельцами Леви (5 %) и фронтотемпоральная деменция (5 %). В исследовании, проведенном J.V. Bowler (2012), было показано, что сочетание цереброваскулярных факторов и нарушение таких когнитивных функций, как память, интеллект, праксис, гнозис, речь и внимание, позволяет говорить о «сосудистых когнитивных нарушениях».
В 2004 году J. Touchon, R. Peterson были предложены модифицированные диагностические критерии синдрома умеренных когнитивных нарушений:
— когнитивные нарушения со слов пациента и/или его ближайшего окружения (последнее важнее);
— признаки ухудшения когнитивных способностей в сравнении с индивидуальной нормой для данного индивида, появившиеся в последнее время;
— объективные признаки когнитивных нарушений, полученные с помощью нейропсихологических тестов (снижение результатов нейропсихологических тестов не менее чем на 1,5 стандартного отклонения от среднестатистической возрастной нормы);
— отсутствие нарушений обычных для пациентов форм повседневной активности, однако трудности в выполнении сложных видов деятельности;
— отсутствие деменции при результате по MMSE не менее 24 баллов.
Также актуальной проблемой современной медицины является метаболический синдром, что определятся его высокой распространенностью (до 40 %) среди взрослого населения в развитых странах мира. В настоящее время, согласно данным ВОЗ, 300 млн человек имеют избыточную массу тела и 30 % населения планеты страдают от ожирения. Данная патология приводит к повышению риска развития сахарного диабета и артериальной гипертензии в 3–6 раз и к увеличению числа сердечно-сосудистых заболеваний и смертности от них в 2–3 раза. Кроме того, наличие метаболического синдрома существенно увеличивает риск возникновения сосудистой деменции и болезни Альцгеймера.
Патогенетические механизмы возникновения когнитивных расстройств при метаболическом синдроме носят сложный (смешанный) характер и заключаются в сочетании гипергликемии, альцгеймеровских, возрастных изменений (в том числе и отложение β-амилоида) и изменений сосудистых, обусловленных поражением как крупных, так и мелких церебральных сосудов. У некоторых больных ведущими являются альцгеймеровские изменения, что в конечном итоге реализуется клинической картиной болезни Альцгеймера, у других — сосудистые, что проявляется клиникой сосудистой деменции.
Наличие метаболического синдрома диагностируют при наличии у пациента трех и более из нижеперечисленных критериев (Alberti K.G. et al., 2009):
— артериальная гипертензия (АД > 130/80 мм рт.ст.) или прием гипотензивных лекарственных средств;
— ожирение (окружность талии более 94 см у мужчин и более 80 см у женщин);
— дислипидемия (повышение уровня триглицеридов сыворотки крови ≥ 1,7 ммоль/л или нормальный уровень триглицеридов при соответствующей терапии; снижение липопротеидов высокой плотности менее 1 ммоль/л для мужчин и менее 1,3 ммоль/л для женщин либо нормальный уровень ЛПВП при соответствующей терапии);
— повышение уровня глюкозы плазмы крови ≥ 5,6 ммоль/л или терапия при гипергликемии.
С учетом сложности сочетания дисциркуляторной энцефалопатии, метаболического синдрома и развития на этом фоне сосудистых когнитивных нарушений основные задачи эффективной фармакологической терапии должны быть направлены на замедление прогрессирования когнитивных нарушений, уменьшение степени их тяжести и вторичную профилактику. Реализация этих задач осуществляется посредством влияния на основной патологический процесс — лечения цереброваскулярных заболеваний; выявления и коррекции сосудистых факторов риска: артериальной гипертензии (гипотензивные препараты), гипер- и дислипидемии (диета, статины, фибраты, никотиновая кислота); гипергликемии (сахароснижающие препараты); ожирения (диета, хирургическое вмешательство); гипергомоцистинемии (витамины В6, В12, фолиевая кислота); предупреждения ишемических эпизодов (антиагреганты и антикоагулянты). Также необходимо проведение терапии сопутствующей соматической патологии: кардиоваскулярных заболеваний, сердечной недостаточности, депрессии. Кроме того, важным звеном лечения является назначение лекарственных средств, действие которых направлено на улучшение когнитивных функций. К основным группам препаратов, применяющихся в лечении сосудистых когнитивных нарушений, относятся лекарственные средства с вазоактивным, нейротрофическим и нейрометаболическим действием и препараты, действие которых направлено на нейротрансмиттерные системы головного мозга.
На сегодняшний день признано, что наиболее перспективным направлением в лечении когнитивной дисфункции является воздействие именно на систему нейротрансмиттеров головного мозга. Согласно данным современных исследований установлено, что ацетилхолин — один из наиболее важных нейромедиаторов в системе обеспечения когнитивных функций. Наибольшее количество холинергических нейронов располагается в области базальных ганглиев, в частности в области ядра Мейнерта, где они составляют примерно 90 %. Базальные ганглии обеспечивают холинергическую иннервацию коры больших полушарий, являясь связующим звеном между лимбико-паралимбической системой и неокортексом. Также установлено, что увеличение концентрации ацетилхолина в мозге способствует росту нейронов и увеличению числа синапсов.
Известны два класса медикаментозных препаратов, действие которых направлено на преодоление холинергической недостаточности:
1) препараты, непосредственно восполняющие дефицит ацетилхолина, — нейромедиаторный препарат центрального действия холина альфосцерат (Глиатилин), являющийся прекурсором ацетилхолина, проходящий через гематоэнцефалический барьер;
2) ингибиторы ацетилхолинэстеразы (ИАХЭ) — донепезил, ривастигмин, галантамин.
В ходе клинических исследований был выявлен нейропротекторный эффект ингибиторов ацетилхолинэстеразы, приводящий к замедлению прогрессирования болезни Альцгеймера и сосудистой деменции. Тем не менее клиническая польза, а также экономическая эффективность применения ИАХЭ незначительны и, как показали некоторые исследования, имеют сомнительную клиническую значимость. Одной из главных проблем терапии ингибиторами ацетилхолинэстеразы является динамическое (зависимое от времени) снижение эффективности лечения. Еще одна проблема заключается в том, что лечение ингибиторами ацетилхолинэстеразы противопоказано пациентам определенных категорий (люди старческого возраста — старше 85 лет, пациенты с брадикардией, бронхиальной астмой или хронической обструктивной болезнью легких). Применение ингибиторов ацетилхолин–эстеразы в дозировках, обладающих большей эффективностью (высокие дозы), также связано с возможным развитием побочных эффектов, включая брадикардию, которая относительно широко распространена при данных обстоятельствах.
Согласно данным клинических исследований, перспективным препаратом для лечения сосудистых когнитивных нарушений является холина альфосцерат (Глиатилин).
Холина альфосцерат является предшественником ацетилхолина и фосфатидилхолина. При попадании в организм холина альфосцерат расщепляется под действием ферментов на холин и глицерофосфат. Холин участвует в биосинтезе ацетилхолина — одного из основных медиаторов нервного возбуждения, который играет ключевую роль в формировании интегративных когнитивных функций. Глицерофосфат является предшественником фосфатидилхолина мембран нейронов и выполняет, таким образом, нейропротекторную и мембраностабилизирующую роль. Кроме того, доказано, что Глиатилин положительно влияет на функциональное состояние микроструктур клеток, нормализует передачу нервных импульсов, потенцирует анаболические процессы в нейронах (рис. 1).
/108.jpg)
Глиатилин устраняет центральную холинергическую недостаточность, что при инсультах и черепно-мозговых травмах позволяет восстановить двигательную функцию пациентов; при дисциркуляторной энцефалопатии, сосудистой деменции, болезни Альцгеймера — восстановить продуктивное мышление; при сопоре и коме оказывает пробуждающий эффект.
Итальянскими учеными Francesco Amenta et al. (2010) был проведен обзор научных данных, касающихся клинической эффективности холина альфосцерата, применяющегося для лечения деменции. Эти данные были получены в ходе тринадцати клинических исследований с участием 4054 пациентов с ишемическим инсультом, с различными формами сосудистой деменции, в том числе альцгеймеровского типа, а также при лечении острых нарушений мозгового кровообращения (ТИА, инсульт). Результаты этих исследований продемонстрировали положительное влияние препарата Глиатилин на когнитивные функции у обследуемых больных в сравнении со стандартной терапией и плацебо. Отмечалось достоверное улучшение памяти, внимания, эмоционального фона. Также наблюдалась положительная динамика в коррекции поведенческих расстройств и уменьшение функционального ограничения повседневной активности.
Эффективность Глиатилина в восстановлении нарушенных функций, вызванных острым нарушением мозгового кровообращения (ОНМК), была подтверждена в многоцентровом плацебо-контролируемом исследовании Д. Барбагалло и соавт., проведенном в 176 неврологических центрах Италии с участием 2058 пациентов. Препарат назначался в дозе 1000 мг в/м ежедневно в течение 28 дней с последующим пероральным приемом 1200 мг в сутки в течение 5 месяцев. По данным диффузионно-взвешенной MРT было установлено, что уменьшение объема дефекта мозговой ткани при лечении Глиатилином достигается в течение месяца. После полугодового курса терапии отмечалось восстановление неврологического дефицита и способности больных к самообслуживанию. При этом на протяжении 6 месяцев у более чем 2000 пациентов не было обнаружено побочных гемодинамических эффектов: влияния на сердечный ритм, давление.
В Европе было проведено двойное слепое многоцентровое клиническое исследование ASCOMALVA, в котором оценивалась эффективность комбинированного применения ингибитора холинэстеразы донепезила и холинергического предшественника холина альфосцерата у пациентов, страдающих болезнью Альцгеймера, при наличии ишемических очагов поражения в головном мозге по данным МРТ. Исследование проходило на базе специализированных клинических центров в Италии с участием 210 пациентов. В 2012 году представлены промежуточные результаты после года терапии, в 2014 году — конечные. На их основании авторами был сделан вывод, что терапия на основе холина альфосцерата, максимально полно устраняя холинергический дефицит, оказывает выраженный клинический эффект в восстановлении когнитивных и двигательных функций, способности к самообслуживанию у пациентов с перенесенным ишемическим поражением головного мозга. Промежуточные результаты исследования ASCOMALVA и клинического наблюдения продемонстрировали, что комбинированное применение холинергических препаратов — холина альфосцерата и донепезила — замедляет прогрессирующее снижение терапевтического ответа, которое является распространенной проблемой в случае долгосрочного лечения ингибиторами ацетилхолинэстеразы.
Целью нашего исследования была оценка эффективности применения Глиатилина в лечении умеренных сосудистых когнитивных нарушений у пациентов с дисциркуляторной энцефалопатией и метаболическим синдромом.
В исследование было включено 80 больных среднего и пожилого возраста (в среднем 64,3 ± 6,6 года) с ДЭ и МС, которые в зависимости от назначенной терапии были разделены на две группы: основную (n = 40) и контрольную (n = 40), равнозначные по возрасту и полу, уровню образования, степени когнитивных нарушений и неврологического дефицита.
У всех пациентов клинический диагноз формулировался как дисциркуляторная энцефалопатия атеросклеротической, гипертонической, дисметаболической, а чаще смешанной этиологии. Всем пациентам проводили клинико-неврологическое обследование, общие лабораторные тесты (общий анализ крови, общий анализ мочи, биохимический анализ крови, липидограмму), инструментальные исследования (ЭЭГ, дуплексное сканирование брахиоцефальных сосудов, МРТ).
С целью оценки степени когнитивных нарушений использовали краткую шкалу оценки психического статуса (Mini Mental State Examination — MMSE). Дополнительно состояние когнитивных функций пациентов оценивали с использованием ряда современных экспериментально-психологических тестов: методики заучивания 10 слов (исследование процессов запоминания, сохранения и воспроизведения информации); теста заучивания парных взаимосвязанных слов (PALT) (исследование немедленной и отсроченной отличительной памяти на вербальные стимулы), таблицы Шульте (определение темпа сенсомоторных реакций, умственной работоспособности, объема активного внимания пациентов), теста цвето-словесного взаимодействия (the Stroop Color — Word Interference Test/ SСWT) (оценка скорости процессов обработки информации и внимания, отражающей функционирование передней поясной извилины). До и после применения препарата оценивались коэффициенты спектральной мощности — соотношение различных диапазонов частот: альфа/тета, альфа/дельта, альфа/(тета + дельта), (альфа + бета)/(тета + дельта).
Все больные основной группы получали Глиатилин по 4 мл внутривенно струйно в течение 9 дней, с последующим переходом на пероральный прием по 400 мг 2 раза в сутки в течение 1 месяца на фоне стандартной терапии, включавшей гипотензивные средства, сахароснижающие препараты, статины, антиагреганты. Пациенты контрольной группы получали стандартную терапию. Курс лечения больных длился 6 недель.
Больные после завершения курса лечения Глиатилином отмечали значительное уменьшение общей слабости, улучшение памяти, сна, уменьшение головной боли, головокружения, шума в ушах, шаткости при ходьбе. При этом наблюдали достоверное увеличение балла по данным ММSE: с 25,1 до 26,8 балла (p < 0,001), что указывало на уменьшение выраженности у них сосудистых когнитивных расстройств.
В контрольной группе также выявлено увеличение балла по данным ММSE с 24,7 до 25,3 (p < 0,05), однако при сравнении результатов терапии в обеих группах эффективность лечения Глиатилином была достоверно более высокой (p < 0,001).
У пациентов контрольной группы на фоне проведенной терапии наблюдали достоверное повышение показателей кратковременной вербальной и семантической памяти (с 26,60 ± 4,59 до 30,30 ± 5,67, p < 0,05), объема немедленной (с 16,30 ± 3,54 до 19,70 ± 4,39, p < 0,01) и отсроченной памяти (с 32,30 ± 5,51 до 40,50 ± 8,01, p < 0,01) по методике PALT. Изменения других экспериментально-психологических показателей были недостоверными.
У пациентов на фоне терапии Глиатилином (рис. 2) отмечено достоверное улучшение показателей кратковременной вербальной и семантической памяти по методике заучивания 10 слов по сравнению с таковыми до лечения (с 31,80 ± 5,03 до 41,70 ± 5,49, р < 0,001).
Достоверно увеличился объем немедленной памяти (с 22,70 ± 3,77 до 28,80 ± 3,35, р < 0,001) и отсроченной памяти (с 50,30 ± 7,45 до 57,70 ± 6,58, р < 0,001) по методике PALT. Также после проведенного лечения у больных отмечено значительное возрастание скорости процессов обработки информации, внимания (с 65,80 ± 10,83 до 83,50 ± 14,01, р < 0,001) по методике SCWT; зарегистрировано достоверное увеличение темпа сенсомоторных реакций по таблицам Шульте (с 217,80 ± 13,06 до 195,60 ± 17,14, р < 0,001).
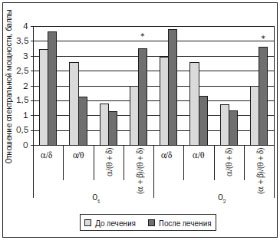
После лечения препаратом Глиатилин у большинства пациентов наблюдалось улучшение электроэнцефалограммы в виде повышения частоты и амплитуды альфа-ритма, формирования доминирующего пика мощности альфа-ритма и уменьшения выраженности дельта- и тета-ритмов на спектрограмме. У больных на фоне терапии Глиатилином наблюдалось достоверное увеличение коэффициентов спектральной мощности альфа/дельта, альфа/(тета + дельта) и (альфа + бета)/(тета + дельта) во всех лобных отведениях.
Также вследствие лечения Глиатилином (рис. 3) в центральных отведениях слева и справа отмечено достоверное увеличение коэффициентов спектральной мощности альфа/дельта и (альфа/бета)/(тета + дельта). В это же время в париетальных отведениях зарегистрировано достоверное увеличение лишь коэффициента спектральной мощности (альфа/бета)/(тета + дельта).
В височных отведениях зарегистрировано достоверное увеличение коэффициентов спектральной мощности альфа/дельта и (альфа + бета)/(тета + дельта) в Т3- и Т4-отведениях, а также увеличение коэффициента спектральной мощности (альфа + бета)/(тета + дельта) в Т5- и Т6-отведениях (рис. 4).
В затылочных отведениях (рис. 5) справа и слева на фоне терапии отмечено достоверное увеличение коэффициента спектральной мощности (альфа + бета)/(тета + дельта).
Таким образом, лечение с применением препарата Глиатилин на фоне стандартной терапии позитивно влияло на общее состояние пациентов. Отмечалось уменьшение выраженности когнитивного дефицита по данным MMSE, что проявлялось в улучшении скорости запоминания, обработки и воспроизведения информации, немедленной и отсроченной распознавательной памяти, уровня умственной работоспособности и внимания, темпов сенсомоторных реакций, что подтверждалось результатами нейропсихологического тестирования. Под влиянием препарата Глиатилин достоверно уменьшились коэффициенты спектральной мощности быстрых ритмов по отношению к медленным в большинстве отведений, что свидетельствует о позитивном влиянии курсового применения Глиатилина на функциональное состояние головного мозга.
Препарат переносился хорошо, на фоне терапии Гиатилином у пациентов не обнаружено побочных эффектов, что позволяет рекомендовать препарат для широкого применения в комплексной терапии умеренных когнитивных нарушений у пациентов с дисциркуляторной энцефалопатией и метаболическим синдромом.
/109.jpg)
/111.jpg)

/108.jpg)
/110.jpg)