Международный неврологический журнал 8 (70) 2014
Вернуться к номеру
Инновационные биотехнологии в медицинской реабилитации детей с церебральным параличом
Авторы: Евтушенко С.К., Попандопуло А.Г., Евтушенко О.С.
ДонНМУ им. М. Горького
ИНВХ НАМН Украины им. В.К. Гусака, г. Донецк
Донецкий областной детский клинический центр нейрореабилитации
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 13-18
Доклад проф. С.К. Евтушенко был представлен 30 октября 2014 г. в Москве (Россия) на IV Международном конгрессе «Детский церебральный паралич и другие нарушения движения у детей» и на II научно-практической конференции с международным участием «Трансплантація: сьогодення, минуле та майбутнє» 7 ноября 2014 г. в Киеве (Украина).
Уважаемые коллеги!
В мире нет страны, где не был бы зафиксирован церебральный паралич (ЦП) у детей. Вместе с тем Американская академия церебрального паралича отмечает, что рост его распространенности обусловлен и достижениями современной медицины (в частности, высокими технологиями родовспоможения). Внедрение концепции ВОЗ — «500 г — жизнеспособный плод» в определенной степени также этому способствовало. Высокие технологии коснулись как медицинской, так и социальной реабилитации детей с ЦП. Но, к сожалению, медицинская реабилитация существенно отстает от социальной.
Методики Войты, Бобатов стали общеизвестными. Европейское признание получила методика проф. К.А. Семеновой (Россия) — применение антигравитационных костюмов, а также методика проф. В.И. Козявкина (Украина) — система интенсивной нейрофизиологической реабилитации.
И все же будущее реабилитации детей с ЦП — это симбиоз медицинской и социальной реабилитации, поскольку ЦП — полиэтиологическое заболевание.
Улучшение моторных, речевых и когнитивных функций благодаря применению современных интенсивных технологий у данной категории больных и есть основная задача медицинской реабилитации.
Научная гипотеза нашего сообщения: базируясь на выявлении основных этиологических факторов церебрального паралича, воплотить в современную нейрореабилитацию научную парадигму: «от достоверной диагностики этиологии церебрального паралича — к его эффективному лечению и реабилитации».
Обоснование. Утвердилось долговременное понятие в международной классификации ЦП как синдрома болезни с известной клиникой и не всегда известной этиологией, и только в странах постсоветского пространства по-прежнему употребляется термин ДЦП — синоним болезни и окончательного диагноза.
А ведь классификация церебральных параличей у детей по МКБ-10 обозначает другие понятия:
G 80.0 — Спастический церебральный паралич (двойная гемиплегия, тетраплегия)
G 80.1 — Спастическая диплегия (синдром Литтля)
G 80.2 — Детская гемиплегия (гемиплегическая форма)
G 80.3 — Дискинетический церебральный паралич (дистонический, гиперкинетический)
G 80.4 — Атактический церебральный паралич (атонически-астатическая форма)
G 80.8 — Другой вид ЦП (смешанные формы)
G 80.9 — Церебральный паралич у детей неуточненный
Вместе с тем З. Фрейд (1931), Войта (1992), M. Bax (1998) уже много лет назад выделяли врожденную форму ЦП. Сегодня под врожденной (но не генетически обусловленной) формой ЦП понимается форма, которая проявляется с момента рождения, чаще у недоношенных и маловесных детей, стигматизированных и чаще родившихся от матерей с патологически протекающей беременностью по разным причинам (с длительным бесплодием; 3 и более спонтанными выкидышами в анамнезе; соматической патологией и др.), а также с наличием у близких или дальних родственников различной психоневрологической патологии, включая ЦП.
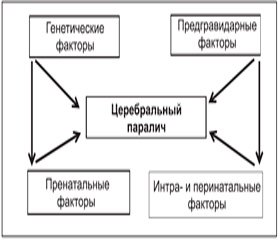
Роль генетических и мутантных микро- и макроаномалий (дисплазия, микро- и пахигирия, гетеротопия, кистозная дегенерация и др.) является установленным фактором в возникновении эпилепсии (75 % случаев), слабоумия (65 %), ЦП (64 %) и задержки психоречевого развития (52 %). На рис. 1 схематически представлены факторы риска.
На протяжении ряда лет в Донецком областном клиническом центре нейрореабилитации проводили исследования роли иммуногенетической предрасположенности у детей с церебральным параличом (в частности, изучалась роль комплекса гистосовместимости HLA у матерей и их детей с ЦП). В литературе имеются сообщения о связи данного комплекса с рядом других заболеваний (табл. 1).
При проведении О.С. Евтушенко (1999–2009) иммуногенетического скрининга (НLА-антигены) у детей с ЦП обнаружено семь ведущих антигенов: А11, В5, В7, В12, В18, В22, В40. Антигены В5, В7, В12 имели положительную ассоциацию. Антигены А11, В18, В22, В40 имели отрицательную ассоциацию с популяцией больных детей. Первая группа — НLА-антигены «протекторы-защитники» — А11, В18, В22, В40; вторая группа — НLА-антигены «агрессоры» — В5, В7, В12, играющие агрессивную (провоцирующую) роль в патогенезе церебрального паралича.
Но под маской церебрального паралича скрываются и другие заболевания (табл. 2). Особенно этот факт подчеркнут на 65-й сессии Американской академии церебрального паралича, проходившей в Лас-Вегасе (США, октябрь 2011). Автор доклада как член Американской академии церебрального паралича принимал участие в работе этой сессии.
На основании многолетних исследований и данных литературы нами резюмированы базисные факторы, лежащие в основе ЦП у детей.
Обобщенные основные этиологические факторы и формы церебрального паралича (С.К. Евтушенко, 1994, 2003, 2010)
1. Церебральный паралич как результат гипоксически-асфиксического и травматического поражения головного мозга, включая (интра- и постнатальную) перивентрикулярную лейкомаляцию — 45 %.
2. Врожденная форма (как следствие генетических мутаций, различных мальформаций мозга и сосудов, нейрональных микродисплазий, патологического спраутинга, внутриутробной перивентрикулярной лейкомаляции и trans mantle) — 18 %.
3. Церебральный паралич как следствие инфекционных, интоксикационных, метаболических и других факторов — 17 %.
4. Идиопатическая (криптогенная) форма церебрального паралича — 19 %.
В определенной степени наши выводы ассоциируются с высокоинтеллектуальными высказываниями неврологов прошлых лет. В частности, в учебнике «Нервные болезни» (Москва, 1930) в главе о детском церебральном параличе сказано: «Под этим названием подразумевают все случаи болезней головного мозга, возникшие или еще во внутриутробной жизни, или в момент родов, или в самом раннем детстве! Анатомический субстрат болезни: повреждение мозга во время трудных родов и различные темные в своей сущности заболевания зародыша! Клиническая картина также довольно разнообразна и во всяком случае не укладывается в рамки одного типа». И это 1930 год! Возникает мысль: мы до сих пор не знаем, что лечим!
В связи с проведенными нами исследованиями, опираясь на мировой и отечественный опыт, мы дали новую формулировку церебрального паралича у детей:
«Церебральный паралич — это возникшие (преимущественно не прогрессирующие) расстройства моторики, речи и когнитивных функций в незрелом или аномально развивающемся мозге ребенка на фоне иммуногенетической предрасположенности» (С.К. Евтушенко с соавт., 1990–2000 гг.)
Асфиксия, регистрируемая у новорожденных, часто является лишь продолжением внутриутробной гипоксии, сохраняя свое последующее пожизненное влияние в диапазоне от минимальных мозговых дисфункций до грубых двигательных расстройств, объединяемых под общим названием «церебральный паралич у детей».
Гипоксия и ишемия запускают каскадно-триггерные реакции нейронального повреждения, приводя к формированию цитотоксического и вазогенного отека головного мозга, выбросу прокоагулянтов и формированию деструктивных зон и невосстановленного кровотока в мозге.
Основные нейроморфологические проявления гипоксически-ишемических посттравматических повреждений головного мозга у доношенных новорожденных приведены в табл. 3.
Внутриутробная гипоксия, патологическая централизация мозгового кровообращения, асфиксия и гипокапния осложняются некрозом белого вещества мозга преимущественно вокруг передних рогов и тел боковых желудочков мозга — это и есть перивентрикулярная лейкомаляция (ПВЛ).
Пренатально ПВЛ возникает у 30 % детей, постнатально — у 30, сочетанно — у 18 и у 22 % время возникновения ПВЛ неизвестно.
О пренатальном генезе ПВЛ свидетельствуют кисты в белом веществе мозга при проведении МРТ в антенатальном периоде (Zupain V., 1996). 50 % новорожденных, имеющих ПВЛ, умирают в первые 5–7 суток после рождения.
При ПВЛ с локализацией в теменных областях и задних рогах высока вероятность возникновения диплегической формы ЦП.
При ПВЛ в лобных долях — ЦП + нарушения когнитивных функций и статики.
При ПВЛ в зрительных областях — ЦП + нарушение зрения.
При ПВЛ в височной области — ЦП + нарушение слуха, судорожный синдром, нарушение статики.
При ПВЛ в задних рогах и аплазии червя — атонически-астатическая форма.
При ПВЛ в гемисфере мозга — гемипаретическая форма ЦП, чаще всего без существенных нарушений других функций.
Обобщив литературные данные и проведя серию собственных исследований, внедрив новые технологии и модифицировав старые, мы разработали методику реабилитации de novo прежде всего ранних форм ЦП, а также устойчивых к проводимой терапии форм ЦП. Это потребовало создания учреждения нового типа, где лечатся не только дети с ЦП, но и дети с другими заболеваниями нервной системы (последствия апаллического синдрома, ПМД, последствия инсульта, нейроинфекций, патология спинного мозга с нарушением функции выделения и др.). Всего за 1988–2013 гг. пролечено 34 450 детей (табл. 4).
Во вновь организованном отделении раннего возраста (от 3 до 12 месяцев) Центра нейрореабилитации пролечено 1300 детей, среди которых 78 детей были рождены с использованием ЭКО, что составило 8 % от общего количества детей 1-го года жизни, находившихся на лечении в центре, у этих детей впервые выявлены аномалии развития головного мозга в 54,5 %.
Таким образом, проанализировав данные неврологического статуса в динамике у детей, рожденных с использованием ЭКО, сравнив их с контрольной группой, мы можем констатировать, что дети, рожденные с использованием ЭКО, отличались тяжестью основного заболевания. У детей данной группы в более раннем возрасте формировались тяжелые двигательные нарушения — спастические и смешанные тетрапарезы, отмечалась выраженная задержка всех видов развития, чаще наблюдались эпилептические синдромы.
И все же на первых местах в этиологии общей популяции ЦП стоят неблагоприятно протекающая беременность, применение агрессивных методов ведения родов (включая родовую травму), кровоизлияние в мозг, отек мозга и др. Достаточно частой причиной ЦП являются врожденные аномалии мозга (микрогирия, микроцефалия, лисэнцефалия, гипоплазия мозга и др.), влияющие в целом на внутриутробную ретардацию плода. С учетом огромных трудностей, с которыми и врач, и ребенок сталкиваются в реабилитации, особенно тонических форм ЦП, нами была внедрена новая технология в лечении данной категории больных.
Исходя из вышесказанного можно предположить, что из числа детей с ЦП наиболее приемлемыми кандидатами для применения клеточных технологий будут дети без признаков врожденных аномалий мозга и различных гетеротопий (по данным МРТ). Но наиболее перспективными (в плане прогнозируемого положительного эффекта от лечения) следует считать детей, родившихся с малым весом и бывших в гипоксии не более 2 часов, или из числа доношенных с гемиплегической формой ЦП (как результат перенесенного перинатального инсульта или перенесенной в/мозговой гематомы) без тяжело перенесенной гипоксии и отека мозга при нежелательной иммуногенетической предрасположенности.
Как известно, анатомическим зачатком нервной системы является медуллярная нервная трубка. В стенках ее размещаются однородные медуллобласты, которые далее (через нейробласты) дифференцируются на нейроны, нейроглию и эпендимоциты. Миелиновая оболочка в пределах центральной нервной системы формируется олигодендроцитами и шванновскими клетками. На пятом месяце внутриутробного периода появляются синапсы.
К моменту рождения головной мозг ребенка является незрелым, а тем более у преждевременно родившихся детей. Главным повреждающим, но не этиологическим фактором чаще всего и является гипоксия, которая приводит к ишемическому повреждению и некрозу мозга.
Но благодаря высоким компенсаторным возможностям, которые имеет незрелый мозг новорожденного, гипоксическое воздействие не всегда является разрушительным, поскольку мозг обладает целым рядом особенностей, оцениваемых как феномен самозащиты.
Незрелый (но не поврежденный) мозг в дальнейшем способен к ремиелинизации, т.е. клонированию нейронов и глии.
К феноменам, способствующим ремоделированию и ремиелинизации, можно отнести:
1. Повышенную толерантность развивающегося мозга к гипоксии (меньшее количество нейронов и синапсов) и меньшую зависимость от ионного насоса, потребляющего энергию.
2. Генетическую нейропластичность: мозг в ответ на повреждение и под влиянием нейротрофических факторов может образовывать новые нейробласты и осуществлять аутотрансплантацию незрелых нейронов в определенные отделы мозга. Прежде денервированные нейроны способны к реиннервации поврежденных структур.
3. При гипоксии происходит перераспределение кровотока за счет ауторегуляции в головном мозге (при этом он возрастает в стволе и спинном мозге, но ослабевает в белом веществе и в коре головного мозга) — известный феномен централизации мозгового кровообращения в ответ на гипоксию.
4. У недоношенных детей все болевые реакции внешне проявляются гораздо слабее, чем у доношенных. Это происходит благодаря запрограммированной в период первых часов после родов активации антиноцицептивной системы плода, что снижает возможность деструкции клеток.
Подобный феномен был образно назван проф. С.И. Бабкиным (1985) «гибернацией плода», т.е. замедлением обменных и сердечно-сосудистых процессов. Но продолжительная боль, перенесенная в период новорожденности (т.е. после выхода из гибернации), нарушает развитие системы ноцицепции и может привести к необратимым функциональным и структурным изменениям в ЦНС, тем самым изменяя программу ответа на боль в будущем.
Наша концептуальная модель возможности прогноза эффекта трансплантации стволовых клеток у детей в определенной степени была подтверждена практическими исследованиями. В период 2010–2011 гг. в иммунологической лаборатории «Биостем» ИНВХ НАМН Украины и на базе областного детского клинического центра нейрореабилитации по желанию родителей и с соблюдением юридического протокола проведена внутривенная трансплантация стволовых клеток детям с установленным диагнозом ЦП, преимущественно двойной гемиплегической формы — 3 детям в возрасте от 3 до 5 лет с перерывов в 3 месяца три курса по 25 млн клеток, 2 детям в возрасте 8 лет по 50 млн клеток № 3 с перерывом в 3 месяца, 3 детям в возрасте от 2 до 3 лет вводилось однократно 25 млн клеток. У одного ребенка в возрасте 8 лет с гемиплегической формой (последствия перинатального инсульта) после 3-кратного введения получено улучшение.
У 5 детей эффект был непродолжительным, но именно у них при повторном обследовании и выявлена полимикрогирия — 2 человека, гипоплазия мозга — 2 человека, у 1 — аномалия Арнольда — Киари.
Ретроспективно в период 2011–2012 гг. (т.е. после трансплантации стволовых клеток) уже была целенаправленно изучена возможная этиология ЦП и его формы.
Последующее наблюдение показало: только в группе детей в возрасте от 2 до 3 лет (2 чел.), родившихся преждевременно с малым весом (по данным МРТ, головной мозг был без аномалии развития), получен терапевтический эффект в виде улучшения моторных и когнитивных функций. Это и послужило основанием продолжать исследования в данном направлении. Катамнез наблюдения с учетом предыдущих исследований составил от 6 месяцев до 3 лет.
Для применения методологии лечения мезенхимальными аутостволовыми клетками уже в 2013–2014 гг. было отобрано 12 детей (из 32 кандидатов!) с церебральным параличом с двойной гемипаретической формой (7 мальчиков, 5 девочек в возрасте от 1 до 8 лет). Из них 2 детей после ЭКО. По данным МРТ, у всех детей аномалии развития мозга исключены! Также проведено тщательное вирусологическое обследование (ПЦР) на все 6 типов вируса герпеса и JVC-вирус. Проведено тщательное соматическое и иммунологическое обследование, включая исследование развернутой иммунограммы (С3, С4, С8, СД20, СД56,СД95+).
Контрольная группа составила 12 детей того же возраста, с аналогичными проявлениями ЦП и соответствующей тяжестью.
При лечении использована аутологическая культура мультипотентных мезенхимальных стромальных клеток, полученных под местной анестезией губчатого костного мозга пациента (лаборатория биотехнологий ИНВХ АМНУ сертифицирована МЗ Украины). Выделение клеточного материала проводилось по методике градиентного центрифугирования. Полученную клеточную культуру идентифицировали согласно рекомендации ISCT (2006). В последующем культивировали в специальной питательной среде. Маркированы стволовые клетки (CD105, CD73, CD90+, CD45, CD34, CD14, HLADR). Культурную смесь вводили в/в капельно, в зависимости от веса ребенка от 25 до 50 млн с повторением через 2–3 недели.
Динамика соответствовала шкалам оценки тяжести в возрасте от 1 года до 2 лет. Использована шкала INFANIB (Infant Neurological International Battery, 1995), которая предусматривает тестирование по 20 пунктам с оценкой от 0 до 5 баллов. Три диапазона — «патология», «транзиторное нарушение», «норма».
В возрасте старше 2 лет применяли шкалу GMFCS (Gross Motor Function Classification System for Cerebral Palsy): уровень 1 — ходьба без ограничений; уровень 2 — ходьба с ограничением; уровень 3 — ходьба со вспомогательными средствами; уровень 4 — самостоятельное передвижение ограничено; уровень 5 — самостоятельное передвижение невозможно. У всех наблюдаемых больных старше 2 лет тяжесть соответствовала 3–5 баллам. Контрольный осмотр показал: состояние без изменения и без ухудшения отмечалось у 5 детей, у 4 детей — четкое улучшение моторики, у 3 улучшена моторика и функция речи. Эти улучшения соответствовали 3 баллам GMFCS.
Но наиболее корректно введение аутологичных клеток сказалось на улучшении когнитивных функций и речи, в меньшей степени — на мышечном тонусе.
Первый опыт аутотрансплантации при лечении детей с церебральным параличом нами оценивается как положительный. Таким образом, продуманный и патогенетически обоснованный отбор детей с церебральным параличом (которые потенциально отреагируют на лечение) позволяет оптимизировать определение биологического эффекта клеточной терапии при наименьшем возможном объеме применения материала.
Для прогнозирования эффекта трансплантации целесообразно проводить не только клинико-биологическое, но обязательно вирусологическое обследование (всех 6 герпестипов + JVC-вируса). Особенно важна идентификация JVC, поскольку его скрытое носительство достигает 100 %, а при иммунодепрессии или при введении стволовых клеток при различных заболеваниях (рассеянный склероз, последствия инсульта), особенно из костного мозга (по данным ряда авторов), возможна реактивация этого вируса и возникновение мультифокальной лейкоэнцефалопатии.
В заключение необходимо сказать, что, без сомнения, будущее в лечении ЦП у детей, особенно в начале его формирования, принадлежит клеточным биотехнологиям. Но трансплантолог должен опираться на достоверную диагностику этиологических факторов ЦП, изначально исключив генетические и другие мальформации головного мозга, поэтому квалифицированное обследование у детского невролога — краеугольный камень успеха клеточных технологий.

/14-1.jpg)
/14-2.jpg)
/15-1.jpg)
/16-1.jpg)
/16-2.jpg)