Газета «Новости медицины и фармации» 10 (543) 2015
Вернуться к номеру
Как обоснованно сделать предположение о наличии тромбоэмболии легочных артерий: насколько помогают диагностические шкалы
Авторы: Миронов А.В.(1), Леонтьев С.Г.(1), Устинов Ф.С.(2), Ефремова О.И.(1), Лебедев И.С.(2), Кириенко А.И.(1)
(1) — Кафедра факультетской хирургии № 1 лечебного факультета Российского научно-исследовательского медицинского университета им. Н.И. Пирогова Минздрава РФ, г. Москва
(2) — ГКБ № 1 им. Н.И. Пирогова, г. Москва
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 18-20 (Мир)
Тромбоэмболия легочной артерии (ТЭЛА) является причиной смерти 1 % всех пациентов, поступивших в стационары, а 10 % всех случаев смерти в стационаре обусловлены этой патологией [1]. Вместе с тем ТЭЛА остается самой нераспознаваемой причиной смерти больных в стационаре. В 70 % случаев правильный диагноз устанавливается только на аутопсии. В то же время своевременная диагностика и проведение эффективного лечения позволяют существенно снизить смертность от этого осложнения венозной тромбоэмболии [2].
Клиническая диагностика ТЭЛА затруднена ввиду отсутствия строго специ–фичных симптомов. Между тем внимательный клиницист на основании данных анамнеза и клинической картины способен с достаточно высокой степенью надежности не только предположить, но и установить правильный диагноз. Помочь врачу обоснованно предположить наличие ТЭЛА призваны диагностические шкалы. В настоящее время наибольшую распространенность для оценки вероятности диагноза ТЭЛА получили две из них — Канадская шкала, предложенная Р. Wells и соавт. [3], и пересмотренная Женевская шкала [4]. Однако каждая из них имеет ряд ограничений. Первая шкала включает клиническое суждение о возможности альтернативного диагноза. Этот критерий имеет основной вес в суммарном показателе, является весьма субъективным и не может быть стандартизован. Мало того, высказано предположение, что вероятностная ценность этой шкалы обусловлена в первую очередь именно этим субъективным компонентом [3]. Пересмотренная Женевская шкала представляется довольно простым способом оценки вероятности наличия ТЭЛА, основанной исключительно на клинических переменных, и не зависит от суждения врача в неясных клинических ситуациях [5].
Целью нашего исследования было выявление наиболее значимых клинических симптомов, которые позволяли бы предположить наличие ТЭЛА, и определение диагностического значения шкал вероятности ТЭЛА.
Материалы и методы
В проспективное исследование включили 130 пациентов (56,9 % женщин, 43,1 % мужчин) в возрасте 17–83 лет, госпитализированных в 2011 г. с диагнозом ТЭЛА в хирургическую клинику Московской городской клинической больницы № 1 им. Н.И. Пирогова.
Каждому пациенту наряду с общим обследованием и выявлением факторов риска (ФР) развития ТЭЛА при поступлении проводили балльную оценку вероятности ТЭЛА по вышеупомянутым шкалам. Оценку выполняли хирурги различной квалификации. Полученные данные не определяли диагностическую тактику в хирургических отделениях или отделениях реанимации и интенсивной терапии.
У каждого пациента, поступившего с диагнозом ТЭЛА, проведена верификация диагноза с помощью рентгенорадиологических методов, позволяющих визуализировать легочное русло (мультиспиральная компьютерная томография с болюсным усилением, ангиопульмонография либо сцинтиграфия легких). Всем больным с подозрением на ТЭЛА, независимо от наличия признаков тромбоза в системе нижней полой вены (НПВ), наряду с физическим обследованием проводили ультразвуковое ангиосканирование вен нижних конечностей. В отсутствие соответствующих данных пациентов исключали из исследования.
Балльные оценки вероятности диагноза ТЭЛА, полученные при использовании обеих шкал, были сопоставлены путем сравнения соответствующих доверительных интервалов. Для оценки значения р использовали критерий χ2 Пирсона. Точность шкалы сравнивали по площади под характеристической кривой (AUC) при использовании дихотомической кривой ROC-анализа (анализа данных с помощью построения характеристических кривых). Статистический анализ проводили с помощью программного обеспечения SPSS.
Результаты
У 96 (73,8 %) пациентов диагноз ТЭЛА был верифицирован, у 34 (26,2 %) клиническая картина заболевания была обу–словлена другой патологией (табл. 1). ТЭЛА с окклюзией как минимум одной из главных легочных артерий и поражением более 50 % легочного русла (массивная эмболия) выявлена у 45 пациентов, у остальных имелось поражение сегментарных либо долевых ветвей меньшего объема (немассивная эмболия).
Выявление ФР возникновения венозного тромбоза, который практически всегда служит источником легочной эмболии, способствует точной диагностике ТЭЛА, поэтому в нашем исследовании наряду с критериями, рекомендованными в указанных выше шкалах, для оценки вероятности эмболического поражения легочного русла мы использовали и другие, наиболее значимые, по нашему мнению, признаки (табл. 2).
Средний срок, прошедший с момента выявления онкологического заболевания до поступления в стационар с подозрением на ТЭЛА, составил 7 мес. С момента получения травмы, имевшейся в анамнезе у 18 пациентов, в среднем прошло 2,5 ± 1,6 сут. В 3,1 % случаев больным были выполнены различные хирургические вмешательства на опорно-двигательном аппарате. Еще 20 больных перенесли операции на органах брюшной полости. Длительность послеоперационного периода до развития признаков ТЭЛА составила 18,55 ± 16,80 сут. Иммобилизация в течение более 3 дней отмечена в 6,1 % случаев.
Сердечной недостаточностью страдали 44,6 % пациентов, 21,5 % — хроническими заболеваниями легких и постинфарктным кардиосклерозом. Тромбоз в системе НПВ ранее перенесли 24 больных.
В табл. 3 представлены клинические данные, полученные при первичном –осмотре в отделении у больных с подозрением на ТЭЛА.
Мы не проводили анализ линейной регрессии каждого из представленных признаков, однако попытались оценить специфичность критериев при помощи подсчета достоверности различий по частоте выявления их в группе с верифицированной ТЭЛА и группой, в которой клиническая картина была обусловлена другой патологией (табл. 3).
Безусловно, учет отдельных клинических признаков, даже тех, частота выявления которых статистически значимо выше при ТЭЛА, не может гарантировать правильность диагноза. Вместе с тем оценка их совокупности может иметь определенное диагностическое значение. В ряде крупных исследований показано, что разделение больных с подозрением на ТЭЛА по уровням клинической вероятности диагноза соответствует частоте его подтверждения (при низкой клинической вероятности — в 9 % случаев, при промежуточной — в 30 %, при высокой вероятности — в 68 %) [4–6]. Такое разделение позволяет осуществить дифференцированный подход к алгоритму использования различных диагностических и лечебных средств.
Интегральную оценку имеющихся анамнестических данных и результатов физического обследования мы производили согласно сопоставляемым шкалам. В табл. 4 представлены полученные нами данные.
Оценка у всех пациентов с подозрением на ТЭЛА по Канадской шкале и пересмотренной Женевской шкале в среднем составляла 4,20 ± 0,48 и 6,21 ± 0,50 балла соответственно. Такие оценки соответствуют промежуточной клинической вероятности ТЭЛА. У 96 пациентов, у которых диагноз ТЭЛА был подтвержден впоследствии с помощью инструментальных методов исследования, оценка по Канадской шкале составляла 4,41 ± 0,57 балла, по Женевской шкале — 6,17 ± 0,63 балла, что также соответствовало промежуточной клинической вероятности ТЭЛА. Вместе с тем у 34 пациентов, у которых диагноз ТЭЛА был исключен, средняя оценка практически не отличалась от таковой, полученной у больных с верифицированным диагнозом, и составляла соответственно 6,14 ± 1,30 и 4,18 ± 0,87 балла.
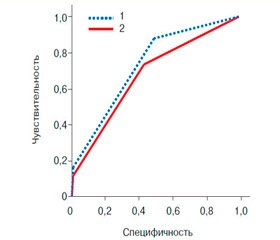
Для оценки практической ценности каждой из шкал сравнили AUC на ROC-кривой для каждой из интегральных систем вероятности (рис. 1). Кривые позволяют наглядно оценить соотношение чувствительности и специфичности, надежности и достоверности [7]. AUC для Канадской шкалы составляла 0,428 (95% ДИ от 0,72 до 0,87) и для Женевской шкалы — 0,512 (95% ДИ от 0,65 до 0,81). При сравнении AUC между кривыми статистически значимые различия не выявлены (р = 0,1).
Обсуждение
Наше исследование показало низкую ценность интегральных систем оценки вероятности наличия ТЭЛА в общей популяции больных с данным патологическим состоянием. Это обусловлено тем, что наиболее часто встречающиеся признаки не имеют патогномоничности. Числовой вес каждого из симптомов не позволяет использовать их в качестве ключевых показателей верификации диагноза вследствие малой специфичности по отношению к любой другой патологии. «Счастливое» диагностическое сочетание таких симптомов, как одышка в покое, обморочное состояние, артериальная гипотония, набухание шейных вен и признаков венозного тромбоза, по нашим данным, практически в 95 % случаев позволяет точно установить верный диагноз ТЭЛА; к сожалению, встречается лишь у 10 % больных. Эти данные свидетельствуют о невозможности использования такой системы в качестве ключевого диагностического правила.
Сравнение AUC ROC-кривых является эффективным инструментом, который позволяет взвесить дискриминационную способность статистических методов для прогностических целей [7]. По данным F. Klok и соавт. [8], AUC для Канадской шкалы составил 0,73, для Женевской — 0,79 (рис. 2). Различия значений AUC, полученных в нашем исследовании, и данных F. Klok и соавт. статистически значимы (p < 0,001). Кривые, полученные нами, отражают низкую чувствительность и специфичность для каждой из представленных шкал.
Такие различия по эффективности использования интегральных шкал, на наш взгляд, имеют целый ряд объяснений. В обеих шкалах уделяется пристальное внимание таким анамнестическим данным, как онкологическое заболевание в анамнезе. По нашим данным, лишь 7,6 % пациентов знали об имеющемся у них злокачественном процессе, хотя после обследования в клинике их доля возросла до 42,3 %. Данное обстоятельство обусловлено поздним выявлением злокачественных заболеваний в нашей стране. Кроме того, средний возраст наших пациентов был значительно моложе.
Мы предприняли попытку ранжирования балльной оценки в зависимости от объема эмболического поражения (табл. 5) и выявили достаточно высокую эффективность обеих интегральных шкал. Полученные результаты свидетельствуют о возможности определения высокой вероятности ТЭЛА при массивном ее характере. Это очень важный факт. К сожалению, он не является –достаточным основанием для использования указанных диагностических систем в повсе–дневной клинической практике.
При проецировании этих диагностических правил на всю совокупность больных результат размывается, и обоснованно судить о вероятности наличия ТЭЛА уже не представляется возможным. Так, нами не получено достоверных различий значений в группе с немассивной тромбоэмболией и в группе, в которой клиническая картина была обусловлена другой патологией, как для одной, так и для другой шкалы.
Таким образом, полученные при расчете значения рассматриваемых шкал позволяют обоснованно предполагать массивную ТЭЛА, т.е. чем больше объем эмболического поражения сосудистого русла легких, тем более вероятен клинический диагноз ТЭЛА.
Заключение
При осмотре больного с подозрением на ТЭЛА врач должен попытаться оценить клиническую вероятность диагноза ТЭЛА. Для этого разработаны специальные диагностические шкалы. Чаще всего используют Канадскую и пересмотренную Женевскую шкалы. Как показали результаты нашего исследования, предложенные унифицированные шкалы имеют весьма ограниченное значение. Для эффективного применения интегральных систем требуется их адаптация либо коренная переработка.
Выявленные нами достоверные различия значений диагностических шкал при оценке массивной ТЭЛА и других ее форм позволяют рекомендовать двухуровневую систему для использования и интерпретации полученных результатов, в которой суммарная оценка более 6 баллов по Канадской шкале и 10 баллов по Женевской шкале отождествляется с высокой вероятностью (до 80 %) наличия ТЭЛА. Для клинической практики это деление может быть не вполне достаточным (выпадают пациенты с немассивной ТЭЛА), но очень важным, так как обоснованное подозрение на массивную легочную эмболию обусловливает необходимость максимально быстрого подтверждения диагноза и решения вопроса о начале агрессивного лечения: проведения тромболитической терапии либо выполнения эмболэктомии из легочных артерий.
Список литературы
1. White R.H. The Epidemiology of Venous Thromboembolism // Circulation. — 2003. — 107. — I-4-I-8.
2. Kroegel C., Reissig A. Principle mechanisms underlying venous thromboembolism: epidemiology, risk factors, pathophysiology and pathogenesis // Respiration. — 2003. — 70(1). — 7-30.
3. Wells P.S., Anderson D.R., Rodger M. et al. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer // Thromb. Haemost. — 2000. — 83(3). — 416-420.
4. Le Gal G., Righini M., Roy P.M. et al. Prediction of pulmonary embolism in the emergency department: the revised Geneva score // Ann. Intern. Med. — 2006. — 144(3). — 165-171.
5. Kabrhel C., McAfee A.T., Goldhaber S.Z. The contribution of the subjective component of the Canadian pulmonary embolism score to the overall score in emergency department patients // Acad. Emerg. Med. — 2005. — 12. — 915-920.
6. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) // Eur. Heart J. — 2008. — 29(18). — 2276-2315.
7. Hanley J.A., McNeil B.J. The meaning and use of the area under a receiver operating (ROC) curve // Radio–logy. — 1982. — 143. — 29-36.
8. Klok F.A., Kruisman E., Spaan J. et al. Comparison of the revised Geneva score with the Wells rule for assessing clinical probability of pulmonary embolism // J. Thromb. Haemost. — 2008. — 6(1). — 40-44.

/18-1-m.jpg)
/19-1-m.jpg)
/19-3-m.jpg)
/19-2-m.jpg)