Журнал «Здоровье ребенка» 2 (61) 2015
Вернуться к номеру
Лейкоцитарний склад та імунофенотип лімфоцитів периферичної крові у ДААт-позитивних і ДААт-негативних щодо вмісту діабетасоційованих автоантитіл дітей та підлітків на доклінічній та ранній клінічній стадіях розвитку цукрового діабету 1-го типу
Авторы: Попова В.В. — ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У статті проаналізовані дані щодо особливостей лейкоцитарного складу та імунофенотипу лімфоцитів периферичної крові (ПК) у 94 ДААт-позитивних і 272 ДААт-негативних щодо вмісту діабетасоційованих автоантитіл (ДААт) дітей та підлітків, 49 ДААт-позитивних пацієнтів із дебютом цукрового діабету 1-го типу (ЦД1) та 84 дітей контрольної групи на доклінічній та ранній клінічній стадіях розвитку ЦД1. Визначення вмісту й аналіз розподілу лімфоцитів різного імунологічного фенотипу здійснювали методом проточної цитометрії, а визначення ДААт — радіоімунологічним методом. Встановлено, що найбільш значні зміни адаптивного та природного імунітету відбуваються на доклінічній стадії розвитку захворювання, що обумовлено найактивнішою фазою перебігу автоімунного процесу. У доклінічний період розвитку ЦД1 у ДААт-позитивних дітей реєструвалося збільшення абсолютної кількості моноцитів та зниження кількості природних клітин-кілерів (CD56+ лімфоцитів/великих грануловмісних лейкоцитів) у ПК, що свідчило про патогенетично значуще ослаблення вродженого імунітету на цьому етапі формування захворювання. Латентний, доклінічний період розвитку ЦД1 у дітей із підвищеними титрами ДААт до острівцевих антигенів порівняно з маркер-негативними пацієнтами щодо наявності ДААт і здоровими дітьми із групи контролю характеризувався порушеннями адаптивного імунітету — зниженням у циркуляції загальної кількості CD3+, CD4+, CD8+ Т-клітин, що є матеріальним субстратом детермінованої автоімунної агресії на доклінічній стадії розвитку ЦД1.
В статье проанализированы данные об особенностях лейкоцитарного состава и иммунофенотипа лимфоцитов периферической крови (ПК) у 94 ДААт-позитивных и 272 ДААт-негативных по наличию диабетассоциированных аутоантител (ДААт) детей и подростков, 49 ДААт-позитивных пациентов с дебютом сахарного диабета 1-го типа (СД1) и 84 детей контрольной группы. Определение содержания и анализ распределения лимфоцитов различного иммунологического фенотипа осуществляли с помощью метода проточной цитометрии, а определение уровней ДААт — радиоиммунологическим методом. Установлено, что наиболее выраженные изменения адаптивного и врожденного иммунитета происходят на доклинической стадии развития заболевания, что обусловлено наиболее активной фазой течения аутоиммунного процесса. В доклинический период развития СД1 у ДААт-позитивных детей регистрировалось увеличение абсолютного количества моноцитов и уменьшение содержания природных клеток-киллеров (CD56+ лимфоцитов/больших гранулосодержащих лимфоцитов) в ПК, что свидетельствовало о патогенетически значимом ослаблении врожденного иммунитета на данном этапе формирования заболевания. Латентный, доклинический период развития СД1 у детей с повышенными титрами ДААт к островковым антигенам в сравнении с маркер-негативными пациентами по наличию ДААт и здоровыми детьми из группы контроля характеризовался нарушениями адаптивного иммунитета — снижением в циркуляции общего количества CD3+, CD4+, CD8+ Т-клеток, что является материальным субстратом детерминированной аутоиммунной агрессии на доклинической стадии развития СД1.
The article analyzed the data about the features of leukocyte composition and immunophenotype of peripheral blood (PB) lymphocytes in children and adolescents: 94 DAAb-positive and 272 DAAb-negative in terms of diabetes-associated autoantibodies (DAAbs) content, 49 DAAb-positive patients with newly diagnosed diabetes mellitus type 1 (DM1) and 84 children from the control group, on the preclinical and early clinical stages of DM1. Evaluation of the content and analysis of distribution of lymphocytes with different immunophenotype was performed by flow cytometry method, and determination of DAAbs — using radioimmunoassay technique. It is found that the most significant changes in adaptive and natural immunity occur on the preclinical stage of the disease, which is caused by the most active phase of the autoimmune process. In preclinical period of DM1, in DAAb-positive children we have recorded an increase in the absolute number of monocytes and reduced number of natural killer cells (CD56+- lymphocytes/large granule-containing leukocytes) in the PB, indicating a pathogenetically significant weakening of innate immunity on this stage of the disease. Latent, preclinical period of DM1 in children with elevated titers of DAAb to islet antigens compared to marker-negative patients in terms of DAAb presence and healthy children from the control group has been characterized by impaired adaptive immunity — a reduction in blood flow of total number of CD3+, CD4+, CD8+ T-cells, which are material substrate of determined autoimmune aggression on the preclinical stage of DM1.
цукровий діабет 1-го типу, діабетасоційовані автоантитіла, імунітет.
сахарный диабет 1-го типа, диабетассоциированные аутоантитела, иммунитет.
type 1 diabetes mellitus, diabetes-associated autoantibodies, immunity.
Статья опубликована на с. 92-98
Цукровий діабет 1-го типу (ЦД1) сьогодні зараховують до найактуальніших як медичних, так і соціальних проблем, що потребують домінантної уваги національних програм охорони здоров’я практично всіх країн світу. Актуальність проблеми зумовлена ростом захворюваності на ЦД1, ранньою інвалідизацією хворих та високою смертністю [10, 27]. Незважаючи на те, що кількість хворих на ЦД1 становить тільки приблизно 5–10 % від загального числа хворих на цукровий діабет, тенденція до різкого зростання частоти захворюваності на ЦД1, особливо в дитячому віці, невпинно прогресує [13]. Епідеміологічні дослідження, що були виконані в різних країнах світу, свідчать про збільшення захворюваності на ЦД1 серед дітей та підлітків протягом останнього десятиріччя [11]. Так, загальна кількість хворих на ЦД1 у США досягла 1 % населення, а в країнах Європи кількість дітей із ЦД1 щорічно зростає на 4 % [30]. Захворюваність на ЦД1 в Україні також динамічно прогресує [4].
На сьогодні загальновизнано, що центральна роль у патогенезі ЦД1 належить Т-клітинам імунної системи, що розпізнають антигени острівцевих клітин специфічними клітинними рецепторами. Автоімунний процес, що призводить до загибелі бета-клітин, дуже складний і багатоступінчастий. Деякі його етапи до цього часу ще не зовсім зрозумілі, і їх значення в автоімунному процесі дискутабельне. Відсутні також дані щодо показників природного й адаптивного імунітету в доклінічний латентний період, що передує клінічній маніфестації захворювання. Не досліджені функції різних видів лейкоцитів периферичної крові (ПК) на доклінічній і ранній клінічній стадіях розвитку ЦД1: лімфоцитів, природних клітин-кілерів (ПКК), великих грануловмісних лейкоцитів (ВГЛ), моноцитів. Усі вищеперераховані прогалини обумовлюють складність даної проблеми та актуальність подальшого вивчення механізмів розвитку ЦД1 у дітей та підлітків.
Мета дослідження. Вивчення стану імунітету в доклінічній стадії розвитку ЦД1 на підставі визначення лейкоцитарного складу крові й імунофенотипу лімфоцитів, що відображає функцію цих клітин, у дітей, позитивних щодо діабетасоційованих автоантитіл (ДААт-позитивні), порівняно з негативними щодо діабетасоційованих автоантитіл (ДААт-негативні), ДААт-позитивними пацієнтами, у яких маніфестував клінічний дебют ЦД1, а також із контрольною групою практично здорових нормоглікемічних дітей без обтяженої спадковості щодо ЦД1.
Матеріали та методи дослідження
Протягом 12 років у рамках Державної програми «Цукровий діабет» обстежено 450 дітей і підлітків обох статей у віковому діапазоні від 7 до 15 років (середній вік — 12,34 ± 0,82 року). Серед обстежених 366 (81,3 %) осіб становили основну групу — діти та підлітки з нормоглікемією, які мали родичів, хворих на ЦД1, першого ступеня родинності (батьки, брат або сестра). Ця група дітей за результатами виконаного радіоімунологічного дослідження на наявність одночасно підвищеного титру діабетасоційованих автоантитіл (ДААт), а саме: автоантитіл до інсуліну (IAA), автоантитіл до протеїну тирозинфосфатази (IA-2A) і автоантитіл до декарбоксилази глутамінової кислоти (GADA) — була поділена на дві великі підгрупи. ДААт-позитивну становили 94 (25,7 %) дитини, необхідним критерієм включення до групи була обов’язкова наявність за дворазового визначення одночасно підвищеного титру не менше двох видів ДААт, переважно GADA і IA-2A. ДААт-негативну групу становили 272 (74,3 %) пацієнти з нормальним рівнем глікемії і з відсутністю одночасно підвищеного титру ДААт (ДААт-негативні). Ще одна група з’явилася як логічне хронологічне завершення автоімунного процесу в групі ДААт-позитивних дітей — група дітей із дебютом ЦД1 — 49 дітей (52,1 %), які поступово впродовж від 6 міс. до 10 років (у середньому 30,9 ± 3,2 міс.) змінили свій нормоглікемічний ДААт-позитивний статус практично здорових дітей на статус пацієнтів із клінічним дебютом ЦД1. 84 практично здорові нормоглікемічні дитини (18,7 %) становили контрольну групу. Рівень глюкози в плазмі венозної крові вимірювали глюкозооксидазним методом. Межі рівня глюкози в крові натще за цією методикою становили 3,6–5,5 ммоль/л. З метою виявлення автоімунного процесу в підшлунковій залозі використовували радіоімунологічний метод визначення ДААт: GADA, IA-2А і IAA. Кількісне визначення концентрацій досліджуваних ДААт у крові виконували, керуючись інструкцією виробника з використанням наборів для встановлення їх вмісту (Immunotech, Чехія, і CIS Bio International, Франція) на гамма-лічильнику Beckman Gamma 5500B (США). Нормальний рівень автоантитіл GADА і IA-2A був меншим за 1 од/мл, а рівень автоантитіл — ІАА був меншим за 5,5 од/мл. Загальну кількість лейкоцитів і лейкоцитарну формулу визначали у венозній гепаринізованій периферичній крові за допомогою загальноприйнятого методу. Мазки крові забарвлювали за Папенгеймом при рН буферного розчину 6,9. Диференційований підрахунок різних типів лейкоцитів здійснювали на 200 клітинах, виділяючи окремо великі грануловмісні лімфоцити. Визначення вмісту й аналіз розподілу лімфоцитів різного імунологічного фенотипу здійснювали за допомогою методу проточної цитометрії з використанням лазерного цитофлуориметра FACStar plus (фірми Becton Dickinson, США). Мононуклеари виділяли з крові диференційованим центрифугуванням у градієнті щільності фікол-уротраст. Поверхневі антигени лімфоцитів мітили моноклональними антитілами, які для візуалізації були кон’юговані із FITC. Використовували моноклональні антитіла фірми Becton Dickinson (США) та Dako (Данія) для ідентифікації поверхневих антигенів: CD3; CD4 (Т-індуктори/хелпери); CD8 (Т-супресори/кілери); CD20 (В-лімфоцити) і CD56 (ПКК). Статистичний аналіз даних виконували на підставі пакетів прикладних програм Microsoft Excel та SPSS 11 (SPSS Inc., США) з використанням параметричних методів статистичного аналізу, що були наведені у вигляді середніх значень та їх стандартної помилки (M ± m). Для порівняння двох груп за кількісними нормально розподіленими ознаками застосовувався t-критерій Стьюдента. Вірогідними вважали відмінності при рівні р < 0,05. Всі статистичні розрахунки виконували при рівні значущості 95 %, р = 0,05.
Загальна кількість лейкоцитів і лейкоцитарний склад крові при цукровому діабеті 1-го типу
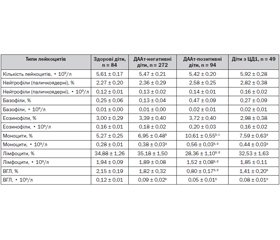
У результаті проведених досліджень не було виявлено вірогідних змін загальної кількості лейкоцитів у ПК як у доклінічну фазу розвитку захворювання, що встановлено на підставі виявлення одночасно підвищених титрів двох видів ДААт (IAA, GADA і IA-2A), так і у вперше виявлених хворих на ЦД1. Як видно з табл. 1, у ДААт-позитивних і ДААт-негативних дітей не було виявлено статистично вірогідних змін загальної кількості лейкоцитів у ПК порівняно з ДААт-позитивними дітьми, у яких згодом розвинувся ЦД1, і дітьми контрольної групи.
При дослідженні лейкоцитарного складу ПК у ДААт-позитивних дітей відмічалось невелике, але статистично вірогідне зниження відносної й абсолютної кількості лімфоцитів порівняно з вмістом відносного й абсолютного числа лімфоцитів у ДААт-негативних дітей і в дітей контрольної групи. При аналізі вмісту ВГЛ, що є гомологами ПКК, нами було виявлено у ДААт-позитивних дітей статистично вірогідне різке зниження відносного й абсолютного числа лімфоцитів порівняно з умістом відносного й абсолютного числа лімфоцитів у ДААт-негативних дітей та у дітей контрольної групи. Помірна лімфоцитопенія може бути пояснена одночасним зниженням кількості Т-лімфоцитів і ПКК (ВГЛ) у ПК. У той же час відносна й абсолютна кількість моноцитів у ДААт-позитивних дітей з обтяженою спадковістю щодо ЦД1 була статистично вірогідно підвищена стосовно вмісту як відносного, так і абсолютного числа лімфоцитів у ДААт-негативних дітей і у дітей контрольної групи (табл. 1). При розвитку клінічного дебюту ЦД1 спостерігалась також невелика лімфоцитопенія, але не настільки значна, як у ДААт-позитивних дітей. Так, у групі дітей із дебютом ЦД1 виявлялося невелике, але статистично вірогідне зниження відносного й абсолютного числа лімфоцитів порівняно з вмістом відносного та абсолютного числа лімфоцитів у ДААт-позитивних дітей, у ДААт-негативних дітей та у дітей контрольної групи. При вивченні вмісту ВГЛ у групі ДААт-позитивних дітей, у яких згодом розвинувся клінічний дебют ЦД1, ми виявили також статистично вірогідне зниження відносного й абсолютного числа лімфоцитів порівняно з вмістом відносного та абсолютного числа лімфоцитів у ДААт-позитивних дітей, у ДААт-негативних дітей та в дітей контрольної групи.
При аналізі вмісту моноцитів у групі дітей із дебютом ЦД1 також виявлявся моноцитоз, але не настільки виражений, як у групі ДААт-позитивних дітей. При дослідженні отриманих результатів ми виявили статистично вірогідне зменшення відносного й абсолютного числа лімфоцитів у групі дітей із дебютом ЦД1 порівняно з вмістом відносного й абсолютного числа лімфоцитів у ДААт-позитивних дітей. Незначний моноцитоз, як відносний, так і абсолютний, був виявлений у групі ДААт-негативних дітей порівняно з умістом відносного та абсолютного числа моноцитів у дітей контрольної групи. Треба відзначити, що помірний моноцитоз і лімфоцитопенія у дітей із клінічним дебютом ЦД1, що вже маніфестував, відмічалися й іншими авторами [3, 5, 18, 29]. Відносний і абсолютний вміст нейтрофілів у ПК ДААт-позитивних, ДААт-негативних і у дітей із дебютом ЦД1 порівняно з контролем вірогідно не був змінений (табл. 1). З боку лейкоцитарного складу ПК у хворих на ЦД1 найчастіше відмічалася, як уже вказувалося раніше, помірна лімфоцитопенія, яка при подальшому перебігу захворювання могла мати тенденцію до ще більшого зниження, хоча є окремі повідомлення [14, 20] щодо нормального рівня лімфоцитів у ПК хворих на ЦД1. Нами також було показано, що у хворих з уперше виявленим ЦД1 до початку інсулінотерапії відмічалося зниження відносного й абсолютного числа великих грануловмісних лімфоцитів у ПК, які вважаються морфологічним гомологом природних клітин-кілерів. Можливо, лімфоцитопенія, що спостерігалася у низки хворих на ЦД1, й обумовлена зниженням саме кількості цих клітин, а також зменшенням вмісту Т-лімфоцитів у ПК. Як видно з табл. 1, особливо значне зниження відносної й абсолютної кількості лімфоцитів у ПК нами було виявлене у ДААт-позитивних дітей з обтяженою спадковістю, тобто в доклінічний період розвитку захворювання, коли автоімунний процес уже почався і прогресує, але деструкції зазнала лише частина маси бета-клітин і, отже, секреція інсуліну хоча і знижена, але все ж таки ще протективно достатня для підтримки нормального рівня глікемії й запобігання клінічному дебюту ЦД1. У ДААт-позитивних дітей, як і в тих, у кого розвинувся клінічний дебют ЦД1, відмічалося значне зниження відносної та абсолютної кількості ВГЛ порівняно з нормою і ДААт-негативними дітьми (табл. 1), що підтверджується одночасним визначенням у цих пацієнтів зниження вмісту лімфоцитів, що експресують СD56-антиген (табл. 1). З боку моноцитів описана як відсутність їх зміни в ПК [21], так і помірний моноцитоз [3, 5], що найбільш виражений у доклінічну стадію розвитку захворювання (табл. 1). Відносний та абсолютний вміст нейтрофілів (як сегментоядерних, так і паличкоядерних) у ПК ДААт-позитивних, ДААт-негативних і у дітей із дебютом ЦД1 порівняно з контролем вірогідно не змінився (табл. 1).
Імунофенотип лімфоцитів у доклінічну і клінічну стадії розвитку цукрового діабету 1-го типу
Головною особливістю нашого дослідження субпопуляційного складу лімфоцитів у ПК у доклінічній стадії ЦД1 було те, що воно було виконане в практично ще здорових клінічно, але ДААт-позитивних імунологічно дітей. Даних щодо рівня CD3+ клітин у ПК в доклінічний період розвитку ЦД1 у ДААт-позитивних дітей у доступній літературі ми не знайшли. У наших проспективних дослідженнях імунофенотипу лімфоцитів було виявлено нижчий відносний та абсолютний вміст загальної кількості Т-лімфоцитів (СD3+ клітин) у ДААт-позитивних дітей у ПК, ніж у ДААт-негативних і здорових дітей контрольної групи, а також у групі ДААт-позитивних дітей, у яких виник ЦД1 (табл. 2). Як видно з табл. 2, абсолютна кількість СD3+ клітин у ПК в ДААт-негативних дітей порівняно з такими у здорових дітей була в середньому зниженою на 12,2 %, у ДААт-позитивних — на 43,2 % (р < 0,05). У той же час абсолютна кількість CD3+ клітин у ДААт-негативних дітей порівняно з ДААт-позитивними дітьми була меншою на 35,3 % (р2 < 0,001).
При FACS-аналізі лімфоцитів різного імунофенотипу в ПК хворих на ЦД1 пильніша увага в літературі приділяється дослідженню вмісту однієї з популяцій CD3+ Т-клітин-Т-хелперів/індукторів (CD4+ Т-клітин) і їх субпопуляції, що мають імунорегуляторні властивості.
У наших дослідженнях імунофенотипу лімфоцитів у дітей, які знаходяться на імунологічно підтвердженій доклінічній стадії розвитку ЦД1, виконаних у ДААт-позитивних дітей, було показано, що зменшення у них вмісту СD3+ Т-клітин у ПК значною мірою обумовлене, як видно з табл. 2, зниженням рівня в циркуляції абсолютної кількості Т-хелперів/супресорів, тобто СD4+ Т-клітин. Середні показники абсолютної кількості цієї субпопуляції лімфоцитів у ПК в ДААт-негативних дітей порівняно з такими у здорових дітей були знижені на 11,2 % (р > 0,05), у ДААт-позитивних дітей — на 46,9 % (р < 0,001) і у ДААт-позитивних дітей із клінічним дебютом ЦД1 — на 28,6 % (р < 0,05). У той же час абсолютне число CD4+ клітин у ДААт-позитивних дітей на 40,2 % (р < 0,001) було нижчим, ніж у ДААт-негативних.
Отримані нами результати узгоджуються з роботами ряду дослідників, що виявили зниження рівня СD4+ клітин у ПК при ЦД1 і підтверджують значну роль цих клітин у патогенезі захворювання [12, 16]. Необхідно особливо підкреслити, що отримані нами дані вказують на те, що зміна цієї популяції Т-клітин відбувається задовго, інколи за декілька років, до розвитку клінічної маніфестації захворювання.
У той же час необхідно зазначити, що, як видно з табл. 2, у ДААт-негативних дітей також було вірогідне зниження відносного й абсолютного вмісту СD3+ і СD4+ Т-клітин, хоча й не настільки вираженим. Це можна, мабуть, пояснити тим, що ця група дітей все ж має обтяжену спадковість, хоча і є ДААт-негативною, при цьому не можна виключати й того, що нормальний титр у деяких із цих дітей надалі може підвищуватися, оскільки є дані про те, що титр GADA і IA-2A в окремих осіб має транзиторний характер, тобто може або зовсім інколи зникати, або, навпаки, значно підвищуватися [24, 25].
Інформація щодо змін рівня CD8+ Т-клітин у ПК в доклінічний період розвитку ЦД1 незначна, неоднозначна і отримана на дуже незначному клінічному матеріалі (всього декілька осіб у групах). Так, за даними C.L. Hitchock та співавт. [19], відсоток CD8+ клітин у ПК в ICA-позитивних сибсів істотно відрізняється від ICA-негативних, а за даними D. Faustman та співавт. [9], «недіабетичні» сибси при предіабеті мають знижену кількість CD8+ Т-клітин у ПК. У виконаному дослідженні імунофенотипу лімфоцитів у ПК обстежуваних груп дітей не було виявлено, як видно з табл. 2, вірогідних змін відносного вмісту CD8+ Т-клітин у ДААт-негативних, ДААт-позитивних і дітей із клінічним дебютом ЦД1 порівняно з контролем. Проте при обчисленні абсолютних чисел CD8+ Т-клітин у ПК спостерігалося значне статистично вірогідне зниження кількості цих клітин у ДААт-позитивних дітей порівняно зі здоровими дітьми, ДААт-негативними дітьми та в ДААт-позитивних дітей із ЦД1. Вірогідної різниці між середньою кількістю CD8+ Т-клітин у ДААт-позитивних і ДААт-негативних пацієнтів виявлено не було (р2 > 0,05). У ДААт-позитивних дітей спостерігалося статистично вірогідне (р < 0,01) зниження абсолютної кількості Т-кілерів/супресорів (СD8+ клітин) у ПК як щодо контрольної групи дітей, так і ДААт-негативних дітей (табл. 2). Вірогідна різниця (р < 0,05) була також між групами ДААт-позитивних і ДААт-негативних дітей. Вірогідне зниження (р < 0,05) відсотка СD8+ клітин у ПК реєструвалося лише при порівнянні середніх величин здорових і ДААт-позитивних дітей. У пацієнтів із клінічним дебютом ЦД1 мало місце подібно доклінічній латентній стадії ЦД1 вірогідне зниження відносної (р = 0,05) й абсолютної (р < 0,05) кількості СD8+ клітин, але воно було менш виражене (табл. 2). Співвідношення між кількістю СD4+ і СD8+ Т-клітин, тобто індекс СD4+/СD8+, було порівняно з контролем вірогідно (р < 0,05) зниженим як у ДААт-позитивних дітей, так і у ДААт-позитивних дітей із маніфестованим ЦД1, що узгоджується з даними переважної більшості авторів [9, 16, 18, 19].
Дослідженню при ЦД1 гуморального імунітету, тобто вмісту В-лімфоцитів (CD19+, CD20+ і CD21+ клітин), присвячена значно менша кількість робіт, ніж аналізу кількості Т-лімфоцитів у ПК. Згідно з наявними даними, вміст В-лімфоцитів у ПК дітей з уперше виявленим ЦД1 знаходиться, на думку одних авторів, у межах нормальних показників або дещо знижений [3, 8, 15, 22], на думку інших — дещо підвищений [2, 6, 7]. У наших проспективних клініко-імунологічних дослідженнях при визначенні В-лімфоцитів (СD20+ клітин), як видно з табл. 2, не було виявлено вірогідної зміни відносного їх вмісту в ПК ДААт-негативних дітей, ДААт-позитивних дітей та ДААт-позитивних дітей із ЦД1 порівняно з контролем. Але абсолютне число СD20+ клітин у ПК було дещо зниженим як у ДААт-позитивних, так і ДААт-негативних дітей, а також у групі ДААт-позитивних дітей із дебютом ЦД1 порівняно з вмістом абсолютного числа СD20+ клітин у ПК здорових дітей.
Украй обмежена також наявна література щодо змін при ЦД1 вмісту третьої (разом з Т- і В-клітинами), головної популяції лімфоцитів — природних клітин-кілерів, що становить 10–15 % усіх лімфоцитів. Унікальна особливість ПКК — їх здатність спонтанно (тобто без попередньої сенсибілізації антигеном) знищувати вірусінфіковані, пухлинні й інші види трансформованих клітин. Імунологічно й морфологічно ПКК відрізняються від Т- і В-лімфоцитів. Вони експресують на своїй поверхні низку характерних маркерів. Найбільш специфічні з них — CD16- і CD56-антигени. У той же час вони не експресують характерний для Т-клітин CD3–антиген [1, 3]. Цікаві дані ми отримали при дослідженні цієї найменш вивченої субпопуляції лімфоцитів — природних клітин-кілерів. Як видно з табл. 2, у ДААт-позитивних дітей і у ДААт-позитивних дітей з уперше виявленим ЦД1 спостерігалося статистично вірогідне зниження в ПК відносного та абсолютного порівняно з групою здорових дітей числа лімфоцитів, що експресують СD56-антиген, який вважається найбільш специфічним імунологічним маркером ПКК. Причому ступінь зниження СD56+ клітин у ДААт-позитивних дітей був більшим, ніж після виникнення захворювання. Подібні зміни в обстежених були також виявлені і при цитологічному визначенні ПКК у мазках ПК на підставі підрахунку ВГЛ, що вважаються, як уже вказувалося, морфологічним гомологом ПКК. Це підтверджує вірогідність отриманих нами даних щодо змін вмісту цієї субпопуляції лімфоцитів на доклінічній і на ранніх клінічних стадіях ЦД1. У доклінічну стадію розвитку ЦД1 у доступній нам літературі вдалося виявити лише одну роботу [28], присвячену дослідженню вмісту ПКК у найбільш ранній фазі виникнення цього захворювання. У ній показано, що в ICA-позитивних дітей, так само як у дітей із ЦД1, є зниження кількості ПКК порівняно з контролем. У наших дослідженнях, як видно з табл. 2, вміст ПКК у доклінічний період ЦД1, тобто в ДААт-позитивних дітей, як і в ДААт-позитивних пацієнтів, у яких уже клінічно маніфестував ЦД1, порівняно з групою практично здорових дітей спостерігалося значне статистично вірогідне зниження в ПК відносного та абсолютного порівняно з групою контролю числа лімфоцитів, що експресують СD56-антиген, тобто найбільш специфічного імунологічного маркера ПКК. При дослідженні стану ПКК при ЦД1 нами була виявлена також дуже цікава закономірність. У більшості хворих дітей із найнижчим вмістом CD56+ клітин і ВГЛ у ПК в одного з батьків дітей із ЦД1 так само було зниження кількості ПКК у ПК. Отримані дані дозволяють зробити висновок, що, можливо, зниження числа ПКК у ПК частини дітей з ЦД1 обумовлене генетичним дефектом системи клітин-кілерів. Ослаблення природної імунної системи організму, зокрема зниження секреції потужного антивірусного цитокіну ІФН-гамма — головного продукту секреції ПКК [23], може сприяти агресивнішому перебігу вірусних захворювань (вірус Коксакі, герпес, краснуха, вітряна віспа й ін.), будучи однією з причин ушкодження бета-клітин — тобто зниження числа циркулюючих ПКК є не наслідком ЦД1, а передує його розвитку. На користь такого припущення свідчить низка фактів, у тому числі й дані про те, що існує асоціація між епідеміологічними сезонними (осінньо-зимовий час) спалахами вірусних захворювань і частотою виникнення ЦД1 у дітей [17, 26].
Висновки
1. Показано, що найбільш виражені зміни адаптивного (Т-клітинного) і природного імунітету (ПКК) відбуваються на доклінічній стадії розвитку захворювання, що обумовлено найактивнішою фазою перебігу автоімунного процесу. Після того як більшість бета-клітин антигенного матеріального субстрату автоімунної агресії зруйнована, автоімунний процес поступово стихає, що і призводить до певної нормалізації імунних показників.
2. У доклінічний період розвитку ЦД1 в ДААт-позитивних дітей реєструвалося збільшення абсолютної кількості моноцитів та зниження кількості природних клітин-кілерів (CD56+ лімфоцитів/ВГЛ) у периферичній крові, що свідчило про патогенетично значуще ослаблення вродженого імунітету на цьому етапі формування захворювання.
3. Латентний, доклінічний період розвитку ЦД1 у дітей із підвищеними титрами ДААт до острівцевих антигенів порівняно з маркер-негативними пацієнтами щодо наявності ДААт до острівцевих антигенів і здоровими дітьми контролю характеризувався порушеннями адаптивного імунітету — зниженням у циркуляції загальної кількості CD3+, CD4+, CD8+ Т-клітин, що є матеріальним субстратом детермінованої автоімунної агресії на доклінічній стадії розвитку ЦД1.
1. Возианов А.Ф. Цитокины. Биологические и противоопухолевые свойства / А.Ф. Возианов, А.К. Бутенко, К.П. Зак. — К.: Наукова думка, 1998. — 315 с.
2. Динамика содержания аутоантител к островковым клеткам поджелудочной железы у родственников больных сахарным диабетом типа 1 / Н.Л. Вартанян, А.А. Соминина, В.В. Зарубаев [и др.] // Пробл. эндокринологии. — 2001. — Т. 47, № 4. — С. 27–30.
3. Зак К.П. Иммунитет у детей, больных сахарным диабетом / К.П. Зак, Т.Н. Малиновская, Н.Д. Тронько. — К.: Книга плюс, 2002. — 111 с.
4. Зак К.П. Сахарный диабет. Иммунитет. Цитокины / К.П. Зак, Н.Д. Тронько, В.В. Попова, А.К. Бутенко. — К.: Книга плюс, 2015. — 488 с.
5. Особенности иммунитета у детей и подростков с различной продолжительностью сахарного диабета типа 1 / Е.В. Крюкова, А.А. Савченко, В.Т. Манчук, И.В. Осокина // Пробл. эндокринологии. — 2000. — Т. 46, № 3. — С. 7–10.
6. Особенности клеточного иммунитета у больных с впервые выявленным инсулинзависимым сахарным диабетом / И.И. Дедов, Л.А. Чугунова, О.М. Смирнова [и др.] // Пробл. эндокринологии. — 1994. — Т. 40, № 1. — С. 17–20.
7. Потемкин В.В. Динамика ряда показателей клеточного и гуморального иммунитета у больных сахарным диабетом 1 типа / В.В. Потемкин, Т.В. Никонова, С.В. Брыкова // Пробл. эндокринологии. — 1994. — Т. 40, № 6. — С. 5–7.
8. Ультраструктура и функция лимфоцитов крови у детей с впервые выявленным нелеченным сахарным диабетом 1-го типа / К.П. Зак, М.А. Грузов, В.В. Афанасьева [и др.] // Пробл. эндокринологии. — 2005. — Т. 51, № 5. — С. 8–13.
9. Abnormal T-lymphocyte subsets in type 1 diabetes / D. Faustman, G. Eisenbarth, J. Dales, J. Breitmeyer // Diabetes. — 1989. — Vol. 38, № 11. — P. 1462–1468.
10. Atkinson M.A. Type 1 diabetes. Type 1 diabetes / M.A. Atkinson, G.S. Eisenbarth, A.W. Michels // Lancet. — 2014. — Vol. 383, № 9911. — P. 69–82.
11. Battaglia M. The streetlight effect in Type 1 diabetes [Text] / M. Battaglia, M.A. Atkinson // Diabetes. — 2015. — Vol. 64. — P. 1081–1090.
12. Effects of cyclosporin A upon humoral and cellular immune parameters in insulin dependent diabetes mellitus type 1: a long-term follow-up study / C. Muller, C.C. Zielinski, W. Kaliniwski [et al.] // J. Endocrinol. — 1989. — Vol. 121, № 1. — P. 177–183.
13. Hansen M.P., Matheis N., Kahaly G.J. Type 1 diabetes and polyglandular autoimmune syndrome: A review / Hansen M.P., Matheis N., Kahaly G.J. // World J. Diabetes. — 2015. — Vol. 6, № 1. — P. 67–79.
14. Higher percentages of T regulatory cells in children at risk for developing type 1 diabetes mellitus / W. Luczynski, A. Stasiak-Barmuta, M. Mysliwiec [et al.] // Pediatr. Endocrinol. Diabetes Metab. — 2010. — Vol. 16, № 1. — P. 7–10.
15. Hyoty H. Flow-cytometric analysis of lymphocyte subsets in relation to virus infections at the onset of type 1 (insulin-dependent) diabetes // APMIS. — 1988. — Vol. 96, № 8. — P. 741–748.
16. Increase in simultaneous coexpression of naive and memory lymphocyte markers at diagnosis of IDDM / R.A. Smerdon, M. Peakman, M. Hussain [et al.] // Diabetes. — 1993. — Vol. 42, № 1. — P. 127–133.
17. Innate immunity and human insulitis during beta cell coxsackie B4 infection / F. Dotta, V. Bonato, R. Gallo [et al.] // Diabetologia. — 2008. — Vol. 51, Suppl. 1. — P. S234–459.
18. Lymphocyte subset abnormalities, autoantibodies and their relationship with HLADR types in children with type 1 (insulin-dependent) diabetes and their first degree relatives / M. Peakman, T. Warnock, A. Vats [et al.] // Diabetologia. — 1994. — Vol. 37, № 2. — P. 155–165.
19. Lymphocyte subsets and activation in prediabetes / C.L. Hitchcock, W.J. Riley, A. Alamo [et al.] // Diabetes. — 1986. — Vol. 35, № 12. — P. 1416–1422.
20. Lower percentages of T regulatory cells in children with type 1 diabetes — preliminary report / W. Luczynski, A. Stasiak-Barmuta, R. Urban [et al.] // Pediatr. Endocrinol. Diabetes Metab. — 2009. — Vol. 15, № 1. — P. 34–38.
21. Monocyte function in IDDM patients and healthy individuals / J. Molvig, F. Pociot, L. Baek [et al.] // Scand. J. Immunol. — 1990. — Vol. 32, № 3. — P. 297–311.
22. Multiparametr immunologic studies in patients with newly diagnosed type1 insulin-dependent diabetes mellitus / S. Gupta, M.A. Charles, N. Waldecr [et al.] // Diabetes Res. — 1986. — Vol. 3, № 5. — P. 225–229.
23. Natural killer cells from children with type 1 diabetes have defects in NKG2D-dependent function and signaling / H. Qin, I.-F. Lee, C. Panagiotopoulos [et al.] // Diabetes. — 2011. — Vol. 60, № 3. — P. 857–866.
24. Prediction of autoantibody positivity and progression to type 1 diabetes: Diabetes Autoimmunity Study in the Young (DAISY) / J.M. Barker, K.J. Barriga, L. Yu [et al.] // J. Clin. Endocrinol. Metab. — 2004. — Vol. 89, № 8. — P. 3896–3902.
25. Progression to type 1 diabetes and autoantibody positivity in relation to HLA risk genotypes in children participating in the ABIS study / C. Gullstrand, J. Wahlberg, J. Ilonen [et al.] // Diabetologia. — 2006. — Vol. 49, Suppl. 1. — P. 179–180.
26. Seasonal variation of type 1 diabetes incidence in childhood in Germany / J. Rosenbauer, C. Bochle, A. Stahl [et al.] // Diabetologia. — 2010. — Vol. 53, Suppl. 1 (A–924).
27. Standards of medical care in diabetes — 2015 // Diabetes care. — 2015. — Vol. 38, Suppl. 1. — S1–S90.
28. T-lymphocytes subsets disturbances in the blood of subjects at high-risk of insulin-dependent diabetes / A. Kretowski, M. Szelochowska, M. Pieterczuk, J. Kinolska // Diabetologia. — 1996. — Vol. 39, Suppl. 1. — P. 356 (A–95).
29. Two-color flow cytometry analysis of activated T-lymphocyte subsets in type 1 diabetes mellitus / C. M. Legendre, A. Schiffirin, G. Weitzner [et al.] // Diabetes. — 1988. — Vol. 37, № 6. — P. 792–795.
30. Zhang L. Prediction and prevention of Type 1 diabetes mellitus / L. Zhang, G.S. Eisenbarth // Diabetes. — 2011. — Vol. 3, Suppl. 1. — P. 48–57. doi: 10.1111/j.1753–0407.2010.00102.

/47/47.jpg)
/48/48.jpg)