Журнал «Здоровье ребенка» 2 (61) 2015
Вернуться к номеру
Характер запалення дихальних шляхів за фенотипу тяжкої бронхіальної астми в дітей шкільного віку
Авторы: Ортеменка Є.П. — Буковинський державний медичний університет, м. Чернівці
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
На базі обласної дитячої клінічної лікарні м. Чернівців в 43 школярів, хворих на персистуючу бронхіальну астму, вивчався характер запалення дихальних шляхів із метою індивідуалізації вибору протизапальної базисної терапії. Першу (І) клінічну групу становили 24 дитини з фенотипом тяжкої астми, до другої (ІІ) групи увійшли 19 дітей із середньотяжким перебігом хвороби. Цитологічний аналіз індукованого мокротиння проводився за методом I.D. Pavord.
Хворим на тяжку бронхіальну астму притаманна вираженіша гіпереозинофільна реакція дихальних шляхів. Так, значна еозинофілія (еозинофілів ≥ 12 % у мокротинні) бронхіального секрету визначалася в 29,2 % пацієнтів із тяжкою астмою та в 10,5 % (Рϕ < 0,05) випадків у ІІ групі. Водночас відносний помірний лімфоцитоз дихальних шляхів (лімфоцитів ≥ 11 % у мокротинні) відзначався у 31,6 % пацієнтів ІІ групи та у 25,0 % школярів із тяжкою астмою (Рϕ > 0,05). Кількість циліндричних епітеліоцитів у бронхіальному секреті ≥ 50 % зареєстрована у 29,3 % хворих І та у 26,3 % школярів ІІ групи порівняння (Рϕ > 0,05). Школярам із тяжкою астмою притаманний гіпереозинофільно-помірно-лімфоцитарний варіант запалення дихальних шляхів, асоційований із їх вираженішим ремоделінгом, що в цілому потребує призначення високих доз інгаляційних глюкокортикостероїдів у комбінації з антинейтрофільними (антилейкотрієни, блокатори імуноглобуліну Е) протизапальними препаратами.
На базе областной детской клинической больницы г. Черновцов у 43 школьников, страдающих персистирующей бронхиальной астмой, изучали характер воспаления дыхательных путей с целью индивидуализации выбора противовоспалительной базисной терапии. Первую (І) клиническую группу составили 24 ребенка с фенотипом тяжелой астмы, во вторую (ІІ) группу вошли 19 детей со среднетяжелым течением. Цитологический анализ индуцированной мокроты проводился по методу I.D. Pavord.
Больным тяжелой бронхиальной астмой присуща гиперэозинофильная реакция дыхательных путей. Так, значительная эозинофилия бронхиального секрета (эозинофилов ≥ 12 % в мокроте) определялась у 29,2 % пациентов с тяжелой астмой и только в 10,5 % случаев (Рϕ < 0,05) во ІІ группе. При этом относительный умеренный лимфоцитоз дыхательных путей (лимфоцитов ≥ 11 % в мокроте) отмечался у 31,6 % пациентов ІІ группы и у 25,0 % школьников с тяжелой астмой (Рϕ > 0,05). Количество цилиндрических эпителиоцитов в бронхиальном секрете ≥ 50 % отмечено у 29,3 % больных І и у 26,3 % детей ІІ групп сравнения (Рϕ > 0,05). Для школьников с тяжелой астмой характерен гиперэозинофильно-умеренно-лимфоцитарный вариант воспаления дыхательных путей, ассоциированный с их более значительным ремоделингом, что в целом указывает на необходимость назначения высоких доз ингаляционных глюкокортикостероидов в комбинации с антинейтрофильными (антилейкотриены, блокаторы иммуноглобулина Е) противовоспалительными препаратами.
At the premises of regional clinical hospital of Chernivtsi city, the nature of airway inflammation has been studied in 43 schoolchildren with persistent bronchial asthma for the purpose of individual choice of antiinflammatory basic therapy. The first (I) clinical group consisted of 24 children with severe asthma phenotype, the second (II) one included 19 children with moderate to severe course of the disease. Cytological analysis of induced sputum was carried out by the method of I.D. Pavord.
Patients with severe bronchial asthma are characterized by more significant hypereosinophilic reaction of airways. Thus, a significant eosinophilia (sputum eosinophils ≥ 12 %) of bronchial mucous was determined in 29.2 % of patients with severe asthma and in 10.5 % (Pϕ < 0.05) of cases in the second group. At the same time, the relative moderate airway lymphocytosis (sputum lymphocytes ≥ 11 %) has been detected in 31.6 % of patients in the second group and in 25.0 % of schoolchildren with severe asthma (Pϕ > 0.05). Number of cylindrical epithelial cells in bronchial mucous ≥ 50 % was registered in 29.3 % of patients from the I group and in 26.3 % of schoolchildren from the second comparison group (Pϕ > 0.05). School-age children with severe asthma are characterized by hypereosinophilic-moderate-lymphocytic type of airway inflammation associated with their significant remodeling that, in general, require the administration of high doses of inhaled corticosteroids in combination with antineutrophilic (antileucotriens, immunoglobulin E blockers) antiinflammatory drugs.
бронхіальна астма, діти, фенотипи, цитологічна картина мокротиння.
бронхиальная астма, дети, фенотипы, цитологическая картина мокроты.
bronchial asthma, children, phenotypes, sputum cytological profile.
Статья опубликована на с. 66-69
Вступ
Незважаючи на значні успіхи, досягнуті за останні десятиріччя у вивченні патогенезу та лікуванні бронхіальної астми (БА), це захворювання є найбільш поширеною хронічною патологією дитячого віку, що суттєво впливає на якість життя пацієнтів та їх родин, на суспільство в цілому та нерідко призводить до інвалідизації й несприятливих наслідків [2]. Серед основних факторів, що впливають на якість життя, слід відмітити тяжкість та тривалість захворювання, неефективність призначеної терапії та, як наслідок, — відсутність адекватного контролю симптомів БА [3].
Одним з аспектів недостатнього контролю тяжкої БА є її фенотипова неоднорідність, зокрема за віком дебюту (астма раннього та пізнього початку), характером запалення бронхів (еозинофільний та нееозинофільний), швидкістю обструкції нижніх дихальних шляхів (торпідна та лабільна обструкція), відповіддю на базисну терапію (стероїд-чутлива та стероїд-резистентна БА) [6, 11]. Водночас ряд авторів у дитячому віці серед вікових, клінічних, патофізіологічних субтипів БА виділяють окремий фенотип «тяжкої астми», хоча чинні критерії тяжкої БА характеризуються суб’єктивізмом [4].
До факторів ризику формування тяжкої БА зараховують дію тригерів (тютюнопаління, експозиція алергенів, вірусна інфекція, полютанти, стрес), відсутність комплайєнсу, наявність супутніх захворювань [2, 4, 6]. Водночас існує думка, що фенотип «тяжкої бронхіальної астми» зумовлений генетичною детермінованістю феномену нечутливості організму до глюкокортикостероїдів [14].
Суперечливими наразі залишаються літературні дані щодо асоціації кількісних та якісних характеристик індукованого мокротиння з тяжкістю захворювання. Так, за даними ряду авторів, кількість еозинофілів індукованого мокротиння не має взаємозв’язку з тяжкістю БА та спірометричними характеристиками [5], проте існує й прямо протилежна позиція [9]. Тяжка, резистентна до лікування БА з фенотипом нестійкого перебігу (brittle-asthma) асоціюється з атопічною формою захворювання та еозинофільним паттерном запалення слизової оболонки бронхів, а також підвищенням функціонування еластази і альфа-1-протеїназного інгібітору. У пацієнтів цієї ж групи спостерігається вираженіше потовщення базальної мембрани, ніж в осіб без еозинофілії. Астму, асоційовану з рефрактерною еозинофілією бронхів на тлі тяжкого персистування патології та резистентності до базисної терапії, деякі автори пропонують виділити в окремий фенотип тяжкої БА [7].
Водночас у наукових джерелах накопичені дані щодо залучення нейтрофільних лейкоцитів до процесів ремоделювання бронхів [10] та асоціації нейтрофільного запалення бронхіального дерева зі зниженням еластичності альвеол та гіперплазією келихоподібних, секреторних клітин епітеліального шару бронхів [13]. При цьому підвищення кількості нейтрофілів у дихальних шляхах (ДШ) зареєстровано в пізню фазу алергічної реакції [7], у хворих на так звану «фатальну» та «нічну астму» [12], а також при гормонорезистентних формах бронхіальної астми [8, 11].
Слід зазначити, що більшість досліджень морфологічного субстрату запалення ДШ при БА проведені серед дорослих хворих [6, 10, 12, 13], а дані щодо особливостей місцевого запалення за фенотипу тяжкої астми у дітей обмежені.
Мета роботи. Вивчити особливості запалення дихальних шляхів у дітей, які страждають від тяжкої бронхіальної астми, для покращення контролю захворювання шляхом диференційованого індивідуалізованого вибору протизапальної базисної терапії.
Матеріал і методи
На базі ОДКЛ м. Чернівців обстежені 43 дитини шкільного віку, хворих на персистувальну БА. Першу (І) клінічну групу становили 24 дитини з фенотипом тяжкої астми, до другої (ІІ), групи контролю, увійшло 19 дітей із фенотипом середньотяжкої БА.
Усім дітям у позанападному періоді проводився цитологічний аналіз мокротиння, отриманого методом індукції з використанням серійних розведень гіпертонічних розчинів (3, 5, 7%) натрію хлориду, за методом I.D. Pavord у модифікації M.M. Pizzichini (1996 р.). Життєздатність клітин цитологічного осаду визначали за допомогою трипанового синього, потім вираховували частку епітеліоцитов із загальної кількості клітин. Відносний вміст клітин запалення в індукованому мокротинні визначали шляхом аналізу 200 клітин, за винятком епітеліальних [15].
За основними клінічними ознаками групи були порівнянними. Так, у І групі було 16 хлопчиків (66,7 %), а середній вік хворих становив 12,2 року. У ІІ клінічній групі порівняння хлопчиків було 13 (68,4 %) (Pt > 0,05), а середній вік пацієнтів становив 11,1 року (Pt > 0,05). У сільській місцевості проживали 16 дітей (66,7 %) І групи та 12 хворих (63,2 %, Pt > 0,05) групи порівняння.
Одержані результати дослідження аналізувалися за допомогою комп’ютерних пакетів Statistica StatSoft Inc. та Excel XP для Windows на персональному комп’ютері з використанням параметричних і непараметричних методів обчислення. Правильність нульової гіпотези визначалася з урахуванням рівня значущості Рt, Pu (методом Вілкоксона — Манна — Уїтні), Рф (методом кутового перетворення Фішера).
Результати та їх обговорення
Відсотковий вміст життєздатних клітин, що є показником правильності отримання мокротиння та маркером придатності отриманого матеріалу для подальшого дослідження, не відрізнявся у клінічних групах порівняння та узгоджувався з даними літератури [15].
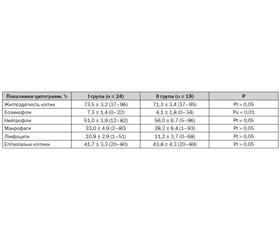
Порівняльний аналіз показників цитограми індукованого мокротиння у дітей із фенотипом тяжкої БА щодо пацієнтів із середньотяжким перебігом хвороби наведений у табл. 1.
З огляду на те, що у здорових дітей максимальний відносний вміст еозинофільних лейкоцитів у мокротинні не перевищує 2 %, частка нейтрофілів та лімфоцитів становить у середньому 46,4 та 3,1 % відповідно, а основними клітинами мокротиння є легеневі мононуклеари, частка яких в індукованому мокротинні зазвичай становить у середньому 50,3 % [1], зауважено, що в обстежених дітей обох клінічних груп визначалося відносне зменшення пулу нормальних клітин захисту легень — альвеолярних макрофагів з одночасним зростанням частки клітин, що асоціюють із запальною реакцією бронхів при БА, — лімфоцитів та гранулоцитів.
Незважаючи на численні літературні повідомлення щодо асоціації фенотипу тяжкої БА у дорослих пацієнтів із нейтрофільним варіантом запалення ДШ [8, 9, 12], значний відносний нейтрофільоз бронхіального секрету частіше визначався серед дітей із середньотяжким перебігом астми. Так, кількість нейтрофільних гранулоцитів (> 80 %) в індукованому мокротинні реєструвалася в кожного четвертого (26,3 %) хворого із середньотяжкою БА та лише у 8,3 % (Рф < 0,05) випадків у І групі спостереження.
Зареєстровано, що вища за норму (≥ 3 %) кількість еозинофілів в індукованому мокротинні відмічалася в більшості (70,8 %) хворих на тяжку БА та лише у чверті (26,3 %) пацієнтів ІІ групи порівняння (Рф < 0,01). При цьому майже повна відсутність (0–1 %) еозинофільних гранулоцитів в індукованому мокротинні реєструвалася в більшості хворих на середньотяжку БА (58,0 %) та лише у двох (8,3 %) пацієнтів І групи порівняння (Рф < 0,01). Водночас відмічено, що хворим на тяжку БА притаманна вираженіша еозинофільна реакція ДШ. Так, значна еозинофілія бронхіального секрету (кількість еозинофільних гранулоцитів ≥ 12 % в індукованому мокротинні) визначалася лише в 10,5 % випадків у ІІ групі, проте реєструвалася в кожного третього пацієнта (29,2 %) з фенотипом тяжкої БА (Рф < 0,05).
Слід зазначити, що серед пацієнтів обох груп спостереження визначалася виражена лімфоцитарна запальна реакція ДШ. Так, відносний вміст лімфоцитів в індукованому мокротинні втричі перевищував регіональний нормальний показник (3,1 ± 0,6 %) як у дітей із фенотипом тяжкої астми (10,9 ± 2,9 %; Р < 0,05), так і хворих із середньотяжким перебігом захворювання (11,2 ± 3,7 %; Р < 0,05). Водночас відносний помірний лімфоцитоз ДШ (відсоток лімфоцитів ≥ 11 % у мокротинні) відзначався в кожного третього (31,6 %) пацієнта ІІ групи порівняння та лише у чверті (25,0 %) хворих на тяжку БА школярів (Рф > 0,05).
Показано, що фенотипу тяжкої БА притаманна вираженіша запальна відповідь ДШ, асоційована з глибоким пошкодженням епітеліального шару бронхів, що відображувалося підвищенням кількості злущеного епітелію в індукованому мокротинні. Так, кількість циліндричних епітеліоцитів у бронхіальному секреті ≥ 50 % траплялася в кожного третього (29,3 %) хворого із фенотипом тяжкої БА та лише в кожного четвертого (26,3 %) школяра ІІ групи порівняння (Рф > 0,05). Такі результати не лише підтверджували наявність пошкодження епітеліального шару бронхів внаслідок хронічного їх запалення при БА, але й припускали можливість вираженішого ремоделювання бронхів у хворих на тяжку БА з формуванням їх ригідності та зниженням гіперсприйнятливості [13]. Про асоціацію структурного пошкодження ДШ із їх ригідністю непрямо свідчив зареєстрований вірогідний обернений взаємозв’язок помірної сили (r = –0,5: P = 0,014) кількості злущеного епітелію в індукованому мокротинні з вираженістю бронходилатації після інгаляції швидкодіючого бета-2-агоніста (за індексом бронходилатації).
Таким чином, у дітей шкільного віку, хворих на середньотяжку БА, реєстрували вираженішу нейтрофільно-лімфоцитарну запальну реакцію ДШ, асоційовану з вираженим нейтрофільозом та незначною еозинофілією у чверті пацієнтів. Такі дані з огляду на здатність інгаляційних глюкокортикостероїдів (ІГКС) не тільки пригнічувати активність лімфоцитів та прискорювати апоптоз еозинофілів, але й подовжувати тривалість життя нейтрофільних гранулоцитів [9, 10] свідчать про необхідність базисного застосування в пацієнтів із середньотяжким перебігом БА помірної стероїдної терапії (малих та середньонизьких доз ІГКС), комбінованої із так званими антинейтрофільними препаратами (метилксантини сповільненої дії, пролонговані бета-2-агоністи, макроліди тощо). Для пацієнтів шкільного віку з фенотипом тяжкої астми характерним виявився гіпереозинофільно-помірно-лімфоцитарний варіант запальної відповіді ДШ, асоційований з ознаками ремоделінгу бронхів унаслідок вираженішого пошкодження їх епітеліального шару, що свідчить про необхідність застосування в даної когорти пацієнтів агресивної гормональної базисної теріпії (максимальних середніх або високих доз ІГКС) у поєднанні з протизапальними препаратами, дія яких спрямована на пригнічення еозинофіл-опосередкованої запальної відповіді (антилейкотрієни, блокатори імуноглобуліну Е, кромони).
Висновки
1. У хворих на бронхіальну астму дітей шкільного віку незалежно від тяжкості захворювання визначається відносне зменшення пулу альвеолярних макрофагів з одночасним зростанням частки клітин, що асоціюються із запальною реакцією бронхів, лімфоцитів та гранулоцитів.
2. Для пацієнтів шкільного віку з фенотипом тяжкої астми характерним є гіпереозинофільно-помірно-лімфоцитарний варіант запальної відповіді дихальних шляхів, асоційований з ознаками вираженішого пошкодження їх епітеліального шару, що потребує комбінації високих доз інгаляційних глюкокортикостероїдів із протизапальними препаратами, дія яких спрямована на пригнічення еозинофіл-опосередкованої запальної відповіді (антилейкотрієни, блокатори імуноглобуліну Е, кромони).
3. Хворим на середньотяжку бронхіальну астму дітям шкільного віку притаманна вираженіша нейтрофільно-лімфоцитарна запальна реакція дихальних шляхів, асоційована у чверті пацієнтів із вираженим нейтрофільозом та незначною еозинофілією, що зумовлює необхідність застосування малих та середньо-низких доз ІГКС у комбінації із так званими антинейтрофільними препаратами (метилксантини сповільненої дії, пролонговані бета-2-агоністи, макроліди тощо) за умови недостатнього контролю астми.
1. Безруков Л.О. Порівняльний аналіз цитологічного складу мокротиння школярів, хворих на бронхіальну астму, при еозинофільному та нейтрофільному характері запалення дихальних шляхів / Л.О. Безруков, О.К. Колоскова, Є.П. Ортеменка // Здоровье ребенка. — 2012. — № 2(37). — С. 28-30.
2. Сучасна класифікація бронхіальної астми у дітей / Ю.Г. Антипкін, В.Ф. Лапшин, Т.Р. Уманець [та ін.] // Перинатологія та педіатрія. — 2011. — № 1. — С. 8-10.
3. Эфендиева К.Е. Циклесонид в лечении бронхиальной астмы у детей / К.Е. Эфендиева, Л.С. Намазанова-Баранова, Ю.Г. Левина и др. // Вопросы современной педиатрии. — 2013. — Т. 12, № 1. — С. 117-122.
4. Asthma severity in childhood, untangling clinical phenotypes / A. Lang, P. Mowinckel, C. Sachs-Olsen [et al.] // Pediatric Allergy and Immunology. — 2010. — Vol. 21, № 6. — Р. 945-953.
5. Bradding P. Asthma: Eosinophil Disease, Mast Cell Disease, or Both? / P. Bradding // Allergy, Asthma, and Clin. Immun. — Vol. 4, № 2 (Summer). — 2008. — P. 84-90.
6. Carolan B.J. Clinical phenotypes of chronic obstructive pulmonary disease and asthma: rrecent advances / B.J. Carolan, E.R. Sutherland // The Journal of Allergy and Clinical Immunology. — 2013. — Vol. 131, № 3. — P. 627-634.
7. Clinical Asthma Phenotypes and Therapeutic Responses [Електронний ресурс] / M. Zedan, G. Attia, M.M. Zedan, A. Osman [et al.] // ISRN Pediatrics. — Volume 2013, Article ID 824781, 7 pages. — Режим доступу: http://dx.doi.org/10.1155/2013/824781
8. Effects of steroid therapy on inflammatory cell subtypes in asthma / D.C. Cowan, J.O. Cowan, R. Palmay [et al.] // Thorax. — 2010. — Vol. 65. — P. 384-390.
9. Fahy J. Eosinophilic and neutrophilic inflammation in asthma. Insights from clinical studies / J. Fahy // Proc. Am. Thoracic Soc. — 2009. — Vol. 6. — P. 256-259.
10. Foley S.C. Images in allergy and immunology: neutrophils in asthma / S.C. Foley, Q. Hamid // J. Allergy Clin. Immunol. — 2007. — Vol. 119 (5). — P. 1282-1286.
11. Green R.H. Stability of inflammatory phenotypes in asthma / R.H. Green, I. Pavord // Thorax. — 2012. — Vol. 67, № 8. — P. 665-667.
12. Haldar P. Noneosinophilic asthma: a distinct clinical and pathologic phenotype / P. Haldar, I.D. Pavord // J. Allergy Clin. Immunol. — 2007. — Vol. 119 (5). — P. 1043-1052.
13. James A.L. Clinical relevance of airway remodeling in airway diseases / A.L. James, S. Wenzel // Eur. Respir. J. — 2007. — Vol. 30. — P. 134-155.
14. Mechanisms of peripheral tolerance to allergens / O.U. Soyer, M. Akdis, J. Ring [at al.] // Allergy. — 2013. — Vol. 68, № 2. — P. 161-170.
15. Sputum induction in severe exacerbations of asthma: safety of a modified method / M.O. Vieira, E. Pizzichini, L.J. Steidle [et al.] // Eur. Respir. J. — 2011. — Vol. 38 (4). — P. 979-980.

/10/10.jpg)