Журнал «Медицина неотложных состояний» 1 (64) 2015
Вернуться к номеру
Сопроводительное лечение осложнений химиотерапии онкологических больных
Авторы: Ренке А.Л. - Киевский областной онкологический диспансер; Жежер А.А., Шлапак И.П. - Кафедра анестезиологии и интенсивной терапии НМАПО имени П.Л. Шупика, г. Киев
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
В статье даются описание и современные методы лечения одного из осложнений химиотерапии онкологических больных — фебрильной нейтропении. Описаны современные методики антибактериальной, противовирусной, противогрибковой терапии. Рассмотрены плюсы и минусы заместительной гемотерапии. Статья рассчитана на врачей-интенсивистов, онкохирургов, онкогинекологов и онкогематологов.
У статті надані описання та сучасні методи лікування одного з ускладнень хіміотерапії онкологічних хворих — фебрильної нейтропенії. Описано сучасні методики антибактеріальної, противірусної, протигрибкової терапії. Розглянуто плюси та мінуси замісної гемотерапії. Стаття розрахована на лікарів-інтенсивістів, онкохірургів, онкогінекологів та онкогематологів.
The article provides description and modern methods of treatment for one of chemotherapy complications in oncological patients — febrile neutropenia. The modern techniques of antibacterial, antiviral, antifungal therapy are described. Pros and cons of replacement hemotherapy are considered. This article is intended for critical care physicians, oncosurgeons, oncogynecologists and oncohematologists.
фебрильная нейтропения, антибактериальная терапия.
фебрильна нейтропенія, антибактеріальна терапія.
febrile neutropenia, antibacterial therapy.
Статья опубликована на с. 20-26
Лечение онкологических заболеваний включает следующие основные направления:
— хирургическое вмешательство;
— химиотерапию;
— лучевую терапию;
— иммунотерапию;
— гормонотерапию;
— таргетную терапию моноклональными антителами;
— комбинацию различных тактик.
Наряду с перечисленными применяют также трансплантацию гемопоэтических стволовых клеток или костного мозга, одним из компонентов которой является также химиотерапия в крайне агрессивных режимах. Распространенным является мнение не только обывателя, но и врача, не специализирующегося в онкологии, что от химиотерапии пациент умирает раньше, чем от рака. Действительно, habitus больного, получающего химиотерапевтический протокол, достаточно характерен и тягостен: алопеция, кахексия, тяжелейшая мышечная слабость, шатающиеся зубы, диарейный синдром. На самом деле тезис о том, что онкологи живут и трудятся в век более безопасной хирургии, чем терапии, имеет место быть. Врачу-неонкологу требуется четкое понимание целей, задач, рисков и опасностей химиотерапевтического лечения.
Больные со злокачественными опухолями подразделяются на пять основных групп по эффективности у них химиотерапии и гормонотерапии:
Группа 1 — потенциально излечимые при использовании только системной терапии.
Группа 2 — получающие адъювантную терапию с доказанной клинической эффективностью при локальных процессах.
Группа 3 — имеющие паллиативный эффект только при метастатических процессах.
Группа 4 — получающие улучшение контроля над местным процессом.
Группа 5 — больные, у которых химиотерапия неэффективна.
Нужно сказать, что в лечении различных видов онкопатологии, в зависимости от вида опухоли и стадирования, доминирующим методом может быть как один из указанных в начале статьи (например, хирургическое лечение, лучевая терапия), так и их комбинация. В связи с этим важное место занимает возможность проведения неоадъювантной (то есть предшествующей основному лечению) химиотерапии, что, например, способствует проведению оперативного вмешательства по радикальной программе. Из вышесказанного, с позиции простого здравого смысла, становится ясно, что чем больше шансов у пациента на выздоровление, тем более агрессивные и опасные схемы лечения будут ему предложены. Поэтому осложнения химиотерапии могут быть как облигатными, так и факультативными. И если пациенты с облигатными осложнениями химиотерапии мониторируются профильными специалистами онкоучреждений, то с факультативными осложнениями, угрожающими жизни пациента, может столкнуться врач-интенсивист любой клиники. Причин этому несколько:
— онкологические учреждения в Украине, как правило, не оказывают ургентной помощи. То есть ночью по «скорой» пациент может быть и не принят, хотя лечение проходит в данной онкоклинике;
— осложнения химиотерапии часто возникают с отсрочкой по времени до десяти и более суток. В этот период пациент находится дома без мониторинга лабораторных показателей, общего состояния и физикальных данных. Обобщенная фраза участкового врача или врача неотложной помощи «Что же вы хотели? У вашего родственника РАК!» стала притчей во языцех;
— на сегодняшний день граждане Украины, страдающие онкопатологией, имеют возможность получить базисную химиотерапию в онкоклиниках крупных областных центров и за рубежом, а потом остаться «с глазу на глаз» с осложнениями там, где системная онкологическая помощь не налажена и развившаяся патология ставит местного доктора в тупик.
Эту статью мы адресуем тем врачам-интенсивистам, кому на местах чистить «авгиевы конюшни» осложнений, полученных с нелегкой руки их коллег из специализированных онкоклиник, как отечественных, так и зарубежных.
Вопросы профилактики в связи с этим рассматриваться не будут, а будут разобраны только наиболее частые осложнения и основные концепции их терапии.
Самой частой и значимой в плане угрозы жизни пациента является химиоиндуцированная фебрильная нейтропения (ФН), при отсутствии терапии трансформирующаяся в септический шок, начинающийся, как правило, молниеносно и атипично. Фебрильная нейтропения часто является компонентом панцитопении, при которой ввиду цитотоксического воздействия препаратов подавляются все три ростка костного мозга. Согласно критериям Американского общества инфекционистов IDSA, фебрильная нейтропения — состояние, при котором уровень гранулоцитов меньше или равен 0,5 x 109, температура тела дважды в сутки превышает 38,0 °С или хотя бы один раз 38,3 °С. Характерным является то, что признаком активности микроорганизмов является лихорадка при отсутствии классических симптомов (боль, гиперемия, отек). Нет нейтрофилов — нет гноя! Даже деструктивные процессы кожи и мягких тканей проявляются зонами некроза. Практически отсутствуют физиологические барьеры на протяжении всей кишечной трубки, гортаноглотки, трахеобронхиального дерева. Происходит массивная транслокация возбудителя в изначально стерильные среды, развивается бактериемия, иногда — септицемия. Ввиду того, что пациент получал химиотерапию в условиях стационара, часто неоднократно, следует ожидать наличия нозокомиальной инфекции. Отдельно нужно отметить, что в отсутствие барьерных функций нормальная микрофлора кишечника тоже может транслоцироваться. Вследствие этого назначение пробиотиков в лечении диарейного синдрома у данной категории больных не рекомендуется до восстановления нормального уровня гранулоцитов. Также массивные клизмы, применяемые с целью детоксикации и стимуляции перистальтики, могут способствовать транслокации возбудителя.
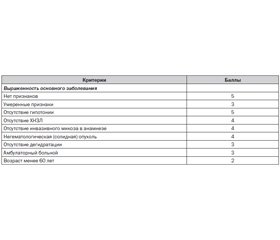
До недавнего времени лихорадка у больных с нейтропенией была абсолютным показанием к госпитализации. Однако после введения MASCC (система прогностического индекса риска осложнений), которая представлена в табл. 1, эти показания перестали быть столь жесткими.
Если индекс MASCC больше или равен 21 баллу, то риск проведения терапии в амбулаторных условиях минимален.
Здесь и далее речь будет идти только о пациентах с фебрильной нейтропенией высокого риска. Факторы, определяющие высокий риск развития осложнений у больных с фебрильной нейтропенией, представлены ниже.
Факторы, определяющие высокий риск развития осложнений у больных ФН
Общие характеристики:
— Статус по шкале ECOG > 2.
— Прогрессирование опухоли.
— < 7 дней после последнего введения цитостатиков.
— Ожидаемая длительность нейтропении > 7 дней.
Клиническая симптоматика:
— Повышение температуры более 39 °С.
— Склонность к гипотонии.
— Клинические проявления инфекции.
— Признаки желудочно-кишечной токсичности (мукозит, диарея).
— Декомпенсация сопутствующей патологии.
— Лабораторные показатели:
– нейтрофилы < 0,1 x 109/л;
– тромбоциты < 50 x 109/л;
– гемоглобин < 70 г/л.
— Увеличение биохимических показателей функции почек и печени более чем в 2 раза от наивысшего уровня нормы.
— Прогностический индекс < 21 балла по шкале MASCC.
Шкала ECOG разработана для оценки физического состояния больных. Данная шкала представлена в табл. 2.
Пациент при поступлении должен быть максимально изолирован. Идеалом может быть отдельный бокс по аналогии с инфекционным отделением. При невозможности изоляции и отсутствии необходимости проведения респираторной поддержки — облигатно-масочный режим со сменой маски пациенту каждые четыре часа, строгая асептика, подход персонала к пациенту только в свежей маске. Бокс следует обрабатывать дважды в день дезинфицирующим раствором (хлорамин и т.п.). Из питания пациента в это время необходимо исключить свежие фрукты, овощи, твердые сыры, мясные и рыбные копчености и т.п. (разрешаются бананы с неповрежденной кожурой). Другая пища должна быть асептической (оптимально — пастеризация в микроволновой печи), то есть должна готовиться непосредственно перед применением и не сохраняться. Запрещается готовить заранее!
Возникновение симптомокомплекса ФН является прямым основанием для проведения ряда диагностических процедур и немедленного (в течение 1 часа!) назначения противомикробной терапии. Диагностические процедуры должны быть проведены до назначения лечения, т.е. практически сразу после выявления ФН. Диагностическая панель включает в себя следующие мероприятия:
— осмотр с выявлением скрытых очагов инфекции (кожа, места пункций, катетеризации, перианальная область, ногти, видимые слизистые);
— посев крови, мочи, отделяемого из полости рта, мест катетеризации, мазков со слизистых полости рта, зева, влагалища;
— рентгенография органов грудной клетки;
— ультразвуковое исследование брюшной полости;
— клинический анализ крови, мочи;
— биохимический анализ крови (белок, билирубин, мочевина, креатинин, активность трансаминаз, щелочная фосфатаза, лактатдегидрогеназа, С-реактивный белок, электролиты).
Дважды в день необходимо обрабатывать слизистую оболочку ротовой полости марлевым тампоном с раствором питьевой соды (1 чайная ложка соды на стакан кипяченой теплой воды) и полоскать этим же раствором полость рта и горло после каждого приема пищи.
В период ФН проводится деконтаминация ЖКТ. Могут быть рекомендованы:
— метронидазол — в сроки более чем 2 недели от начала селективной деконтаминации в дозе 20–30 мг/кг/сут в 2–3 приема в течение 7 дней;
— гентамицин — реr оs в максимальных суточных дозах на протяжении всего периода агранулоцитоза;
— канамицин — реr оs в максимальных суточных дозах на протяжении всего периода агранулоцитоза. Аминогликозиды per os не оказывают токсического системного воздействия, действуя в кишечной трубке;
— неабсорбирующийся препарат нитрофуранового ряда в соответствующих дозах (нифуроксазид — 2 таблетки 4 раза в день);
— при наличии лимфопении (уровень лимфоцитов < 300/мм3) назначается ацикловир реr оs 750 мг/м2 в сутки в 4 приема 5 суток.
Начало комбинированной противомикробной терапии и проведение мероприятий по предотвращению развития септического шока у пациентов с фебрильной нейтропенией являются ургентными. Они начинаются одновременно!
Профилактика септического шока
По возможности (приемлемый уровень тромбоцитов, отсутствие явлений гипокоагуляции) должен быть установлен центральный венозный катетер с контролем центрального венозного давления 4 раза в сутки или более, при негативной клинической динамике проводится нагрузка кристаллоидами в объеме 2000–3000 мл/м2/сут (но не более 3 литров суммарно взрослому) с добавлением калия 50 ммоль/м2/сут. Следует оценить сократительную способность миокарда. При сниженной фракции выброса доза волемической нагрузки редуцируется. Расчетная доза вводится только круглосуточно непрерывно. На введении антибиотиков параллельная инфузия прерывается (предотвращение увеличения их клиренса!). Дефицит диуреза при этом не должен превышать 200 мл/м2 за 6 часов. В случае превышения этого показателя — фуросемид в/в в дозе 0,1–0,5 мг/кг (максимальная суточная доза не должна превышать 10 мг/кг) или торасемид 20–40 мг. В случае угрозы развития шока (тахикардия, увеличение частоты дыхательных движений (ЧДД), устойчивая тенденция к снижению артериального давления (АД), быстрый лизис температуры до субнормальных показателей, профузный диарейный синдром) необходимо ориентироваться не на дефицит диуреза за 6 часов, а на почасовой диурез, который должен быть не ниже 100 мл/м2 в час. Если уровень клубочковой фильтрации ниже этого показателя, вводится фуросемид почасово в дозе 0,4 мг/кг в час или торасемид 10–20 мг ежечасно — до нормализации диуреза. Возможна комбинация с осмодиуретиками при отсутствии угрозы отека легких. При этом проводится почасовой контроль температуры тела, АД, частоты сердечных сокращений, ЧДД. Что касается частоты пульса: пациенты, получившие несколько блоков химиотерапии, имеют тенденцию к устойчивой тахикардии. В обычной ситуации контроль этих показателей необходимо проводить 1 раз в 6 часов. Бикарбонат натрия в инфузионную программу может быть добавлен при необходимости только под контролем кислотно-основного состояния крови.
Инфузия прекращается минимум через 24 часа после первого введения одной комбинации антибиотиков и/или через 24 часа после нормализации температуры.
Каждая новая комбинация антибиотиков должна сопровождаться такой же параллельной инфузией в течение не менее 24 часов от первого введения.
Очень важным является поддержание температуры тела на уровне ниже 38,5 °С в течение всего времени фебрильного эпизода у нейтропенического пациента (38,5 °С — значительное повышение угрозы развития шока) путем внутривенного введения 50% раствора метамизола и/или парацетамола при каждом подъеме температуры 38,5 °С (без периода ожидания, под контролем АД) непосредственно перед введением антибиотика и через 30 и 60 минут — после. Это связано с угрозой развития синдрома Яриша — Герксгеймера.
Противомикробная терапия при фебрильной нейтропении
Практически всегда для поступившего больного антибактериальная терапия на старте будет эмпирической, но проведение ее согласно концепции деэскалации в практике не всегда представляется возможным.
Если инициальная эмпирическая схема «дождалась» результата посева, то вероятность того, что она будет отменена при клинической ее эффективности, очень мала. Скорее всего, она будет усилена дополнительным препаратом, по результату чувствительности, для наиболее быстрой эрадикации возбудителя и при отсутствии клинической эффективности — заменена на альтернативную схему.
Основными особенностями ФН являются высокий риск развития оппортунистических инфекций (основные тактики лечения будут перечислены ниже) и наличие нозокомиальной полирезистентной флоры, особенно у пациентов гематологического профиля ввиду их длительного нахождения в стационаре. Перед назначением эмпирической противомикробной терапии необходимо:
— провести все диагностические мероприятия;
— определить степень риска инфекции;
— оценить необходимость включения в первый ряд терапии ванкомицина, тейкопланина, линезолида.
Включение одного из этих препаратов в первоначальную эмпирическую терапию целесообразно у больных в следующих клинических ситуациях:
— клинически подозреваемая катетер-ассоциированная инфекция;
— наличие данных о колонизации пенициллин- и цефалоспорин-резистентных кокков или метициллинрезистентных;
— гипотензия или другие признаки сердечно-сосудистых нарушений.
Кроме того, в 10–15 % случаев причиной инфекции у больных с ФН могут быть грибы. Бактериальные и грибковые инфекции могут успешно сосуществовать, при этом одна может маскировать другую. Клиническим признаком микоза является стабильно высокая лихорадка на фоне введения антибиотиков. В дополнение: при рентгенодиагностике могут выявляться инфильтраты в легких. Наиболее частыми возбудителями грибковой лихорадки являются все виды Candida spp. или Aspergillus. С учетом трудностей диагностики микозов назначают противогрибковые средства пациентам, лихорадящим в течение 5 дней на фоне антибактериальной эрадикации. Прогноз грибковой септицемии остается неблагоприятным (летальность 30–40 %) и в большой степени зависит от адекватного лечения.
В табл. 3 представлена классификация противогрибковых препаратов, которые используются у больных с ФН.
Антибактериальная терапия должна отвечать следующим требованиям:
— широкий спектр активности;
— синергизм препаратов, используемых для скорейшего достижения эффекта;
— предупреждение развития резистентности;
— учет чувствительности госпитальной микрофлоры;
— при подборе следующей комбинации в первую очередь необходимо ориентироваться на результаты микробиологических исследований, выполненных в первый день развития фебрилитета.
В это же время полное микробиологическое обследование должно быть выполнено в объеме всех пунктов независимо от наличия или отсутствия явных показаний. В этой ситуации, кроме того, необходимы:
— КТ туловища (обратить особое внимание на легкие, печень, селезенку, почки);
— бактериоскопическое и бактериологическое исследование ликвора;
— осмотр глазного дна;
— КТ черепа — при показаниях (очаговая и общемозговая неврологическая симптоматика);
— удаление центрального катетера при наличии хотя бы минимальных признаков воспаления тканей на месте установки с микробиологическим исследованием его части, находившейся под кожей.
Особое внимание необходимо обратить на очаги, которые могут быть обнаружены при клиническом обследовании: мукозит, перианальный инфильтрат, легочные инфильтраты, дыхательная недостаточность, дефекты и инфильтраты слизистых оболочек и кожи, лимфаденит, очаговая неврологическая симптоматика, абдоминальные проблемы, нарушения сердечной, почечной деятельности и др. с их микробиологическим анализом по возможности.
При наличии псевдомембранозного энтероколита ванкомицин одновременно с парентеральным введением должен назначаться реr os.
Необходимо назначение в более ранние сроки амфотерицина В — при наличии глубокого грибкового поражения слизистой ротовой полости, кожи или четко очерченного очага в паренхиме легких (КТ). Также назначаются: метронидазол — при наличии тяжелого (с дефектами тканей) эндоцеллюлита слизистой ротовой полости/пищевода и/или перианального инфильтрата; бисептол — при наличии диффузной легочной симптоматики (интерстициальная/сливная/прикорневая пневмония). При наличии дыхательной недостаточности парентеральное назначение бисептола является ургентным независимо от заключения рентгенолога (так протекает интерстициальная пневмоцистная пневмония у больных с фебрильной нейтропенией). Доза бисептола высокая — 20 мг/кг по триметоприму. Зовиракс — при наличии герпетических поражений кожи/слизистых или при подозрении герпетической инфекции другой локализации (ЦНС, легкие и т.д.).
При подозрении на ЦМВ-инфекцию (особенно в случаях серологической ЦМВ-позитивности) — ЦМВ-пневмония, ЦМВ-гепатит и т.д. — должен быть назначен ганцикловир, валацикловир или фоскарнет. При отсутствии этих препаратов используется зовиракс, который может быть эффективным в этих случаях примерно у 30 % пациентов. Наличие тяжелой, с нарушением жизненно важных функций, аспергиллезной и/или кандидозной инвазии резистентными видами делает необходимым назначение амфотерицина В, липосомального амфотерицина В (амбизома), каспофунгина (кансидаса), вориконазола (вифенда), анидулафунгина (эраксиса).
Инфекционный гепатит В и С (активность процесса документирована серологически) должен быть пролечен рекомбинантным интерфероном в дозе 1–2 млн МЕ 10–21 день и далее по 4 млн МЕ 3 раза в неделю от 2 до 6 месяцев или же пегилированными формами интерферона с добавлением липоевой кислоты в высоких дозах внутривенно или рer оs.
Использование в подобной ситуации концентрата донорских гранулоцитов (полученных путем аппаратного цитафереза) допускается только при условии подбора донора по системе НLА и после облучения концентрата в дозе 30 г.
Тактика, которая категорически не может быть рекомендуемой
1. Антибактериальная монотерапия, которая может использоваться в любых других ситуациях, недопустима у пациентов с фебрильной нейтропенией на фоне интенсивной химиотерапии, даже в случаях определенной идентификации возбудителя, поскольку всегда в подобной ситуации существует потенциальная возможность невыявленной микст-инфекции и развития перекрестной резистентности возбудителей.
2. Недопустимо использование в лечебных целях цефалоспоринов ниже третьего поколения и пенициллинов, которые не имеют антибеталактамазной активности, поскольку они малоэффективны в отношении оппортунистической микрофлоры.
3. Недопустимо использование в лечебных целях препаратов рer оs (кроме тех, для которых этот путь введения обусловлен специально) и в виде внутримышечных и подкожных инъекций, кроме инъекций инсулина (опасность образования абсцессов на фоне иммуносупрессии и гематом на фоне тромбоцитопении).
4. Не может быть рекомендовано однократное введение всей суточной дозы препарата, что допустимо в других ситуациях, поскольку всегда имеет место высокий клиренс за счет поддержания высокого темпа диуреза (профилактика септического шока), за исключением амфотерицина В.
5. Не имеет смысла одновременное использование двух цефалоспоринов или аминогликозидов, поскольку в этом случае отсутствует синергизм при увеличении токсичности.
6. Недопустимо прекращение антибактериальной терапии ранее чем через 3 суток с момента нормализации температуры из-за опасности формирования резистентных штаммов и реинфекции.
7. Недопустимо начинать антимикробную терапию без сопровождающей профилактической инфузии, учитывая значительную опасность развития инфекционно-токсического шока.
8. Недопустима редукция доз препаратов (кроме случаев почечной или печеночной недостаточности, когда дозы могут быть модифицированы только с учетом клиренса креатинина или четко указаны в инструкции, исходя из маркеров печеночной дисфункции), а также произвольное изменение способа и режима введения, поскольку это может привести к снижению терапевтической эффективности, формированию перекрестной резистентности возбудителей и повышению токсической нагрузки на организм пациента.
Трансфузиологическое обеспечение
Замещение эритроцитов
Замещение эритроцитов проводится при уровне гемоглобина менее 70 г/л эритроконцентратом (эритроцитарной массой). У пациентов с лейкемией при начальном гиперлейкоцитозе > 50 000/мм3 замещение эритроцитов до нормы категорически запрещается! В этой ситуации трансфузии эритроцитов осуществляются только при наличии гипоксемии.
Замещение тромбоцитов
Тромбоцитопения является одним из краеугольных камней в комплексе осложнений химиотерапии. Дело в том, что возмещение тромбоцитов в достаточном количестве путем трансфузии тромбоконцентрата является проблемой и для большинства крупных центральных клиник ввиду того, что:
1) под рукой должен быть обследованный донор (наличие базы данных);
2) должен быть обученный аппаратному цитаферезу специалист;
3) должны наличествовать сам аппарат и расходные материалы к нему;
4) требуется наличие шейкера для тромбоконцентрата, который при хранении должен постоянно перемешиваться;
5) получение тромбоконцентрата со стационарных станций переливания крови может занять несколько суток (поиск и обследование донора, приготовление тромбоконцентрата, его транспортировка).
А чем же он настолько лучше известной лейкотромбомассы? Всем!
1. Что такое одна доза тромбоконцентрата? Это доза тромбоцитов, полученных из одной стандартной донорской дозы крови. В лейкотромбомассе она одна, а в тромбоконцентрате их много (в современных технологиях приоритетным является здоровье донора, поэтому количество отобранных тромбоцитов в разных контейнерах может различаться — в среднем 5 доз, приблизительно как из двух литров крови).
2. При отсутствии шейкирования при хранении и транспортировке тромбоциты попросту слипаются, теряя почти всю свою активность. А это «неизвестно что» еще и надо ввести в вену!
3. Трансфузия лейкотромбомассы только по системе АВО приводит к тяжелейшей аллоиммунизации.
Трансфузия лейкотромбомассы возможна только в ситуации, если иначе смерть пациента неминуема, и неминуема в самые короткие сроки.
Уровни тромбоцитопении и выбор лечебной тактики:
1) при 50–100/мкл возможно проведение ургентных операций с последующим восполнением уровня тромбоцитов;
2) при 30–50/мкл возможно проведение малоинвазивных операций, катетеризаций и т.д.;
3) при 20–30/мкл проводить любые хирургические вмешательства нельзя, трансфузия тромбоцитов проводится при геморрагическом синдроме;
4) если меньше 20/мкл, показана трансфузия даже без геморрагического синдрома.
N.B.! Даже у молодых пациентов, даже у детей, даже с нормальным АД, при тромбоцитах меньше 20/мкл нужно быть готовым к геморрагическому инсульту!
Замещение плазменных факторов проводится свежезамороженной плазмой, которая вводится при их дефиците (как ориентир может использоваться уровень фибриногена плазмы < 2 г/л) в дозе до 30 мл/кг/сут в 3 приема.
Применение ростовых факторов для ликвидации нейтропении
Показания к применению гемоцитокинов у больных с ФН. Использование рекомбинантных гемопоэтических факторов (Г-колониестимулирующий фактор (КСФ), ГМ-КСФ) (граноцит, нейпоген, неуластим) для стимуляции ростков кроветворения и преодоления миелосупрессии при ФН рассматривалось в нескольких рандомизированных исследованиях. Это связано со сложностью оценки эффекта КСФ на фоне антибактериальной терапии, которая в большинстве случаев имеет положительный ответ. Сегодня на основании опубликованных совместных результатов можно сделать следующие выводы и дать рекомендации по назначению КСФ больным в период фебрильной нейтропении:
1) использование КСФ достоверно снижает длительность нейтропении;
2) не выявлено положительного влияния КСФ на течение ФН (продолжительность лихорадки, длительность антимикробной терапии);
3) не выявлено снижения стоимости лечения эпизода ФН;
4) не выявлено влияния КСФ на уровень смертности от инфекций;
5) не оправдано рутинное применение КСФ у больных с неосложненной ФН (неосложненная ФН определяется как лихорадка продолжительностью менее 10 дней без признаков тяжелых инфекций и органной дисфункции);
6) применение КСФ оправдано у больных с высоким риском развития жизненно опасных инфекционных осложнений.
Ростовые факторы абсолютно показаны при глубокой нейтропении (абсолютное число нейтрофилов < 0,1 в 1 мкл), отсутствии ремиссии опухоли, пневмонии, гипотензии, сепсисе с полиорганной недостаточностью, инвазивном микозе, в возрасте старше 65 лет, при ранней постцитостатической лимфопении, склонности к гипотонии. Нужно сказать, что абсолютные и относительные показания к назначению ростовых факторов разнятся в протоколах ведения больных разных исследовательских студий. Так, например, в детской практике они назначаются при фебрильной нейтропении практически всегда.
Немаловажным моментом является довольно частое ухудшение состояния пациента после восстановления уровня гранулоцитов. Ведь роль нейтрофилов в механизмах системного воспалительного ответа, синдрома полиорганной недостаточности и септического шока достаточно хорошо изучена.
Данная статья, основанная на литературных данных, вобрала в себя 15-летний опыт работы коллектива Киевского областного онкологического диспансера. Авторы благодарят коллег онкохирургов, онкогематологов, детских онкогематологов, онкогинекологов за предоставленную информацию и многолетнее плодотворное сотрудничество.
1. Орлова Р.В., Чубенко В.А. Фебрильная нейтропения. Инфекционно-токсический шок // Практическая онкология. — 2006. — Т. 7, № 2. — С. 69–76.
2. Румянцев А.Г., Масчан А.А., Самочатова Е.В. Сопроводительная терапия и контроль инфекций при гематологических и онкологических заболеваниях. — М.: Медпрактика-М, 2006. — 235 с.
3. Масчан А.А., Румянцев А.Г. Трансплантация гемопоэтических стволовых клеток у детей. — М.: Медицинское информационное агентство, 2003. — 325 с.
4. Стецюк И.В., Донская С.Б., Рыжак О.А. Лечение инфекционных осложнений у пациентов детского возраста в состоянии нейтропении, индуцированной предшествующей цитостатической терапией. — Киев, 2002. — 413 с.
5. Дыма С.В., Дербенева Н.А., Ренке А.Л. Лечение инфекционных осложнений у пациентов детского возраста в состоянии нейтропении, индуцированной предшествующей цитостатической терапией. Локальный протокол 2009 г.
6. Дмитриева Н.В., Петухова И.Н. Рациональные подходы к лечению фебрильной нейтропении у онкологических больных. — М.: Боргес, 2003. — 73 с.
7. Птушкин В.В. Лечение и профилактика химиолучевого лечения у больных с лимфомами // Практическая онкология. — 2004. — Т. 5, № 3. — С. 223–230.
8. Тец В.В. Микроорганизмы и антибиотики. Сепсис. — СПб.: Эскулап, 2003. — 154 с.
9. Cometta A., Kern W.V., De Bock R. et al. Vancomycin versus placebo for treating persistent fever in patients with neutropenic cancer receiving piperacillin-tazobactam monotherapy // CID. — 2003. — № 37. — P. 382–389.
10. Hughes W.T., Armstrong D., Bodey G.P. et al. Guidelines for the use of antimicrobial agents in neutropenic patients with cancer // CID. — 2002. — Vol. 34. — P. 730–751.
11. Klastersky J., Paesmans M., Rubenstein E.B. The Multinational Association for Supportive Care in Cancer Risk Index: A Multinational Scoring System for Identifying Low-Risk Febrile Neutropenic Cancer Patients // JCO. — 2000. — Vol. 18. — P. 3038–3051.
12. Lin S., Schranz J., Teutsch S.M. Aspergillosis case-fatality rate // CID. — 2001. — Vol. 32. — P. 358–366.
13. Pizzo P.A., Robichaud K.J., Gill F.A. et al. Empiric antibiotic and antifungal therapy for cancer patients with prolonged fever and granulocytopenia // Amer. J. Med. — 1992. — Vol. 72. — P. 101–111.
14. Trillet-Lenoir V., Green J., Manegold C. et al. Recombinant granulocyte colony stimulating factor reduces the infectious complications of cytotoxic chemotherapy // Europ. J. Cancer. — 2009. — Vol. 29A. — P. 319–322.
15. Haematopoietic Stem Cell Transplantation. The EBMT Handbook / Ed. by J. Apperley, E. Carreras, E. Gluckman, A. Gratwohl, T. Masszi. — 2008. — 356 p.

/21/21.jpg)
/22/22.jpg)
/24/24.jpg)