Журнал «Здоровье ребенка» 1 (60) 2015
Вернуться к номеру
Ефективність лікування респіраторних вірусних захворювань у дітей із використанням бактеріальних лізатів
Авторы: Абатуров О.Є. - Дніпропетровська медична академія; Токарева Н.М. - Дніпропетровська міська дитяча клінічна лікарня № 1
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У статті розглянуто проблему гострих респіраторних інфекційно-запальних захворювань у дітей. Описані функції системи неспецифічного захисту, надана характеристика препаратів, що застосовуються для патогенетичного лікування респіраторних інфекцій, — бактеріальних лізатів.
В статье рассматривается проблема острых респираторных инфекционно-воспалительных заболеваний у детей. Описаны функции системы неспецифической защиты, а также дана характеристика препаратов, применяющихся для патогенетического лечения респираторных инфекций, — бактериальных лизатов.
The problem of acute respiratory infectious and inflammatory diseases in children is considered in the article. The functions of nonspecific defense system are described, and there are also given the characteristics of drugs used for the pathogenic treatment of respiratory infections — bacterial lysates.
діти, респіраторні інфекції, лікування, бактеріальні лізати.
дети, респираторные инфекции, лечение, бактериальные лизаты.
children, respiratory infections, treatment, bacterial lysates.
Статья опубликована на с. 21-24
Вступ
Інфекційні захворювання дихальних шляхів становлять соціальну, медичну та економічну проблему, яка щороку загострюється. У структурі дитячої інфекційної патології гострі респіраторні вірусні інфекції (ГРВІ) становлять до 80,0 %, і тенденція до зниження їх частоти відсутня. На сьогодні існує гостра потреба в ефективних програмах удосконалення профілактики та лікування ГРВІ, особливо серед дитячої популяції. Вирішення цієї проблеми ускладнюється широким спектром етіологічних факторів гострих респіраторних інфекцій, а також обмеженими можливостями їх верифікації. Діагноз ГРВІ встановлюється лікарем на підставі клінічних ознак, стартова терапія призначається емпірично [1, 2, 9, 13, 16].
Різноманітність і численність збудників інфекційних захворювань, з якими перманентно стикається слизова оболонка респіраторного тракту (у середньому міський житель вдихає не менше 104–105 різних мікроорганізмів), припускає наявність складної, мультикомпонентної організації локального захисту респіраторного тракту [15, 18].
Прийняття рішень щодо використання того чи іншого препарату для лікування ГРВІ — складний процес, що включає в себе оцінку ефективності потенційних ризиків та економічної вигоди за умов обмеженого фонду специфічних противірусних засобів для лікування ГРВІ у дітей. Враховуючи вищенаведене, ми вважаємо за доцільне вивчення профілактичного та лікувального використання бактеріальних лізатів як препаратів, здатних підсилити неспецифічну імунну відповідь [6, 8, 16].
Відкриття цитокінів та вивчення їх ролі, особливо ролі інтерферонів (IFN) у патогенезі ГРВІ, визначили пріоритети дослідження цитокінового статусу для розуміння патогенезу вірусних інфекцій та причин формування ускладненого перебігу захворювань, а також вплинули на розробку нових напрямків лікування вірусних захворювань, зокрема застосування препаратів, здатних активувати неспецифічний імунний захист організму [3–5, 10, 11].
Інтерферон є важливим медіатором імунної системи, що продукується відразу після надходження вірусу в організм та індукує розвиток неспецифічного противірусного імунного захисту. Але для запобігання подальшому розвитку інфекційного процесу ендогенного інтерферону недостатньо, до того ж ряд вірусів пригнічує його продукцію. Для більшості вірусних інфекцій встановлено пряму залежність між вмістом інтерферону в крові і тяжкістю захворювання. При тяжкому перебігу захворювання рівень інтерферону, а також інтерферон-продукуюча активність клітин макрофагально-моноцитарної лінії знижується, а при легкому — зростає [1, 2].
Існують два основних підходи до використання інтерферону при вірусних захворюваннях — введення готових препаратів екзогенного та стимуляція вироблення ендогенного інтерферону. Застосування готових препаратів інтерферону людини є ефективним, але їх виготовлення є дорогим та складним процесом. Іншим методом лікування захворювань вірусної природи є індукція власного (ендогенного) інтерферону. Після стимуляції утворюється високоактивний інтерферон, специфічний для організму-господаря. У продукції ендогенного інтерферону беруть активну участь різноманітні клітини організму, відбувається стимуляція інших механізмів неспецифічної резистентності (фагоцитоз, утворення антитіл, система комплементу та ін.). У той же час у літературі є досить багато даних про імуномодулюючі ефекти бактеріальних лізатів [7, 12–15, 18].
Використання бактеріальних лізатів зумовлює контакт антигенів найбільш значущих збудників гострих респіраторних захворювань з макрофагами, що перебувають у слизових оболонках респіраторного та шлунково-кишкового тракту, з подальшою їх презентацією лімфоцитам MALT-системи (лімфоїдна тканина, асоційована зі слизовими). У результаті цього з’являються комітовані клони В-лімфоцитів, що продукують специфічні антитіла до антигенів збудників, що містяться в бактеріальних імунотропних препаратах. Крім того, міграція комітованих В-лімфоцитів в інші лімфоїдні утворення MALT-системи і подальша їх диференціація в плазмоцити призводять до продукції специфічного секреторного IgA і розвитку ефективного місцевого імунного захисту проти основних збудників гострих респіраторних захворювань. Оскільки бактеріальні лізати представлені комплексними препаратами, що містять РАМР, одним із механізмів їх дії є вплив на вроджену імунну систему переважно через сигнальні образрекогнуючі рецептори. Ефективність використання цієї групи препаратів пов’язана з активацією ефекторів вродженого імунітету. Призначення імуномодуляторів бактеріального походження набуло значного поширення в багатьох країнах: на сьогодні в усьому світі з моменту їх комерціалізації даними препаратами було проліковано близько 150 млн пацієнтів [6, 7, 11, 14, 16, 17].
Мета дослідження. Завданням нашого дослідження стало вивчення можливостей посилення противірусної відповіді імунної системи застосуванням бактеріального лізату OM-85.
Матеріали та методи
У дослідження було включено 40 пацієнтів із діагнозом ГРВІ середнього ступеня тяжкості, це діти обох статей віком від 6 міс. до 8 років. Всі пацієнти звернулися в клініку на 1–2-й день від початку захворювання.
Відповідно до схеми рандомізації діти були розподілені у співвідношенні 1 : 1 на дві групи — основну та контрольну, по 20 пацієнтів у кожній.
Пацієнти основної групи, окрім терапії, рекомендованої стандартами лікування МОЗ України, отримували OM-85 у дозі 3,5 мг 1 раз на добу протягом 10 днів із подальшим прийомом ще двох курсів препарату по 10 днів у наступні 2 місяці. Перерва між прийомами препарату становила 20 днів. Пацієнти контрольної групи отримували тільки базисну терапію ГРВІ. Обидві групи були ідентичними за гендерними та віковими ознаками. Усі пацієнти пройшли повний курс лікування і були включені в аналіз ефективності та переносимості.
Ефективність OM-85 у лікуванні гострих респіраторних інфекцій у дітей оцінювали на підставі даних динаміки клінічних проявів захворювання, показників клінічного аналізу крові, рівня IFN-a в сироватці крові.
Визначення IFN-a у сироватці крові дітей проводили при надходженні в клініку (не пізніше 36 годин після початку захворювання) і на 3-тю добу терапії імуноферментним методом на спектрофотометрі Sanofi Diagnostics Pasteur PR 2100 за допомогою комерційних тест-систем IFN-a Elisa Kit фірми Diaclone (Франція). Забір крові з периферичних вен здійснювали вранці натщесерце, перед прийомом ліків і фізіотерапевтичних процедур, у стерильні сухі пробірки, які маркували і негайно доставляли в лабораторію.
Отримані результати
В анамнезі у 4 (20 %) дітей основної групи і у 3 (15 %) дітей контрольної групи спостерігалися часті респіраторні захворювання верхніх дихальних шляхів; у 3 (15 %) дітей основної та у 2 (10 %) контрольної — хронічний тонзиліт, в 1 (5 %) основної та в 1 (5 %) контрольної — рецидивуючий бронхіт.
У клінічній картині пацієнтів до початку терапії переважали симптоми інтоксикації: підвищена температура тіла (38,5 ± 0,5 °С), блідість шкіри, зниження апетиту. При огляді у всіх пацієнтів основної та контрольної груп визначалися виділення з носа, незначна і помірна лімфаденопатія. Кашель був у 7 (35 %) хворих основної групи і у 10 (50 %) контрольної. При аускультації у 18 (90 %) пацієнтів основної групи і у 17 (85 %) контрольної спостерігалося жорстке дихання; у 4 (20 %) пацієнтів основної групи і у 5 (25 %) контрольної — сухі розсіяні хрипи.
Порушень із боку серцево-судинної системи (зміни показників артеріального тиску, характеристик пульсу, тонів серця) у всіх обстежених дітей виявлено не було. Збільшення частоти серцевих скорочень відповідало температурі тіла.
Характер основних скарг відповідав клінічній картині гострої респіраторної вірусної інфекції. Пацієнти скаржилися на головний біль, слабкість, зниження апетиту, біль у горлі, лихоманку, біль у суглобах і м’язах, нежить, кашель. Суб’єктивні симптоми захворювання (загальна слабкість, головний біль, зниження апетиту, біль у горлі, міалгія, артралгія, кашель, нежить) оцінювалися залежно від їх вираженості за бальною шкалою: 0 — відсутня; 1 — незначна; 2 — помірна; 3 — сильна.
Показники об’єктивного обстеження (блідість шкірних покривів, тахікардія, збільшення підщелепних та/або задньошийних лімфовузлів, гіперемія зіва) оцінювалися залежно від їх вираженості за бальною шкалою: 0 — відсутня; 1 — незначна; 2 — помірна; 3 — сильна.
Крім того, стан пацієнтів оцінювався за такими категоріальними показниками: жорстке дихання при аускультації легень, хрипи (є/немає); підвищення температури тіла (< 37,0 °С; 37,4–38,0–39,0 °С; > 39,0 °С). До початку лікування OM-85 у всіх хворих проводився лабораторний аналіз крові та сечі. На початку захворювання зміни периферичної крові у більшості хворих мали виражений запальний характер: лейкоцитоз, паличкоядерний зсув, підвищення ШОЕ. Результати загального аналізу сечі і біохімічного аналізу крові знаходилися в межах норми у всіх пацієнтів основної та контрольної груп.
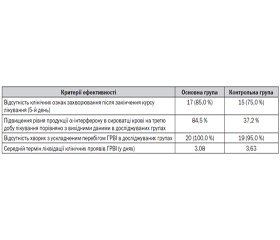
Результати проведених досліджень показали, що позитивна клінічна динаміка захворювання до закінчення курсу лікування відзначалася в більшості дітей як в основній, так і в контрольній групах. Зменшилися такі прояви інтоксикаційного синдрому, як головний біль, слабкість, зниження апетиту. Температура тіла до закінчення курсу лікування знизилася до нормальних величин і в середньому становила 36,5 ± 0,5 °С. Спостерігалася також позитивна динаміка катаральних явищ до закінчення курсу лікування: у 17 (85 %) пацієнтів основної групи і у 15 (75 %) контрольної практично припинилися нежить і біль у горлі, зникли запальні зміни в ротоглотці.
Залишкові катаральні явища (нежить і незначна гіперемія зіва) до закінчення курсу лікування збереглися у 3 пацієнтів основної групи і у 5 контрольної. Слід зазначити, що симптоми, що збереглися до 5-го дня лікування, мали незначну вираженість і в наступні дні відбулася їх поступова редукція. В одного пацієнта контрольної групи ГРВІ ускладнилася загостренням рецидивуючого бронхіту. У цього хворого до п’ятого дня лікування спостерігалися помірно виражений кашель, при аускультації — сухі розсіяні хрипи, температура тіла — 37,4 °С. Після закінчення курсу лікування був проведений аналіз динаміки змін суб’єктивних і об’єктивних симптомів ГРВІ в основній і контрольній групах хворих під впливом терапії. Після аналізу тривалості основних симптомів захворювання в групах констатували більш швидке зникнення симптомів інтоксикації й лихоманки, а також скорочення тривалості катаральних явищ у хворих, які отримували на додаток до базисної терапії OM-85 порівняно з групою хворих, які отримували тільки базисну терапію. Так, середня тривалість лихоманки у хворих в основній групі становила 2,8 дня, у контрольній — 3,5 дня, симптоми інтоксикації (загальне нездужання, головний біль) — 2,3 і 2,9 дня відповідно, середня тривалість катаральних явищ (нежить, кашель, біль у горлі) у хворих в основній групі — 4,2 дня, у конт–рольній — 4,6 дня. Найбільш виражені відмінності спостерігалися за такими показниками: підвищення температури тіла, головний біль, міалгія.
Оскільки одним із критеріїв ефективності була відсутність клінічних ознак захворювання до закінчення курсу лікування (5-й день), у групах визначили частку пацієнтів, у яких були відсутні клінічні ознаки ГРВІ після п’яти днів лікування. Дані про розподіл досліджуваних за категоріальною змінною наявності/відсутності клінічних ознак наведені в табл. 1.
Оцінювали інтенсивність продукції IFN-a залежно від одержуваної терапії.
Статистично значуща різниця відмічалася між основною групою та контролем за рівнем a-інтерферону на 3-тю добу терапії. В основній групі рівень інтерферону збільшився в середньому на 51,09 од. (на 84,5 %), у той час як у контрольній — на 21,33 од. (на 37,2 %).
Оцінка загальної ефективності лікування в групах відбувалася за такими показниками:
— відсутність/наявність клінічних ознак захворювання до закінчення курсу лікування;
— середній термін ліквідації клінічних проявів ГРВІ в досліджуваних групах;
— динаміка рівня продукції a-інтерферону в сироватці крові на третій день лікування порівняно з вихідними даними в досліджуваних групах;
— відсоток хворих з ускладненим перебігом ГРВІ в досліджуваних групах.
Отримані дані дозволяють зробити висновок, що включення OM-85 у терапію ГРВІ у дітей є ефективним і дозволяє зменшити тривалість катарального синдрому та кількість ускладнень за рахунок активації неспецифічного імунітету.
Після закінчення періоду спостереження було повторно проведено лабораторне дослідження крові та сечі. Встановлено, що під впливом лікування зменшилися швидкість осідання еритроцитів і кількість лейкоцитів як в основній, так і в контрольній групі. Показники біохімічного дослідження крові та загального аналізу сечі залишалися в межах норми як до, так і після лікування у всіх пацієнтів. За період лікування не було зареєстровано жодного випадку негативних реакцій, пов’язаних із прийомом OM-85.
Висновки
1. Застосування OM-85 у дітей із ГРВІ сприяє більш швидкій ліквідації клінічних проявів захворювання. Включення OM-85 у схему лікування ГРВІ у дітей забезпечує більш швидке зниження вираженості інтоксикаційного синдрому, катаральних явищ, а також запобігає розвитку ускладнень.
2. Застосування OM-85 у дозі 3,5 мг на добу сприяє підвищенню рівня IFN-a в периферичній крові хворої дитини.
3. OM-85 можна рекомендувати включити в схему лікування дітей, хворих на гострі респіраторні вірусні інфекції.
1. Абатуров А.Е. Молекулярные механизмы неспецифической защиты респираторного тракта: распознавание патоген-ассоциированных молекулярных структур // Здоровье ребенка. — 2006. — № 2(2). — С. 87-92.
2. Абатуров А.Е., Волосовец А.П., Юлиш Е.И. Инициация воспалительного процесса при вирусных и бактериальных заболеваниях, возможности и перспективы медикаментозного управления. — Харьков: С.А.М., 2011. — 392 с.
3. Ахматова Н.К. Молекулярные и клеточные механизмы действия иммуномодуляторов микробного происхождения на функциональную активность эффекторов врожденного иммунитета: Дис… д-ра мед. наук. — 2006. — 226 с.
4. Козлов И.Г. Лекарственные воздействия через рецепторы врожденного иммунитета / И.Г. Козлов, Т.М. Андронова // Современные представления о молекулярном механизме действия глюкозаминилмурамилдипептида (ГМДП). — 2006. — С. 27-37.
5. Козлов И.Г., Тимаков М.А. Иммунотерапия: вчера, сегодня, завтра / И.Г. Козлов, М.А. Тимаков // Педиатрия. — 2009. — Т. 87, № 4. — С. 140-149.
6. Лебединская Е.А. Молекулярно-клеточные механизмы действия бактериальных иммуномодуляторов, несущих лиганды к TOLL-подобным рецепторам / Е.А. Лебединская, О.В. Лебединская, Н.К. Ахматова, А.П. Годовалов // Фундаментальные исследования. — 2010. — № 12. — С. 51-52.
7. Маркова Т.П. Бактериальные иммуномодуляторы // РМЖ. — 2009. — № 3. — С. 24-27.
8. Azizi A. Enhancing oral vaccine potency by targeting intestinal M-cells / A. Azizi, A. Kumar, F. Diaz-Mitoma, J. Mestecky // PLoS Pathog. — 2010. — Vol. 6, № 11. — P. e1001147. doi: 10.1371/journal.ppat.1001147.
9. Cisney E.D. Examining the Role of Nasopharyngeal-associated Lymphoreticular Tissue (NALT) in Mouse Responses to Vaccines / E.D. Cisney, S. Fernandez, S.I. Hall, G.A. Krietz, R.G. Ulrich // J. Vis. Exp. — 2012. — Vol. 66. — P. 3960. doi: 10.3791/3960.
11. Miller H. Intestinal M cells: the fallible sentinels? / H. Miller, J. Zhang, R. Kuolee, G.B. Patel, W. Chen // World J. Gastroente–rol. — 2007. — Vol. 13, № 10. — P. 1477-1486. doi: 10.3748/wjg.v13.i10.1477.
12. LeGrand E.K. Turning up the heat: immune brinksmanship in the acute phase response / E.K. LeGrand, J. Alcock // Q. Rev. Biol. — 2012. — Vol. 87, № 1. — P. 3-18. PMID: 22518930
13. Parker D. Innate immunity in the respiratory epithelium/ D. Parker, A. Prince // Am. J. Respir. Cell. Mol. Biol. — 2011. — Vol. 45, № 2. — P. 189-201. doi: 10.1165/rcmb.2011-0011RT.
14. Razi C.H. The immunostimulant OM-85 BV prevents wheezing attacks in preschool children / C.H. Razi, K. Harmancı, A. Abacı, O. Özdemir, S. Hızlı, R. Renda, F. Keskin // J. Allergy Clin. Immunol. — 2010. — Vol. 126, № 4. — P. 763-769. doi: 10.1016/j.jaci.2010.07.038.
15. Rozy A. Bacterial immunostimulants — mechanism of action and clinical application in respiratory diseases / A. Rozy, J. Chorostowska-Wynimko // Pneumonol. Alergol. Pol. — 2008. — Vol. 76, № 5. — P. 353-359.
16. Schaad U.B. OM-85 BV, an immunostimulant in pediatric recurrent respiratory tract infections: a systematic review // World J. Pediatr. — 2010. — Vol. 6, № 1. — P. 5-12. doi: 10.1007/s12519-010-0001-x.
17. Steurer-Stey C. Oral purified bacterial extracts in acute respiratory tract infections in childhood: a systematic quantitative review / C. Steurer-Stey, L. Lagler, D.A. Straub, J. Steurer, L.M. Bachmann // Eur. J. Pediatr. — 2007. — Vol. 166, № 4. — P. 365-376. doi 10.1007/s00431-006-0248-3
18. Thompson M.R. Pattern recognition receptors and the innate immune response to viral infection / M.R. Thompson, J.J. Kaminski, E.A. KurtJones, K.A. Fitzgerald // Viruses. — 2011. — Vol. 3, № 6. — P. 921. doi: 10.3390/v3060920.
1. Abaturov A.E. Molekulyarnye mekhanizmy nespetsificheskoy zashchity respiratornogo trakta: raspoznavanie patogenassotsiirovannykh molekulyarnykh struktur // Zdorov'e rebenka. — 2006. — № 2(2). — S. 87¬92.
3. Abaturov A.E., Volosovets A.P., Yulish E.I. Initsiatsiya vospalitel'nogo protsessa pri virusnykh i bakterial'nykh zabolevaniyakh, vozmozhnosti i perspektivy medikamentoznogo upravleniya. — Khar'kov: OOO «S.A.M.», 2011. — 392 s.
3. Akhmatova N.K. Molekulyarnye i kletochnye mekhanizmy deystviya immunomodulyatorov mikrobnogo proiskhozhdeniya na funktsional'nuyu aktivnost' effektorov vrozhdennogo immuniteta: Dis… d-ra med. nauk. — 2006. — 226 s.
4. Kozlov I.G., Andronova T.M. Lekarstvennye vozdeystviya cherez retseptory vrozhdennogo immuniteta // Sovremennye predstavleniya o molekulyarnom mekhanizme deystviya glyukozaminilmuramildipeptida (GMDP). — 2006. — S. 27¬37.
5. Kozlov I.G., Timakov M.A. Immunoterapiya: vchera, segodnya, zavtra // Pediatriya. — 2009. — T. 87, № 4. — S. 140¬149.
6. Markova T.P. Bakterial'nye immunomodulyatory // RMZh. — 2009. — № 3. — S. 24¬27.
7. Molekulyarno-kletochnye mekhanizmy deystviya bakterial'nykh immunomodulyatorov, nesushchikh ligandy k TOLL-podobnym retseptoram / E.A. Lebedinskaya, O.V. Lebedinskaya, N.K. Akhmatova, A.P. Godovalov // Fundamental'nye issledovaniya. — 2010. — № 12. — S. 51¬52.

/23/23.jpg)
/24/24.jpg)