Журнал «Здоровье ребенка» 7 (58) 2014
Вернуться к номеру
Неонатальні аритмії: тріпотіння передсердь
Авторы: Гончарь М.О., Сенаторова Г.С., Бойченко А.Д., Шипко А.Ф., Ріга О.О. - Харківський національний медичний університет; Кондратова І.Ю. - Регіональний перинатальний центр; Страшок О.І. - Обласний дитячий кардіологічний центр, м. Харків; Сенаторова А.В., Тесленко Т.О., Губарь Н.В. -
Харківський національний медичний університет
Рубрики: Кардиология, Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У статті наведено сучасні дані з питань діагностики неонатальних аритмій, висвітлено поширеність, механізми формування, діагностику та лікування одного з варіантів порушення ритму серця — тріпотіння передсердь. Оприлюднено клінічне спостереження щодо діагностики та лікування тріпотіння передсердь у новонародженого в ранньому неонатальному періоді.
В статье приведены современные данные по вопросу диагностики неонатальных аритмий, описаны распространенность, механизмы формирования, диагностика и лечение одного из вариантов нарушения ритма сердца — трепетания предсердий. Опубликовано клиническое наблюдение диагностики и лечения трепетания предсердий у новорожденного ребенка в раннем неонатальном периоде.
The paper presents the current data on the diagnosis of neonatal arrhythmias, covers the prevalence, mechanisms of formation, diagnosis and treatment of one type of cardiac arrhythmias — atrial flutter. Clinical observation in terms of the diagnosis and treatment of atrial flutter in a newborn in the early neonatal period is given.
аритмії, новонароджені, діагностика, лікування.
аритмии, новорожденные, диагностика, лечение.
arrhythmia, newborns, diagnosis, treatment.
Статья опубликована на с. 71-76
Точних даних про поширеність порушень ритму серця (ПРС) та провідності в дитячому віці немає [1–4]. Патофізіологічні стани, виникнення яких супроводжується зміною частоти, регулярності ритму та/або джерела збудження серця або порушенням зв’язку між активацією скорочень передсердь і шлуночків чи їх послідовності, потребують поглибленого вивчення в дітей [1, 5, 6]. У неонатальний період вони можуть спровокувати розвиток гострої серцевої недостатності (СН) та призвести до кардіогенного шоку й смерті [7–9]. Найчастішими та прогностично важливими аритміями в новонароджених вважають суправентрикулярну тахікардію, вроджену атріовентрикулярну блокаду, шлуночкову тахікардію та фібриляцію/тріпотіння передсердь [5, 9].
Повідомляють, що серед фетальних тахіаритмій частка тріпотіння передсердь становить до 30–46 % [9–11]. Вважають, що в разі виникнення цього ПРС прогноз визначає зрілість плода та своєчасність встановлення діагнозу, причому прогностично важлива наявність вродженої вади серця (ВВС) із порушеннями гемодинаміки або водянки плода [11].
Фетальна надшлуночкова тахікардія в 68 % спостережень супроводжується неімунною водянкою плода, у 32 % — ранньою неонатальною смертю, тобто прогностично є дуже тяжкою [11]. Показаннями до проведення термінового розродження вважають розвиток анасарки в плода з ПРС за відсутності ефекту від призначеної вагітній терапії протягом декількох діб, а також ультразвукові прояви у вигляді турбулентного кровотоку в порожнистих венах, недостатність тристулкового клапана 2–3-го ступеня [11, 12]. Загальноприйнятих алгоритмів обстеження та лікування плодів із пренатально встановленими ПРС немає [12–14].
У новонароджених діагностика аритмій ускладнюється тим, що навіть в умовах провідних клінік проведення електрокардіографічного дослідження із високою точністю або використання методу 20-хвилинної оцінки варіабельності ритму є утрудненими за відсутності повного спокою дитини, низького рівня шуму тощо; досі відсутні критерії показань до призначення медикаментозного лікування або профілактичних заходів у неонатальному періоді [12, 14, 15].
Основними методами діагностики ПРС залишаються визначення частоти серцевих скорочень (ЧСС) та дані електрокардіограми (ЕКГ); ретельний збір анамнезу з деталізацією перебігу вагітності та стану плода за даними пренатального ультразвукового дослідження. Новонародженим допплерехокардіографію (ДЕхоКГ) призначають із метою виключення вродженої структурної патології серця, а також для визначення адекватності медикаментозної терапії аритмій. Точно визначити характер і ступінь вираженості аритмії дає змогу холтерівське моніторування ЕКГ (ХМ ЕКГ), одним із показань для проведення якого є обстеження пацієнтів із високим ризиком розвитку життєво небезпечних серцевих аритмій і раптової серцевої смерті [16–18].
За наявності показань проводиться черезстравохідне електрофізіологічне дослідження. Ендокардіальне електрофізіологічне дослідження виконують перед проведенням катетерної деструкції електрофізіологічного вогнища тахікардії.
Важливо встановити причинні фактори, що призводять до розвитку ПРС у новонароджених: ВВС, запальні та дегенеративні захворювання міокарда, пухлини серця [10, 19, 20]; метаболічні порушення гомеостазу (гіпо- або гіперкальціємія, -магніємія, гіпо- або гіпертермія; гіпертиреоїдні стани); вплив лікарських препаратів [5, 14, 21]. Важливу роль у генезі аритмій відіграють автоімунні захворювання сполучної тканини, цукровий діабет, захворювання щитоподібної залози у вагітної; мають значення ураження центральної нервової системи внаслідок внутрішньоутробної гіпоксії, пологової травми, асфіксії новонародженого [5, 10, 12]. До значущих факторів ризику розвитку фібриляції передсердь у неонатальному періоді відносять низьку масу тіла при народженні [22].
Дитина з аритмією, вперше виявленою в неонатальному періоді, потребує обов’язкової консультації кардіолога; надалі підлягає додатковому обстеженню в спеціалізованому кардіологічному центрі/відділенні, диспансерному спостереженню в умовах поліклініки.
У дитячій кардіології фібриляцію передсердь і тріпотіння передсердь (ТП) часто об’єднують під назвою «миготлива аритмія» (МА), яку відносять до класу суправентрикулярних тахікардій. Загальні властивості цих аритмій полягають у тому, що ані синусовий вузол, ані атріовентрикулярний не мають відношення до їх розвитку.
Миготливу аритмію вважають досить поширеною в плодів [23]; до особливостей її перебігу відносять зміни ЧСС у значних межах (150–280 уд/хв) за даними ДЕхоКГ; виражену нерегулярність ритму з інтервалами стабілізації ЧСС (у межах 200 уд/хв) внаслідок мінливої провідності атріовентрикулярного вузла; постійно рецидивуючий характер аритмії. У неонатальному періоді МА розвивається у хворих із ВВС, кардіоміопатіями (КМП), тяжкою анемією, пневмоніями; ідіопатична МА спостерігається рідко [5, 22, 23].
Фібриляція й тріпотіння передсердь — це тяжка форма ПРС у новонароджених, що може призводити до потенційно летальних гемодинамічних розладів. За механізмом виникнення, можливостями й ефективністю терапії це різні варіанти тахікардії.
При фібриляції передсердь, коли має місце їх хаотичне скорочення, на ЕКГ фіксуються часті загостреної форми хвилі між шлуночковими комплексами або ритмічні хвилі з високою частотою (понад 350 уд/хв), а також різна тривалість інтервалів R-R.
Тріпотіння передсердь — це макро-re-entry тахікардія, що виникає в тканинах передсердь, при якій за відсутності лікування частота їх скорочень може перевищувати 250–450 уд/хв. До механізму виникнення істмус–залежного тріпотіння відносять коло re-entry на площині перешийка між нижньою порожнистою веною та кільцем тристулкового клапана [6].
ТП в популяції зустрічається доволі часто — 0,08 %. До 60 % дорослих хворих скаржаться на прискорене серцебиття, задишку, підвищену стомлюваність, біль за грудиною; із часом прогресують клінічні ознаки СН. До клінічних симптомів у дітей, безпосередньо пов’язаних із ПРС, відносять невідкладні стани (напади тахікардії, втрату свідомості), відповідний анамнез, об’єктивне дослідження (тахікардія > 30 % від норми, екстратони, ознаки вегетативної дисфункції, диспластичний статус, затримка фізичного розвитку дитини) [4, 6, 7].
При типовому нападі ТП на електрокардіограмі фіксують правильний регулярний передсердний ритм, коли замість зубців Р наявні хвилі F із відсутністю ізолінії між ними (пилоподібні хвилі). У разі вогнищевого (фокусного) ТП патологічні імпульси виходять із невеликої ділянки міокарда передсердь — «точкового джерела». Прогностично несприятливою є багатовогнищева за походженням передсердна тахікардія, коли на ЕКГ визначають три та більше морфологічно різних зубці Р в одному відведенні; між зубцями Р зберігається ізолінія; мають місце нерегулярні PR–, РР–, RR–інтервали. Вважають, що при цьому мають значення два основних процеси — виникнення передсердних фокусів збудження (найбільш часто в ділянці легеневих вен) і множинних хвиль re-entry.
За графікою ЕКГ тріпотіння передсердь відокремлюють від фібриляції шлуночків. При тріпотінні-мерехтінні (фібриляції) шлуночків має місце стійка re-entry тахікардія з ЧСС понад 200–300 уд/хв, реєструється регулярна синусоїда (тріпотіння шлуночків) або хаотичні нерегулярні різні за формою хвилі на ЕКГ (фібриляція шлуночків) [1, 6]. Як правило, тріпотіння переходить у фібриляцію, гемодинаміка не є ефективною; для лікування використовують дефібриляцію.
Під час аналізу анамнестичних даних робиться акцент на наявність станів, що мають принципово прогностичне значення щодо перебігу ТП і визначення складу медикаментозної терапії (синкопе, раптова серцева смерть у родичів дитини). Мають значення гострі порушення гемодинаміки, що виникають під час нападів тахікардії. Прогноз погіршується в разі наявності органічного захворювання міокарда, резидуальних станів, залишкових явищ або ускладнень після хірургічної корекції ВВС.
При стабільній гемодинаміці пацієнтам із ТП/миготливою аритмією призначають кордарон або дигоксин; тріпотіння передсердь на тлі тяжкої СН є показанням для призначення дигоксину новонародженим [5, 25, 26]. Дитині призначають швидку дигіталізацію. За даними мультицентрових досліджень, використання дигоксину в новонароджених із тріпотінням передсердь є ефективним методом лікування, що запобігає розвитку аритмогенної КМП, дилатації порожнини лівого передсердя [9, 21].
Фібриляція або тріпотіння передсердь призводить до зменшення серцевого викиду внаслідок «випадіння» передсердної систоли. Тому, якщо ТП вперше виявлено в новонародженої дитини або в малюка будь-якого віку з нестабільною гемодинамікою, застосовують синхронізовану кардіоверсію (0,5–2 Дж/кг) під загальною анестезією або седацією (процедура супроводжується сильним больовим синдромом). Далі в разі виявлення аритмогенної кардіоміопатії, ознак СН призначають аміодарон (кордарон) із дигоксином; при одночасному використанні доза останнього зменшується до 25–50 % від середньої.
За відсутності гемодинамічних розладів із метою зупинки нападів ТП можливо використовувати черезстравохідну електростимуляцію. За неефективності медикаментозної терапії використовують хірургічні методи лікування МА: радіочастотну катетерну абляцію (РЧА) аритмогенних зон передсердя з наступною імплантацією двохкамерного електрокардіостимулятора, імплантацію передсердного кардіовертера-дефібрилятора. РЧА проводять дітям віком старше 5 років, однак при неефективності медикаментозної терапії, розвитку аритмогенної кардіоміопатії вона показана пацієнтам будь-якого віку після проведення інвазивного етапу діагностики ТП — картування передсердь [1, 6].
Для профілактики рецидивів нападів тахікардії медикаментозна терапія призначається всім дітям першого року життя після зафіксованого епізоду тахікардії.
З метою ілюстрації даних, що були викладені вище, наводимо витяг з історії розвитку новонародженої П., яка народилась у регіональному перинатальному центрі від VІIІ вагітності, ІІ передчасних пологів у терміні гестації 36–37 тижнів шляхом кесаревого розтину (у зв’язку з антенатальним дистресом плода, ЧСС 220 уд/хв). Відомо, що на 35-му тижні вагітності жінка перенесла гостру респіраторну вірусну інфекцію. Пренатально встановлено ознаки материнсько-плодової інфекції та вроджену ваду розвитку сечовивідних шляхів: мультикістоз лівої нирки плода. Вік матері — 28 років, вона має вроджену аномалію сечовивідних шляхів: гідронефроз правої нирки; хронічний пієлонефрит, НН0.
Дитина народилася з масою 3200 г, зростом 49 м, окружністю голови 35 см, грудної клітини — 34 см. За шкалою Апгар оцінена в 7/7 балів. При народженні стан тяжкий, прояви респіраторної недостатності; негучний крик, м’язова гіпотонія. Частота дихання (ЧД) 65–72/хв. ЧСС 190–204 уд/хв. SрО2 88 %. Тони серця ритмічні, м’який систолічний шум у другому міжребер’ї зліва від грудини. Живіт м’який, печінка +1,5 см нижче краю реберної дуги. Показники кислотно-лужного стану при народженні: рН 7,33; рСО2 50,0 мм рт.ст.; рО2 15 мм рт.ст.; НСО2 26,7; ВЕ –0,4 ммоль/л. Кальцій 1,4 ммоль/л. За тяжкістю стану дитина переведена у відділення інтенсивної терапії новонароджених, де знаходилась протягом 1 доби.
Протягом першої доби життя загальний стан залишався тяжким за рахунок респіраторної недостатності, зберігалась тахікардія до 200 уд/хв. Гіпорефлексія. М’язовий тонус, спонтанна рухова активність знижені. Шкіра чиста, рожевого кольору, волога. Еластичність шкіри нормальна, тургор знижений. Підшкірно-жировий шар розвинений достатньо до терміну гестації. Набряків немає. Дихання самостійне, ритмічне з втягненням міжреберних проміжків. Аускультативно в легенях дихання проводиться до всіх відділів з обох сторін. ЧД 65/хв. SрО2 97–98 %. Межі відносної серцевої тупості: права — по правому краю грудини, верхня — II міжребер’я, ліва — на 1,0 см вліво від середньо-ключичної лінії. При аускультації тони серця ритмічні, приглушені. ЧСС 190 уд/хв. Артеріальний тиск 69/36 мм рт.ст., середній артеріальний тиск 36 мм рт.ст. Живіт м’який. Печінка +1,5 см нижче краю реберної дуги. Сечовипускання достатнє (1,5 мл/кг/год). Клінічні аналізи крові та сечі, біохімічний аналіз крові (загальний білірубін, електроліти, альбумін, С-реактивний протеїн, цукор крові) — без відхилень від норми. КФК-МВ 60,1 Од/л. ДЕхоКГ у першу добу життя: ДдЛШ 14,9 мм, ДсЛШ 12,4 мм, товщина задньої стінки лівого шлуночка (Тзслш) 3,9–5,0 мм, товщина міжшлуночкової перетинки (Тмшп) 3,9–4,9 мм, фракція викиду (ФВ) 62 %, Д 31 %, діаметр лівого передсердя (ДЛП) 10,3 мм, діаметр аорти (Ао) 8,6 мм, діаметр легеневої артерії (ЛА) 9,2 мм, ДдПШ 16,0 мм. Середній тиск у стволі ЛА 27 мм рт.ст. Висновок: помірна дилатація правих камер. Аневризма міжпередсердної перетинки, широкий відкритий овальний отвір, діаметр 4,7 мм, інтенсивний ліво-правий шунт. Відкрита артеріальна протока, діаметр 3,1 мм, градієнт тиску Ао/ЛА 17 мм рт.ст. Аритмія серцевої діяльності, ЧСС 113–190 уд/хв. Кровотік у черевній аорті пульсуючий.
Під впливом посиндромної терапії прояви респіраторної недостатності куповані на другу-третю добу життя, у стабільному стані дитина переведена до відділення сумісного перебування. Звертала на себе увагу наявність прискореної ЧСС до 200–220 уд/хв за відсутності клінічних ознак гемодинамічних розладів, з приводу чого дитині призначено допплерехокардіографічне дослідження, консультація кардіолога. Дані ДЕхоКГ на третю добу життя (рис. 1): ДдЛШ 13,9 мм, ДдПШ 16,0 мм, ДПП 15,0 мм, ФВ 56 %, ДЛП 10,3 мм, діаметр Ао 8,6 мм, діаметр ЛА 9,2 мм. Середній тиск у стволі ЛА 27 мм рт.ст. Висновок: зберігається помірна дилатація правих камер, широкий овальний отвір з інтенсивним ліво-правим шунтуванням через міжпередсердну перетинку. Відкрита артеріальна протока, діаметр 2,4 мм. Тахікардія. Кровотік у черевній аорті пульсуючий. При дослідженні у М-режимі зареєстрована невідповідність частоти скорочень кореня аорти та лівого передсердя у відношенні 1 : 2 із частотою скорочення аорти 190–200 уд/хв, передсердь — 350–400 на хвилину (непостійно), що дозволило діагностувати порушення ритму серця — тріпотіння передсердь.
Після консультації кардіолога, проведення електрокардіографічного дослідження на ЕКГ зафіксовані характерні передсердні хвилі F, що мають характерну пилкоподібну форму, підтверджена наявність порушення ритму серця — тріпотіння передсердь (рис. 2). Клінічних ознак серцевої недостатності не виявлено.
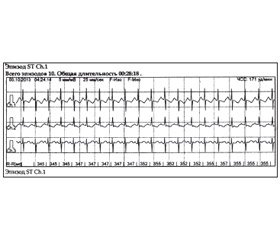
З метою нормалізації ритму серця дитині призначена протиаритмічна терапія — кордарон в/в у дозі 5 мг/кг/добу. Нормалізація серцевого ритму зафіксована через 20 годин (рис. 3).
При проведенні холтерівського моніторування ЕКГ протягом доби — ритм синусовий (рис. 4).
Після проведення дообстеження з метою виключення внутрішньоутробної інфекції, міокардиту, консультації кардіохірурга (виключення вторинного дефекту міжпередсердної перетинки) дитина в задовільному стані виписана під спостереження педіатра за місцем проживання з діагнозом: множинні вроджені вади розвитку: вроджена вада серця (вторинний дефект міжпередсердної перетинки, функціонуюча відкрита артеріальна протока). Аномальна трабекула порожнини лівого шлуночка. Вроджене порушення ритму серця: тріпотіння передсердь. СН0. Вроджена вада розвитку сечовидільної системи: мультикістоз лівої нирки. НН0. Протягом першого місяця життя стан задовільний, епізоди тахікардії не зафіксовані, по медичну допомогу батьки не звертались. Рекомендовано планове обстеження та диспансерне спостереження в обласному дитячому кардіологічному центрі протягом року.
/75/75.jpg)
Таким чином, тріпотіння передсердь у новонародженого може розвинутись у ранньому неонатальному періоді внаслідок перевантаження правого передсердя об’ємом на тлі активно функціонуючих плодових комунікацій (широкого овального отвору з ліво-правим шунтуванням, відкритої артеріальної протоки). За відсутності вродженої структурної патології серця ТП не призвело до тяжких гемодинамічних розладів, швидко куповане призначенням антиаритмічної терапії, зокрема кордарону, тобто мало сприятливий прогноз.
Неонатолог та дитячий кардіоревматолог мають виключити низку захворювань новонародженого й матері для встановлення генезу аритмії. Особливу роль у цьому аспекті відіграють дані пренатальної ультразвукової діагностики. Повноцінне обстеження немовляти з аритмією, окрім клініко-анамнестичного дослідження, включає ЕКГ спокою, ДЕхоКГ, ХМ ЕКГ, а також лабораторні дослідження з метою виключення вроджених структурних аномалій або запальних захворювань серця, вторинних кардіоміопатій, що стає можливим в умовах сучасних перинатальних центрів. У разі виявлення неонатальних аритмій, у тому числі тріпотіння передсердь, є важливою і необхідною чітка злагоджена співпраця неонатологів з кардіоревматологами профільних відділень дитячих лікарень, обласних дитячих кардіоцентрів з дитячими кардіохірургами.
Уточнення частоти розвитку та спектра фетальних і перинатальних аритмій, дослідження причинно-наслідкових взаємозв’язків їх формування, можливих наслідків, показань до призначення та алгоритмів медикаментозного або хірургічного лікування сприятимуть зниженню показників перинатальної та неонатальної смертності, дитячої інвалідності, тобто матимуть не тільки клінічний, але й соціальний та економічний ефекти.
1. Доронин А.В. Лечение тахиаритмий сердца методом катетерной деструкции: Монография / А.В. Доронин. — К., 2008. — 96 с.
2. Yagel S., Silverman N.H., Gembruch U. Fetal cardiology. — NY, London: Martin Dunitz Taylor & Francis Gr., 2009. — Р. 593.
3. Дослідження в перинатології. Серцево-судинні захворювання у новонароджених / Під ред. Г. Верновського, С.Д. Рубенстайна; пер. з англ. — К.: Молодь, 2004. — 312 с.
4. Кардиология детского возраста / Под ред. А.Д. Царегородцева, Ю.М. Белозерова, Л.В. Брегель. — М.: ГЭОТАР-Медиа, 2014. — 784 с.
5. Рооз Р. Неонатология. Практические рекомендации: пер. с нем. / Р. Рооз, О. Генцель-Боровичени, Г. Прокитте. — М.: Мед.лит., 2011. — 527 с.
6. Тактика ведення дітей з порушеннями ритму серця / О.В. Доронин. — К., 2010. — 20 с.
7. Диагностика и лечение нарушений ритма и проводимости сердца у детей: Учебное пособие / Под ред. М.А. Школьниковой, Д.Ф. Егорова. — СПб.: Человек, 2012. — 432 с.
8. Перинатальная кардиология. Руководство для педиатров, акушеров, неонатологов / А.С. Шарыкин. — М.: Волшебный фонарь, 2007. — 264 с.
9. Sanatani S., Potts J.E., Etheridge S.P. The study of antiarrhythmic medications in infancy (SAMIS): a multicenter, randomized controlled trial comparing the efficacy and safety of digoxin versus propranolol for prophylaxis of supraventricular tachycardia in infants. [Randomized Controlled Trial] // Circ. Arrhythm. Electrophysiol. — 2012. — 5(5). — 984–91.
10. Котлукова Н.П. Фетальные и неонатальные нарушения ритма и проводимости / Н.П. Котлукова, О.М. Хузина, В.Б. Немировский, Е.А. Матюнин // Педиатрия. — 2007. — Т. 86, № 2. — С. 5–12.
11. Бокерия Е.Л. Нарушения ритма сердца у новорожденных детей при гипоксически-ишемической энцефалопатии / Е.Л. Бокерия // Российский вестник перинатологии и педиатрии. — 2010. — С. 19–21.
12. Хузина О.М. Нарушения сердечного ритма и проводимости у плодов в системе мать — плацента — плод и у новорожденных: Автореф. дис… канд. мед. наук: спец.14.00.09 — педиатрия / Хузина О.М. — М., 2005. — С. 108.
13. Miyoshi T., Maeno Y., Ikeda T. Evaluation of transplacental treatment for fetal congenital bradyarrhythmia: nationwide survey in Japan // Circ. J. — 2012. — 76(2). — 469–76.
14. Сафина А.И. Нарушение ритма сердца, период новорожденности / А.И. Сафина, И.Я. Лутфуллина, Э.А. Гайнуллина // Педиатрия. — 2010. — № 6. — С. 18–22.
15. Прахов А.В. Неонатальная кардиология. — Н. Новгород: НижГМА, 2008. — 388 с.
16. Болезни сердца и сосудов. Руководство Европейского общества кардиологов / Под ред. А. Джона Кэмма, Томаса Ф. Люшера, Патрика В. Серруиса; пер. с англ. под ред. Е.В. Шляхто. — М.: ГЭОТАР-Медиа, 2011. — 2294 с.
17. Суправентрикулярные тахикардии у детей: клиника, диагностика, методы лечения / Т.К. Кручина, Д.Ф. Егоров. — СПб.: Человек, 2011. — 356 с.
18. Макаров Л.М. ЭКГ в педиатрии / Л.М. Макаров. — М.: Медпрактика, 2002. — 282 с.
19. Волосовець О.П. Діагностика та моніторинг вроджених вад серця у новонароджених: Навчальний посібник / О.П. Волосовець, Г.С. Сенаторова, М.О. Гончарь, А.Д. Бойченко. — Харків, 2013. — 108 с.
20. Levin M.D., Stephens P., Rhodes L.A.Ventricular tachycardia in infants with structurally normal heart: a benign disorder [Journal Article] // Cardiol Young. — 2010. — 20(6). — 641–7.
21. Maulidi H., McNair C., Tomlinson C. Arrhythmia associated with tetracaine in an extremely low birth weight premature infant. [Case Reports] // Pediatrics. — 2012. — 130(6). — e1704–7.
22. Conen D., Tedrow U.B., Albert C.M. Birth weight is a significant risk factor for incident atrial fibrillation [Randomized Controlled Trial] // Circulation. — 2010 Aug 24. — 122(8). — 764–70.
23. Barros A., Sousa P.R., Nascimento R. Perinatal atrial flutter: different therapeutic outcomes in two case reports [Case Reports] // Rev. Port. Cardiol. — 2010. — 29(10). — 1575–80.
24. Drago F., Silvetti M.S., Di Ciommo V. Paroxysmal reciprocating supraventricular tachycardia in infants: electrophysiologically guided medical treatment and long-term evolution of the re-entry circuit. [Clinical Trial] // Europace. — 2008. — 10(5). — 629–35.
25. Клінічні протоколи надання медичної допомоги (Педіатрія): Нормативне виробничо-практичне видання. — К.: МНІАЦ медичної статистики; МВЦ «Медінформ», 2005. — 320 с.
26. NeoFax: фармакологический справочник. — 23-е изд. — 2010.

/74/74.jpg)