Журнал «Здоровье ребенка» 7 (58) 2014
Вернуться к номеру
Динамика показателей вариабельности сердечного ритма у детей с систолической дисфункцией миокарда под влиянием терапии
Авторы: Ахназарянц Э.Л. - ГУ «Институт охраны здоровья детей и подростков Национальной академии медицинских наук Украины», г. Харьков
Рубрики: Кардиология, Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Целью исследования было изучение динамики вариабельности сердечного ритма у детей с патологией миокарда в зависимости от вида терапии. Под наблюдением находилось 84 ребенка и подростка обоих полов в возрасте 11–18 лет с систолической дисфункцией миокарда при различных заболеваниях сердца, из которых 42 ребенка получали патогенетическую терапию в течение 3 месяцев ингибиторами ангиотензинпревращающего фермента и 42 — средства кардиометаболического действия в течение 30–45 дней повторными курсами дважды в год. Оценка вариабельности сердечного ритма проводилась по результатам бифункционального суточного мониторирования ЭКГ и артериального давления с помощью аппарата ЕС-3Н/АВР с программным обеспечением Сardiospy фирмы Labtech в соответствии со стандартами, разработанными рабочей группой Европейского кардиологического общества и Североамериканского общества стимуляции и электрофизиологии.
Установлено, что в динамике наблюдения у 48 % детей, получающих патогенетическую терапию, отмечено повышение активности парасимпатического отдела вегетативной нервной системы, сопровождающееся нормализацией фракции выброса. А у 52 % детей, получающих метаболическую терапию, — повышение активности симпатического отдела вегетативной нервной системы, сопровождающееся лишь тенденцией к нормализации фракции выброса. В связи с этим детям с систолической дисфункцией миокарда любого генеза показано проведение патогенетической терапии ингибиторами ангиотензинпревращающего фермента.
Метою дослідження було вивчення динаміки варіабельності серцевого ритму в дітей із патологією міокарда залежно від комплексу терапії. Під спостереженням знаходилося 84 дитини та підлітка обох статей віком 11–18 років із систолічною дисфункцією міокарда при різних захворюваннях серця, з яких 42 дитини отримували патогенетичну терапію впродовж 3 місяців інгібіторами ангіотензинперетворюючого ферменту і 42 — засоби кардіометаболічної дії впродовж 30–45 днів повторними курсами двічі на рік. Оцінка варіабельності серцевого ритму проводилася за результатами біфункціонального добового моніторування ЕКГ та артеріального тиску за допомогою апарата ЕС-3Н/АВР із програмним забезпеченням Cardiospy фірми Labtech відповідно до стандартів, розроблених робочою групою Європейського кардіологічного товариства і Північноамериканського товариства стимуляції та електрофізіології.
Установлено, що в динаміці спостереження в 48 % дітей, які одержували патогенетичну терапію, відмічено підвищення активності парасимпатичної ланки вегетативної нервової системи та нормалізацію фракції викиду, а в 52 % дітей, які одержували кардіометаболічну терапію, — підвищення активності симпатичного відділу вегетативної нервової системи, що супроводжувалося лише тенденцією до нормалізації фракції викиду. У зв’язку з цим дітям із систолічною дисфункцією міокарда будь-якого генезу показано застосування патогенетичної терапії інгібіторами ангіотензинперетворюючого ферменту.
The aim of the research was to study the dynamics of changes in heart rate variability in children with myocardial pathology depending on the type of therapy. The study involved 84 children and adolescents of both genders aged 11–18 years with systolic myocardial dysfunction in various diseases of the heart, of which 42 children received pathogenetic therapy with angiotensin converting enzyme inhibitors for 3 months and 42 — drugs with cardiometabolic action for 30–45 days, repeated courses twice a year. Evaluation of heart rate variability was performed by the results of bifunctional daily monitoring of electrocardiographic and blood pressure monitoring using the apparatus ES-3N/AVR with Сardiospy software of Labtech company in accordance with standards developed by the Working Group of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology.
It was found that in dynamics of the observation 48 % of children receiving pathogenetic therapy reported increased activity of the parasympathetic autonomic nervous system, which is accompanied by normalization of ejection fraction. And 52 % of children receiving metabolic therapy — increased activity of the sympathetic autonomic nervous system, associated only with a trend toward ejection fraction normalization. Due to this, children with systolic myocardial dysfunction of any origin should receive pathogenetic therapy with angiotensin converting enzyme inhibitors.
вариабельность сердечного ритма, дисфункция миокарда, дети, лечение.
варіабельність серцевого ритму, дисфункція міокарда, діти, лікування.
heart rate variability, myocardial dysfunction, children, treatment.
Статья опубликована на с. 16-20
Хроническая сердечная недостаточность (ХСН) является одним из прогностически неблагоприятных осложнений при заболеваниях сердечно-сосудистой системы, приводящих к потере трудоспособности и уменьшению продолжительности жизни населения [2–4, 7, 9]. У детей и подростков, как правило, она развивается на фоне врожденных и приобретенных пороков сердца, первичных и вторичных кардиомиопатий, нарушений ритма и проводимости, после перенесенных воспалительных заболеваний миокарда [4, 6]. В связи с этим разработка эффективных подходов к лечению на ранних (еще до развития клинической картины) этапах развития ХСН, то есть на этапах формирования систолической дисфункции миокарда, имеет большое медико-социальное значение [2–6, 8, 9].
Одним из независимых прогностических факторов течения заболеваний сердца является вариабельность сердечного ритма (ВСР) — выраженность колебаний частоты сердечных сокращений по отношению к ее среднему уровню. Зачастую именно реакция вегетативной нервной системы (ВНС) является триггерным фактором развития аритмий у пациентов с патологией миокарда [5, 7, 9, 14]. По мнению многих исследователей, вегетативная дисфункция предшествует развитию определенных форм органной патологии, а ранняя диагностика и коррекция этого состояния позволяют предотвратить развитие или замедлить прогрессирование патологического процесса [1–3, 5, 8, 9, 12, 13]. Данные, полученные в результате анализа волновой структуры сердечного ритма, имеют важное значение для патогенетической терапии ряда заболеваний [5, 6, 9, 13, 14]. Таким образом, показатели ВСР, отражая степень напряжения регуляторных систем, определяют прогноз при патологии миокарда, влияют на выбор оптимальной терапевтической стратегии [2, 3, 5, 7, 9, 12, 13].
В соответствии с современными представлениями о патогенезе ХСН данное состояние рассматривается прежде всего как нарушение нейрогуморальных механизмов регуляции кровообращения (возникающее при любом заболевании сердца), начальным элементом которых является повышение активности симпатического отдела ВНС. Активация симпатоадреналовой системы на первых этапах носит компенсаторный характер, однако по мере прогрессирования процесса возникает целый комплекс дезадаптивных реакций с последующей активацией ренин-ангиотензин-альдостероновой системы.
Современная тактика ведения больных с патологией миокарда (ПМ) предусматривает раннее назначение, еще на доклиническом этапе развития процесса — на стадии формирования дисфункции миокарда, средств патогенетической терапии (ингибиторы ангиотензинпревращающего фермента (иАПФ) и β-адреноблокаторы), однако в педиатрической практике сохраняется также традиция назначения кардиометаболических средств (L-карнитин, тиотриазолин, триметазидин) [1, 4, 6, 9–11].
Целью исследования явилось изучение динамики вариабельности сердечного ритма у детей с патологией миокарда в зависимости от вида терапии.
Объем и методы исследования
Под наблюдением находилось 84 ребенка и подростка обоих полов в возрасте 11–18 лет с систолической дисфункцией миокарда (фракция выброса менее 55 %) при различных заболеваниях сердца (диспластические кардиомиопатии, нарушения ритма и проводимости, миокардит в анамнезе), из которых 42 ребенка получали патогенетическую терапию в течение 3 месяцев (иАПФ — эналаприл) и 42 — средства кардиометаболического действия (тиотриазолин, триметазидин, L-карнитин) курсами по 30–45 дней дважды в год. Обследование проведено до лечения и спустя 1 год. Контрольную группу составили 27 практически здоровых детей обоих полов в возрасте 11–18 лет с нормальными показателями артериального давления и фракции выброса, адекватным ответом на физическую нагрузку.
Оценка ВСР проводилась по результатам бифункционального суточного мониторирования ЭКГ и АД с помощью аппарата ЕС-3Н/АВР с программным обеспечением Сardiospy фирмы Labtech (Венгрия).
При анализе полученных результатов руководствовались стандартами измерения, физиологической интерпретации и клинического использования ВСР, разработанными рабочей группой Европейского кардиологического общества и Североамериканского общества стимуляции и электрофизиологии в 1996 году.
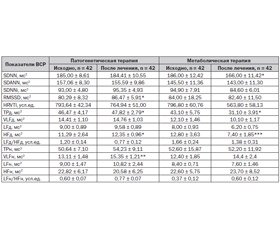
Стандарты измерения ВСР включают методы оценки временной и частотной областей. Они дополняют друг друга и являются лишь различными математическими способами анализа одного и того же феномена. Методы оценки временной области отражают степень выраженности синусовой аритмии и состоят из статистических методов, характеризующих нормальные интервалы (SDNN, SDANN, SDNNi, RMSSD), и геометрических методов (HRVTI), описывающих геометрические модели ВСР.
Статистические методы включают анализ последовательных интервалов NN и рассчитываются за сутки: SDNN (мс2) — стандартное отклонение всех анализируемых интервалов NN, отражает общий тонус ВНС; SDANN (мс2) — стандартное отклонение средних интервалов NN за 5-минутные промежутки времени, характеризует тонус симпатического отдела ВНС; SDNNi (мс2) — среднее значение стандартных отклонений интервалов NN за 5-минутные промежутки времени, вычисленные за 24 часа; RMSSD (мс2) — квадратный корень средних квадратов разницы между смежными NN-интервалами (оценка степени различия двух соседних интервалов NN), отображает тонус парасимпатического отдела.
Геометрические методы относительно нечувствительны к аналитическому качеству серии NN-интервалов. Они основаны на построении и анализе гистограмм. При этом в нашем исследовании определялся только триангулярный индекс (HRVTI, усл.ед.), представляющий собой интеграл плотности распределения (общее количество NN-интервалов), отнесенный к максимуму плотности распределения. Этот показатель характеризует общую ВСР и более зависим от низкочастотных составляющих.
Среди методов частотной (или спектральной) области изучались различные частотные составляющие сердечного ритма за дневной (д) и ночной (н) периоды: высокочастотные колебания (HF, мс2) — колебания частоты сердечных сокращений при частоте 0,15–0,4 Гц, которые отражают колебания парасимпатического отдела ВНС (маркер вагусного воздействия); низкочастотные колебания (LF, мс2) — часть спектра в диапазоне 0,04–0,15 Гц, которые характеризуют преимущественно изменения симпатического тонуса ВНС; очень низкочастотные колебания (VLF, мс2), представляющие диапазон частот 0,003–0,04 Гц, которые отражают гуморально-метаболические и церебральные эрготропные влияния; индекс симпатовагального взаимодействия (LF/HF, усл.ед.), который характеризует баланс симпатических и парасимпатических влияний; общая мощность спектра (TP, мс2), которая отражает суммарную активность вегетативного воздействия на сердечный ритм.
Статистический анализ проводился с помощью пакета прикладных программ SPSS Statistics 17.0.
Результаты и их обсуждение
При изучении временных параметров ВСР получены результаты, достоверно отличающиеся в группе детей с ПМ по сравнению с контролем (табл. 1).
Как видно из табл. 1, исходно у детей с ПМ имеется тенденция к повышению временных показателей, что свидетельствует о некоторой активации парасимпатических воздействий на ритм сердца.
При оценке волновой структуры сердечного ритма было установлено, что в дневное время суток отмечалось достоверное повышение общей мощности спектра (р < 0,02) за счет усиления высокочастотного компонента (р < 0,01), свидетельствующее об усилении вагусных воздействий на ритм сердца. Ночью имелась лишь тенденция к повышению этого показателя (р < 0,1) также за счет высокочастотного компонента (р < 0,05). Эти изменения влекли за собой снижение показателей симпатовагального индекса как днем (р < 0,1), так и ночью (р < 0,01). Следовательно, у детей с ПМ на этапах формирования систолической дисфункции миокарда отмечается усиление парасимпатических влияний на ритм сердца, особенно в ночное время суток.
При изучении показателей ВСР под влиянием проводимой терапии, без учета комплекса, по группе в целом существенной динамики не отмечалось.
Однако при индивидуальном анализе установлено, что в группе с ПМ исходно у 44 % детей ВСР была повышена, у 31 % — нормальная и у 25 % — снижена.
В динамике наблюдения наполнение группы с повышенной ВСР происходило за счет сохранения исходно высокой ВСР, повышения ее у детей с исходно нормальной и одного ребенка с исходно низкой ВСР. При этом у 60 % детей, получающих патогенетическую терапию (иАПФ), фракция выброса нормализовалась и составила 60–65 %, а у пациентов с метаболическим комплексом терапии отмечалась только тенденция к ее нормализации (55 %).
Снижение ВСР в динамике наблюдения имело место у 48 % детей, основную часть которых составили лица с исходно низкой (46,1 %) ВСР, но в нее вошли также дети с исходно нормальной (38,5 %) и высокой (15,4 %) ВСР. В этой группе также использовались оба вида лечения, но фракция выброса нормализовалась лишь у 30 % пациентов, независимо от терапевтического комплекса.
У больных с систолической дисфункцией миокарда под воздействием патогенетической терапии изменение вегетативного обеспечения ритма сердца происходит в основном за счет активации парасимпатического отдела, что проявляется достоверным повышением RMSSD и общей мощности спектра в дневное время за счет высокочастотного компонента (табл. 2).
Возрастание вагусных влияний рассматривается как адаптивное состояние с экономным использованием возможностей сердца. Это подтверждается повышением у детей фракции выброса в процессе лечения и является доказательством адекватности выбранной терапии.
На фоне метаболической терапии происходит снижение общего вегетативного тонуса (SDNN исходно — 186,00 ± 12,42 мс2, в динамике — 166,00 ± 11,42 мс2, р < 0,05) и общей мощности спектра днем (ТРд исходно — 43,10 ± 5,75 мс2, в динамике — 31,10 ± 3,91 мс2, р < 0,05) за счет высокочастотного компонента (HF исходно — 12,80 ± 3,63 мс2, в динамике — 7,40 ± 1,85 мс2, р < 0,001), что свидетельствует о снижении активности парасимпатического отдела ВНС и активации симпатического.
Снижение ВСР у больных с систолической дисфункцией миокарда является независимым показателем, свидетельствующим о прогрессировании процесса. У детей и подростков, имеющих доклиническую стадию ХСН, снижение ВСР также свидетельствует о прогрессировании дисфункции миокарда и неэффективности проводимой терапии, что подтверждается динамикой клинических проявлений.
При первичном исследовании в группе детей с ПМ клинические проявления не зависели от основного заболевания, а ведущими были кардиальные жалобы (60 %) и жалобы на головные боли (75 %).
Кардиальные жалобы представлены болевым синдромом, чувством перебоев в работе сердца и одышкой. Кардиалгии имели колющий характер, были кратковременными, также не зависели от вида нагрузок, купировались в покое или после приема седативных препаратов и мягких спазмолитиков. Чувство перебоев в работе сердца отмечали 23 % детей. В этой же группе зарегистрированы жалобы на чувство неполного вдоха (невротическое диспноэ) у 4 % лиц. Одышка при незначительной физической нагрузке выявлена у 16 % пациентов, причем они не относились к категории «детренированных» детей. Цефалгии у этих детей появлялись к концу занятий в школе или в вечернее время, не зависели от характера нагрузок, зачастую отмечалась их метеозависимость, иногда сопровождались головокружением (14 %). У 22 % обследуемых жалобы отсутствовали. При объективном осмотре обращали на себя внимание астеническое телосложение, бледность кожных покровов, синева под глазами.
На фоне проводимого лечения в обеих группах изменилась структура жалоб. В группе пациентов, получающих патогенетическое лечение иАПФ, уменьшилось количество жалоб на кардиалгии и сердцебиение, увеличилось число больных без жалоб (с 19,6 до 28,3 %). В группе, получавшей метаболическую терапию, также уменьшилось число детей с жалобами на кардиалгии и сердцебиение, 28 % детей вообще жалоб не предъявляли.
Таким образом, у детей с ПМ любого генеза исходно имеет место дисбаланс ВНС за счет преобладания парасимпатикотонии. На фоне проводимой патогенетической терапии ингибиторами ангиотензинпревращающего фермента отмечается дальнейшее повышение уровня активности парасимпатического отдела, за счет чего и обеспечивается повышение ВСР с нормализацией фракции выброса.
В группе детей, получающих метаболическую терапию, в процессе лечения происходит изменение вегетативного баланса в сторону активации симпатического звена, что приводит к снижению ВСР и лишь к тенденции повышения фракции выброса. Увеличение влияния симпатоадреналовой системы у этих детей может свидетельствовать о напряжении механизмов адаптации с последующим прогрессированием систолической дисфункции, что требует пересмотра комплекса терапии.
Выводы
1. У 48 % детей с систолической дисфункцией миокарда, получающих патогенетическую терапию (иАПФ), в динамике наблюдения отмечено повышение активности парасимпатического отдела ВНС, сопровождающееся нормализацией фракции выброса левого желудочка сердца.
2. У 52 % детей с патологией миокарда, получающих метаболическую терапию, в динамике наблюдения установлено повышение активности симпатического отдела ВНС, сопровождающееся лишь тенденцией к нормализации фракции выброса.
3. Детям с систолической дисфункцией миокарда любого генеза показано проведение патогенетической терапии иАПФ в сочетании с кардиотрофическими препаратами длительными курсами.
1. Алексеева Ю.М. Взаимосвязь между изменениями частоты и вариабельности ритма сердца под действием β-адреноблокаторов [Текст] / Ю.М. Алексеева, Т.А. Малкина, С.Ф. Соколов // Кардиология. — 2007. — № 12. — С. 24–34.
2. Вариабельность ритма сердца при хронической сердечной недостаточности и ее роль в прогнозе заболевания [Текст] / Г.Н. Арбонишвили, В.Ю. Мареев, Я.А. Орлова, Ю.Н. Беленков // Кардиология. — 2006. — Т. 46, № 12. — С. 4–11.
3. Воронков Л.Г. Варіабельність ритму серця та її прогностичне значення у хворих з хронічною серцевою недостатністю [Текст] / Л.Г. Воронков, Н.В. Богачова // Укр. кардіол. журнал. — 2004. — № 2. — С. 49–52.
4. Гончарь М.О. Порушення діастолічної функції міокарда шлуночків у дітей з природженими вадами серця [Текст] / М.О. Гончарь, Г.С. Сенаторова // Таврический медико-биологический вестник. — 2010. — Т. 13, № 2. — С. 30–32.
5. Жусупова Г. Вариабельность ритма сердца в зависимости от гемодинамического варианта сердечной недостаточности [Текст] / Г.К. Жусупова, Н.Л. Загоруля // Тезисы докладов Международного конгресса «Кардиология на перекрестке наук» совместно с V Международным симпозиумом по эхокардиографии и сосудистому ультразвуку, XVII ежегодной научно-практической конференцией «Актуальные вопросы кардиологии». — Тюмень, 2010. — С. 115–116.
6. Зубаренко А.В. Эффективность реабилитационных мероприятий при врожденных пороках сердца у детей после хирургического лечения [Текст] / А.В. Зубаренко, Е.А. Лосева // Материалы 11-го съезда педиатров Украины. — Киев, 2006. — С. 142.
7. Коваленко В.Н. Вариабельность ритма сердца как показатель функции вегетативной нервной системы у больных с сердечно-сосудистыми заболеваниями [Текст] / В.Н. Коваленко, Е.Г. Несукай, Е.В. Дмитриченко // Укр. кардіол. журнал. — 2006. — № 3. — С. 68–71.
8. Нагорная Н.В. Ранняя диагностика хронической сердечной недостаточности у детей с нарушениями ритма сердца и проводимости [Текст] / Н.В. Нагорная, Е.В. Пшеничная // Здоровье ребенка. — 2007. — № 3. — С. 35–42.
9. Овчарова О.М. Довготермінове виживання та незалежні предиктори його прогнозу у хворих з ХСН різного походження [Текст] / О.М. Овчарова // Національний конгрес кардіологів України: матеріали конгр. — Київ, 2009. — С. 177–178.
10. Рябенко Д.В. Достижения и эволюция фармакотерапии хронической сердечной недостаточности [Текст] // Сердечная недостаточность. — 2009. — № 1. — С. 55–64.
11. Рябенко Д.В. Фармакотерапия хронической сердечной недостаточности в XXI веке: достижения и вопросы [Текст] // Сердечная недостаточность. — 2014. — № 1. — С. 31–42.
12. De Ferrari G.M., Crijns H.J., Borggrefe M. et al. Chronic vagus nerve stimulation; a new and promising therapeutic approach for chronic heart failure // Eur. Heart J. — 2011. — 32(7). — 847–55.
13. Goldberger J.J., Le F.K., Lahiri M. Assesment of parasympathetic reactivation after exercise // Am. J. Physiol., 271 (Heart Circ. Physiol). — 2006. — Vol. 290. — Р. 2446–2452.
14. Sabbah H.N., Iisar I., Zaretsky A. et al. Vagus nerve stimulation in experimental heart failure // Heart Fail. Rev. — 2011. — 16. — Р. 171–178.

/18/18.jpg)
/19/19.jpg)