Украинский журнал хирургии 3-4 (26-27) 2014
Вернуться к номеру
Зменшення частоти високих ампутацій як результат клінічного застосування методу вакуум-кавітаційної санації гнійних ран у хворих із синдромом діабетичної стопи
Авторы: Шкварковський І.В., Антонюк Т.В., Шкварковська Н.В. - Буковинський державний медичний університет, м. Чернівці
Рубрики: Хирургия
Разделы: Клинические исследования
Версия для печати
Синдром діабетичної стопи є одним з найбільш частих і тяжких ускладнень цукрового діабету, що ускладнює перебіг захворювання. Ризик виникнення гангрени нижніх кінцівок у цих хворих у кілька разів вищий, ніж у загальній популяції. У світі щогодини виконується 55 ампутацій нижніх кінцівок з приводу синдрому діабетичної стопи. З метою зменшення частоти високих ампутацій розроблений метод комплексного хірургічного лікування з використанням низькочастотного ультразвуку та вакуумної терапії.
Синдром диабетической стопы является одним из наиболее частых и тяжелых осложнений сахарного диабета, что усугубляет течение заболевания. Риск возникновения гангрены нижних конечностей у таких больных в разы выше, чем в общей популяции. В мире ежечасно выполняется 55 ампутаций нижних конечностей в связи с синдромом диабетической стопы. С целью уменьшения частоты высоких ампутаций разработана методика комплексного хирургического лечения с использованием низкочастотного ультразвука и вакуумной терапии.
Diabetic foot syndrome is one of the most frequent and serious complications of diabetes, which complicates the disease. The risk of gangrene of the lower extremities in these patients is several times higher than in the general population. Worldwide hourly performed 55 amputations of lower limbs on diabetic foot syndrome. In order to decrease the high rate of amputations development of methods for complex surgical treatment using low-frequency ultrasound and vacuum therapy.
синдром діабетичної стопи, вакуумна терапія, ультразвукова кавітація.
синдром диабетической стопы, вакуумная терапия, ультразвуковая кавитация.
diabetic foot syndrome, vacuum therapy, ultrasound cavitation.
Статья опубликована на с. 28-32
Вступ
Цукровий діабет залишається однією з актуальних проблем медицини, оскільки він є одним з найбільш поширених ендокринологічних захворювань зі стійкою тенденцією до зростання. За останні роки досягнуті певні успіхи у вивченні патогенезу гнійно-запальних уражень при цукровому діабеті, хірургічному лікуванні таких хворих, зокрема реваскуляризуючих оперативних втручань, використання різноманітного ранового покриття та аплікацій на ранову поверхню стовбурових клітин [8]. Однак захворювання і надалі залишається медичною і соціальною проблемою з високим ризиком післяопераційної летальності, яка сягає 25–55% [7]. І навіть за умови успішного стаціонарного лікування у 50–60% осіб з гнійно-запальними ускладненнями м’яких тканин, на фоні цукрового діабету, протягом 3–5 років розвивається рецидив гнійно-запального процесу з переходом у некротичні ураження тканини і кінцівок [7].
Синдром діабетичної стопи є одним з найбільш частих і тяжких ускладнень цукрового діабету, що змінює перебіг захворювання майже у 25% пацієнтів. Ризик виникнення гангрени нижніх кінцівок у таких хворих у 20 разів вищий, ніж у загальній популяції [4]. Відсоток післяопераційних ускладнень залишається високим (30–37%), а летальність сягає 9–26% [3]. Велика соціальна значущість цукрового діабету полягає в тому, що він призводить до ранньої інвалідності. Ампутацію нижніх кінцівок у хворих на цукровий діабет виконують у 17–45 разів частіше, ніж в осіб без такого захворювання. Серед хворих на цукровий діабет після першої ампутації підлягає ампутації друга кінцівка – від 1 до 3 років – 6–30%, через 5 років – 28–51% [4].
Гнійно-запальний процес м’якої тканини за умови гіперглікемії має певну особливість перебігу. Порушення клітинної і гуморальної ланок імунітету призводить до швидкого поширення патогенних мікроорганізмів, місцевий прояв запалення не завжди супроводжується системними ознаками інфекції, що призводить до пізнього звернення хворих по медичну допомогу [10].
Нині, в аспекті вдосконалення хірургічної допомоги, науково–дослідницькі програми спрямовуються на боротьбу з тяжкими гнійно-некротичними ураженнями, які найчастіше виникають в ділянці стопи. Не існує методики для лікування рани, що була б універсальною на всіх стадіях запального процесу, досліджуються методи, засновані на різних фізичних методах (обробка рани низькочастотним ультразвуком, вакуумна терапія, кріотерапія, гіпербарична оксигенація та застосування лазерів) [4].
Вакуумна терапія знаходить все більш широке використання в комплексному лікуванні гнійних ран. Лікувальний ефект досягається створенням постійного негативного тиску на всій рановій поверхні. При цьому відбувається активне видалення продуктів некротичного розпаду та надмірного ранового ексудату, у тому числі речовин, що уповільнюють загоєння рани (наприклад, матриксних металопротеїназ і продуктів їх розпаду) [5,9]. Збереження вологості ранової поверхні, що стимулює ангіогенез, посилює фібриноліз і сприяє функціонуванню чинників зростання. Створюється умова для швидкої елімінації мікробного фактора з вогнища запалення. Зниження локального інтерстиціального набряку тканини, зниження міжклітинного тиску, посилення місцевого лімфообігу і транскапілярного транспорту поліпшує живлення тканини і збільшує швидкість формування грануляційної тканини, а поліпшення перфузії ранового ложа додатково сприяє деконтамінації рани [6].
При обробці ран ультразвуком виникають кавітаційні процеси, завдяки яким відбувається дезінфекція рани на глибині, вимивання фібрину і ексудату з тяжкодоступних ділянок рани. Ультразвук має виражену бактерицидну і бактеріостатичну дію на збудники ранової інфекції, знижує їх антибіотикорезистентність, стимулює внутрішньоклітинний біосинтез і регенераторний процес у рані, сприяє розширенню капілярів у грануляційній тканині, поліпшує мікроциркуляцію. Також має властивість потенціювати дію лікарських засобів, що застосовуються для місцевого лікування рани. Бактерицидний ефект зумовлений ушкоджувальною дією ультразвукової хвилі на мікробну клітину, підвищенням температури в озвучуваному середовищі, утворенням у ній хімічних сполук, які згубно діють на мікроорганізми [1]. Крім поліпшення мікроциркуляції, ультразвук має протизапальну дію внаслідок усунення застійного процесу, розсмоктування інфільтрату, підвищення фагоцитарної активності лейкоцитів і рівня природного захисту. Вплив низькочастотного ультразвуку на тканину приводить до активації синтезу протеїнів фібробластами і факторів росту макрофагами, збільшення продукції NO ендотеліальними клітинами під впливом низькочастотного ультразвуку і поліпшення перфузії ішемізованих тканин [2].
Мета дослідження. Підвищити ефективність хірургічного лікування гнійно-некротичного процесу у хворих із синдромом діабетичної стопи з метою зменшення частоти високих ампутацій за рахунок використання вакуум-кавітаційної санації із застосуванням антисептичних розчинів.
Матеріал і методи
На базі хірургічного відділення № 1 КМУ "Лікарні швидкої медичної допомоги" м. Чернівці проведено лікування 31 хворого після первинного оперативного втручання з приводу гнійно-некротичного процесу синдрому діабетичної стопи – 13 чоловіків і 18 жінок. Вік пацієнтів коливався від 39 до 64 років і, у середньому, становив 56,4 ± 2,18 року. Серед нозологічних форм діагностовані: 15 хворим виконана ампутація стопи за Лісфранком, 6 пацієнтам – ампутація стопи за Шарпом, у 10 хворих – рана після ампутації стопи за Шопаром. Середній термін ускладнень після первинного оперативного лікування становив 6,2 ± 1,12 доби. Застосовували спосіб лікування гнійної рани кавітаційно-вакуумним методом за розробленою методикою (патент України №81727, опублікований 10.07.2013. Бюл. №13).
Контрольну групу становили 40 пацієнтів з гнійно–некротичним процесом синдрому діабетичної стопи після первинного оперативного втручання – 18 чоловіків і 22 жінки. Вік пацієнтів коливався від 39 до 68 років і, у середньому, склав 53,2 ± 2,31 року. Групи були порівнянні за віком і нозологічними формами. Середній термін розвитку захворювання до звернення за медичною допомогою в контрольній групі становив 6,6 ± 1,15 доби (p > 0,05). Лікування хворих у контрольній групі проводилося за традиційними методиками.
Статистичну обробку отриманих результатів проводили на персональному комп'ютері за допомогою програм «Microsoft Excel» і «Statistica 6.0». При цьому виконували обчислення середніх величин (M), їх помилки (m), відмінність у показниках вважалои достовірним при p < 0,05.
Результати дослідження та їх обговорення
Усім хворим після видалення некротично зміненої тканини проводиться заливка порожнини розчином антисептика і виконується ультразвукова кавітація дна рани з резонансною частотою 26,5 кГц і потужністю 1,5 вт/см, тривалість процедури залежить від розміру ранової поверхні – 1 хв на 1 см2. У подальшому в рані розміщують змодельовану до її форми та розміру поролонову губку (розмір пор 500–1500 мікрометрів) з перфорованим дренажем, який розташовується всередині губки і виводиться через окремий розтин шкіри на відстані від країв рани, що дозволяє краще герметизувати порожнину. Рану закривають зовні клейкою плівкою для досягнення повної герметичності. Зовнішній кінець дренажу під’єднують до вакуумного пристрою, що дозволяє підтримувати від’ємний тиск на рівні 0,1–0,2 атм. Ступінь розрідження визначається стадією перебігу ранового процесу, характером ранового вмісту. Пористість губки має значення, розмір пор залежить від характеру ранового ексудату. На початку лікування перевагу надається губкам з розміром пор 1500 мікрометрів, що дозволяє евакуювати залишки некротизованих тканин. У стадії проліферації, коли ексудація з рани є мінімальною і утворюється грануляційна тканина, доцільно застосовувати губки з меншим розміром пор (500 мікрометрів), що не ушкоджує грануляційну тканину.
У післяопераційному періоді досліджували інтенсивність больового синдрому, термін очищення рани, кількість ранового ексудату (відсутній, незначний, помірний, значний), характер ранового ексудату (відсутній, серозний, серозно–гнійний, гнійний), наявність перипроцесу (набряк, гіперемія) (відсутній, слабо виражений, помірно виражений, сильно виражений), наявність грануляції (відсутня, поодинока, виповнює повністю, надмірна), характер грануляцій (відсутня, дрібнозерниста, велико зерниста, лакова), епітелізація (відсутня, слабка, помірна, виражена, повна), наявність шкірного свербежу, швидкість загоєння рани, термін накладання вторинного шва на рану, динаміку кількості мікробних тіл у біоптаті рани, динаміку лейкоцитарного індексу інтоксикації, тривалість післяопераційного ліжко–дня.
За результатами клінічних спостережень визначено, що хворі, яким проводили вакуум-кавітаційну обробку рани за розробленою методикою, вже на другу добу відзначали вщухання болю і свербежу, зниження температури тіла, нормалізацію сну й апетиту. Дані ознаки зменшувалися в контрольній групі тільки на 3–4 добу.
Зменшення перифокального набряку та гіперемії шкіри навколо рани відзначали у більшості пацієнтів основної групи – 26 (83,9%) до 2 діб лікування. При цьому ознаки перифокального набряку в контрольній групі зберігалися на другу добу в усіх хворих (p < 0,05) і тільки на четверту добу зникали у 33 (82,5%) хворих. Ознаки лимфангоїту і лімфаденіту зникали в усіх хворих основної групи на 3 добу проведеної терапії, при цьому в контрольній групі – на 5 добу.
Інтенсивність больового синдрому коливалася від трьох до шести балів за Цифровою Рейтинговою Шкалою (Numerical Rating Scale, NRS) [10] і в середньому склала 4,3 ± 0,22 бала в основній групі. У контрольній групі інтенсивність больового синдрому тановила 5,7 ± 0,46, що достовірно вище показника контрольної групи (p < 0,01).
Очищення рани від некротичної тканини відбувалося після 2–3 сеансів ультразвукової кавітації в основній групі, що відповідало в середньому 4,6 ± 0,35 добу. У контрольній групі очищення відбувалося тільки на 6,7 ± 0,63 добу (p < 0,05). Виділення ранового ексудату зменшувалося наполовину на 4,4 ± 0,50 доби в основній групі, що було достовірно менше показника основної групи – 6,4 ± 0,46 доби (p < 0,05). Зміна характеру виділень від гнійних до серозних проходила в середньому до 3,9 ± 0,47 доби у хворих основної групи. У контрольній групі цей показник становив 5,6 ± 0,53 доби, що достовірно вище основної групи (p < 0,05).
У хворих основної групи середній термін появи грануляційної тканини становив 2,9 ± 0,36 доби, а початок крайової епітелізації – 3,6 ± 0,44 доби. Дані показники були достовірно (p < 0,05) вищими в контрольній групі – 4,2 ± 0,51 доби і 5,0 ± 0,54 доби відповідно.
Швидкість загоєння рани визначали за методикою Л.Н. Попової [4], що становило 3,4 % протягом перших 5 діб і 4,8% – до повного загоєння рани. У 22 (71,0%) хворих основної групи закриття ранового дефекту провели за допомогою вторинного шва на 6,3 ± 1,6 добу. Швидкість загоєння рани у хворих контрольної групи була 2,8% до 5 діб і 4,1% – до повного загоєння рани. У контрольній групі рани гоїлися вторинним натягом без накладення вторинних швів.
Динаміка кількості мікробних тіл в біоптаті рани хворих основної групи, яку визначали в Lg КУО/г тканини рани, показала, що вихідний рівень обсіменіння післяопераційної рани мікрофлорою становив 8,9 ± 0,15 Lg КУО/г тканини, на 3 добу після операції – 3,5 ± 0,20 Lg КУО/г тканини і на 6 добу – 2,5 ± 0,18 Lg КУО/г тканини. При цьому вихідний показник обсіменіння післяопераційної рани мікрофлорою достовірно не відрізнявся в контрольній групі – 8,7 ± 0,19 Lg КУО/г (p > 0,05). Показники на 3 і 6 добу були достовірно вищими в контрольній групі – 6,3 ± 0,30 Lg КУО/г (p < 0,01) і 4,7 ± 0,25 Lg КУО/г (p < 0,01) відповідно.
При надходженні визначали лейкоцитарний індекс інтоксикації (ЛІІ) за формулою Кальф-Каліфа, що становив 5,4 ± 0,41 в основній групі і не відрізнявся від показника контрольної групи – 5,6 ± 0,26 (p > 0,05). В основній групі на 3 добу ЛІІ знизився до 3,2 ± 0,26, а на 6 добу – до 2,5 ± 0,15, що було достовірно нижче ЛІІ у контрольній групі – 4,7 ± 0,33 (p < 0,01) і 3,4 ± 0,22 (p < 0,01) відповідно на 3 і 6 добу.
У 8 (20%) хворих контрольної групи не вдалося зберегти кінцівку і довелося виконувати високу ампутацію внаслідок прогресування гнійно–некротичного процесу. В основній групі висока ампутація виконана у 2 (6,5%) хворих. Тривалість післяопераційного періоду була достовірно нижча (p < 0,05) у хворих основної групи і становила 20,2 ± 0,94 доби проти 28,4 ± 1,20 доби в контрольній групі.
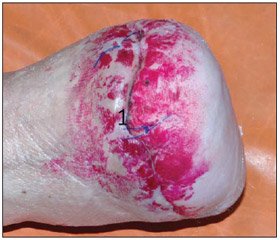
Найбільш наочно результати нашого лікування демонструє таке спостереження: хвора В., 40 років, надійшла до 1-го хірургічного відділення ЛШМД 19.05.2013р., через два місяці від початку захворювання, з діагнозом: цукровий діабет І типу, тяжкий перебіг, субкомпенсований, ускладнений мікро- та макроангіопатією судин нижніх кінцівок, периферичною сенсорною полінейропатією, синдром діабетичної стопи, гнійно-некротична рана культі правої стопи. З анамнезу: пацієнтка була прооперована з приводу гангрени пальців правої стопи, після зняття швів на 10 добу краї рани розійшлися, приєдналася вторинна інфекція. (рис. 1).
/31/31.jpg)
При надходженні – скарги на біль у ділянці рани, набряк та почервоніння правої стопи, виділення гнійного характеру, підвищення температури тіла до 38,2 С. Об’єктивно: загальний стан хворої середнього ступеня тяжкості, шкіра та слизові оболонки блідо-рожевого кольору. Пульс 84 за 1 хв, задовільної властивості, АТ 100/70 мм рт. ст. Серцеві тони ритмічні, у легенях дихання везикулярне. Язик вологий, обкладений білим нальотом. Живіт звичайної форми, симетричний, бере участь в акті дихання, при пальпації м’який, неболючий, симптоми подразнення очеревини негативні, перистальтика активна. Локально: у ділянці правої стопи рана розміром 10х4х2 см, дно вкрите нальотом фібрину, набряк, гіпертермія стопи, виділення серозно-гнійні, при пальпації визначається болючість. У день надходження була проведена обробка рани низькочастотним ультразвуком упродовж 15 хв з частотою 25 кГц, із заливкою порожнини розчином антисептика (рис. 2).
20.05.2013р накладені вакуумні пов’язки, проведені чотири сеанси вакуумної терапії (рис. 3).
Закриття ранового дефекту проводилося за допомогою вторинних швів 24.05.2013р (рис. 4).
На 2 добу зменшився больовий синдром, нормалізувалася температура тіла, зникли набряк та гіперемія шкіри навколо рани. Інтенсивність больового синдрому за Цифровою Рейтинговою Шкалою (Numerical Rating Scale, NRS) становила 5 балів. Повне очищення рани від некротичної тканини відбулося на 4 добу, грануляційна тканина з’явилася на 2 добу, крайова епітелізація – на 6 добу. Швидкість загоєння рани, що визначали за методикою Л.Н. Попової, становила 6,4%. Динаміка кількості мікробних тіл у біоптаті рани показала: вихідний рівень обсіменіння післяопераційної рани мікрофлорою становив 8,4 Lg КУО/г тканини, на 4 добу після операції – 4,2 Lg КУО/г тканини і на 7 добу — 2,1 Lg КУО/г тканини. При надходженні лейкоцитарний індекс інтоксикації сягав 5,4, на 4 добу показник дорівнював 3,6, на 7 добу – 2,0. Тривалість післяопераційного періоду становила 16 діб (рис. 5).
Висновок
Клінічне використання запропонованого способу лікування гнійно-некротичного процесу у хворих із синдромом діабетичної стопи дозволило запобігти виконанню високої ампутації і сприяло більш швидкому очищенню рани, зменшенню мікробної контамінації, зменшенню площі ранової поверхні, пришвидшенню розвитку грануляційної тканини і процесу епітелізації.
1. Арефьев В.А. Метод ультразвуковой кавитации в комплексном хирургическом лечении гранулирующих ран / В.А. Арефьев, Л.А. Анищенко, Р.А. Агеев // Клінічна хірургія. – 2009. – № 11–12. – С. 4–6.
2. Брискин Б.С. Ультразвуковая кавитация в лечении гнойно-некротических осложнений синдрома диабетической стопы / Б.С. Брискин, М.В. Полянский, Ф.В. Прошин // Инфекции в хирургии. – 2007. – № 3. – С. 33–39.
3. Варианты гнойно-некротического поражения у больных при синдроме диабетической стопы. / Н.Н. Милица, В.В. Солдусова // Клінічна хірургія. – № 11–12. – С. 56.
4. Грекова Н.М. Хирургия диабетической стопы / Н.М. Грекова, В.Н. Бордуновский. – М.: ИД « Медпрактика-М», 2009. – 188 с.
5. Зайцева Е.Л. Вакуум-терапия в лечении хронических ран / Е.Л. Зайцева, А.Ю. Токмакова // Сахарний диабет. – 2012. – № 3. – С. 45–49.
6. Кутовой А.Б. Лечение гнойных ран с использованием вакуум-терапии / А.Б. Кутовой, С.О. Косульников, С.А. Тарнопольский // Клінічна хірургія. – 2011. – № 6. – С. 51–61.
7. Маслова О. В. Эпидемиология сахарного диабета и микрососудистых осложнений / О. В. Маслова, Ю.И. Сунцов // Сахарный диабет. – 2011. – № 3. – С. 6–11.
8. Удовиченко О. В. Диабетическая стопа / О. В. Удовиченко, Н. М. Грекова. – М.: Практическая медицина, 2010. – 272 с.
9. Fraccalvieri M. Patien’s pain feedback using negative pressure wound therapy with foam and gauze / M. Fraccalvieri, E. Ruka // International wound journal. – 2011. – № 8. – Р. 492–499.
10. ShawJ. E. Global estimates ofthe prevalence of diabetes for 2010 and 2030/ J.E. Shaw, R.A. Sicree, P.Z. Zimmet // Diabetes Res. Clin. Pract. – 2010. –Vol. 87. – № 1. – P. 4–14.

/31/31_2.jpg)