Журнал «Здоровье ребенка» 6 (57) 2014
Вернуться к номеру
Значення поліморфізму генів глутатіон-S-трансфераз (GSTM1, GSTT1) при різних запальних фенотипах бронхіальної астми в дітей
Авторы: Колоскова О.К., Безруков Л.О., Білоус Т.М., Григола О.Г., Ортеменка Є.П. - Буковинський державний медичний університет, м. Чернівці
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Мета дослідження: вивчити особливості гетерогенного запалення дихальних шляхів у дітей, які страждають від бронхіальної астми (БА), за делеційного поліморфізму генів GSTM1 та GSTT1.
Матеріал і методи. Обстежені 102 хворі шкільного віку, які страждають від БА, з яких у 46 дітей (І клінічна група) встановлено еозинофільний характер запалення бронхів, у 33 пацієнтів (ІІ клінічна група) — нейтрофільний варіант, а у 23 (ІІІ група) — пауцигранулоцитарний характер запальних змін у бронхах.
Результати. У хворих на бронхіальну астму гомозиготна делеція гена GSTT1 визначалася у кожної п’ятої дитини незалежно від характеру запалення бронхів. У хворих з еозинофільним субтипом запалення бронхів делеція гена GSTМ1 відмічена у 32,6% випадків, при нейтрофільному — у 51,1 % та пауцигранулоцитарному — у 21,7 % спостережень. У дітей із генотипом T1delM1+ тяжкий перебіг БА у I групі визначався у 37,5 % випадків, у II — у 50,0 % та у III групі — у 100 % спостережень (Р III : I, II < 0,05).
Висновки. Таким чином, у дітей із різними запальними фенотипами бронхіальної астми є певні особливості перебігу захворювання за наявності делеційного поліморфізму генів GSTM1 і GSTT1, що слід враховувати при виборі тактики лікування цих пацієнтів.
Цель исследования: изучить особенности гетерогенного воспаления бронхов у детей с бронхиальной астмой (БА) при делеционном полиморфизме генов GSTM1 и GSTT1.
Материал и методы. Обследованы 102 ребенка школьного возраста с БА, из них у 46 детей (І клиническая группа) установлен эозинофильный характер воспаления бронхов, у 33 пациентов (ІІ клиническая группа) — нейтрофильный вариант, а у 23 (ІІІ группа) — пауцигранулоцитарный характер воспалительных изменений в бронхах.
Результаты. У больных бронхиальной астмой гомозиготная делеция гена GSTT1 определялась у каждого пятого ребенка независимо от характера воспаления бронхов. У пациентов с эозинофильным субтипом воспаления бронхов делеция гена GSTМ1 отмечена в 32,6 % случаев, при нейтрофильном — в 51,1 % и пауцигранулоцитарном — в 21,7 % наблюдений. У детей с генотипом T1delM1+ тяжелое течение БА в I группе наблюдалось в 37,5 % случаев, во II — в 50,0 % и в III группе — в 100 % наблюдений (Р III : I, II < 0,05).
Выводы. Таким образом, у детей с различными воспалительными фенотипами бронхиальной астмы наблюдаются определенные особенности течения заболевания при наличии делеционного полиморфизма генов GSTM1 и GSTT1, что следует учитывать при выборе тактики лечения этих пациентов.
The aim of research: to study the peculiarities of a heterogeneous airway inflammation in children with bronchial asthma (BA) under the deletion polymorphism of GSTM1 and GSTT1 genes.
Materials and Methods. We have examined 102 school-aged children with BA, of whom in 46 patients (I clinical group) the eosinophilic type of bronchial inflammation was verified, in 33 patients (II clinical group) — the neutrophilic type, and in 23 children (ІІІ group) — paucigranulocytic nature of inflammatory changes in the bronchi.
Results. In patients with bronchial asthma, the homozygous deletion of GSTT1 gene has been detected in every fifth child, independently of type of airway inflammation. In patients with eosinophilic subtype of inflammation of the bronchi, GSTM1 gene deletion was noted in 32.6 % of cases, with neutrophilic one — in 51.1 % and with paucigranulocytic — 21.7 % of cases. In children with T1delM1+ genotype, severe BA in I group was detected in 37.5 % of cases, in the II — in 50.0 %, and in III group — in 100 % of cases (PIII : I,II < 0.05).
Conclusions. Thus, children with different inflammatory phenotypes of asthma have certain characteristics of the disease course in the presence of GSTM1 and GSTT1 genes deletion polymorphism, which should be considered when choosing a treatment strategy in these patients.
бронхіальна астма, діти, глутатіон-S-трансфераза.
бронхиальная астма, дети, глутатион-S-трансфераза.
bronchial asthma, children, glutathione-S-transferase.
Статья опубликована на с. 45-48
Вступ
Хронічне запалення дихальних шляхів — один із ключових феноменів бронхіальної астми (БА) [9, 10]. Варто визнати, що недостатня ефективність контролюючого лікування БА певною мірою пов’язана з гетерогенністю запального процесу в дихальних шляхах, а саме з наявністю еозинофільного, нейтрофільного та пауцигранулоцитарного характеру запалення дихальних шляхів [1, 5]. Відмічено, що за наявності нейтрофільного характеру запального процесу в бронхах знижується контрольованость БА з ознаками її терапевтичної резистентності [7]. Це вимагає індивідуалізованого підходу до лікування цієї хвороби, зокрема, з урахуванням характеру запалення дихальних шляхів. Дана вимога є тим більше актуальною, оскільки в останні роки відмічена чітка тенденція до підвищення рівня захворюваності на неалергічну БА, в основі якої зазвичай лежить нееозинофільний характер запалення бронхів [4, 6, 8]. У той же час варто визнати, що діагностика різних запальних фенотипів БА у дітей на сьогодні залишається невдосконаленою. Так, після короткочасного оптимізму щодо цього прийшло усвідомлення того факту, що варіант запалення бронхів, який визначається за цитологічним складом мокротиння, нерідко непостійний і має швидше дискретний, аніж безперервний характер [13]. Враховуючи це, можна припустити, що зменшення діагностичних помилок можна досягнути, визначаючи запальний патерн бронхів на основі комплексу особливостей БА, а також генетичної схильності до їх розвитку [2].
Дійсно, БА розглядається як мультифакторне захворювання, при якому реалізація патологічного процесу визначається взаємодією генетичних факторів і чинників середовища. Сьогодні механізм розвитку цього захворювання трактується з молекулярно-генетичної точки зору з урахуванням поліморфізму генів, що впливають на формування та клінічні прояви БА [11]. Формування запального процесу в бронхах певною мірою визначається генетичною компонентою, яка, зокрема, модифікує здатність дихальних шляхів захищати себе від вдихуваних патогенних речовин із навколишнього середовища. Водночас варто визнати, що предикторна роль генетичних факторів у розвитку характеру запалення бронхів залишається недостатньо вивченою.
Мета роботи — вивчити особливості гетерогенного запалення дихальних шляхів у дітей, які страждають від бронхіальної астми, за делеційного поліморфізму генів GSTM1 та GSTT1.
Матеріал і методи
Обстежені 102 хворі шкільного віку, які страждають від БА. З них у 46 дітей (І клінічна група) встановлено еозинофільний характер запалення бронхів (ЕХЗ), у 33 пацієнтів (ІІ клінічна група) — нейтрофільний варіант (НХЗ), а у 23 (ІІІ група) — пауцигранулоцитарний характер запальних змін (ПХЗ) у бронхах. За основними клінічними характеристиками групи були порівнянні. Так, у І групі хлопчиків було 65,3 %, а середній вік пацієнтів становив 11,2 року. У ІІ клінічній групі частка хлопчиків становила 56,7 %, а середній вік представників даної групи сягав 13,1 року (Р > 0,05). Середній вік представників ІІІ групи становив 10,3 року, хлопчиків серед них було 65,2 % (P > 0,05). За ступенем тяжкості захворювання у І групі тяжка форма траплялася у 27 пацієнтів (58,7 %), середньотяжка — у 15 дітей (32,6 %) та легка — у 4 школярів (8,7 %). У представників ІІ групи тяжка астма траплялася у 15 хворих (45,4 %, Р > 0,05), середньотяжка — у 14 дітей (42,4 %, Р > 0,05), а легка — у 4 школярів (12,2 %, Р > 0,05). У ІІІ клінічній групі наведена вище тяжкість БА відповідно визначалася у 12 (52,2 %) пацієнтів, 10 (43,5 %) дітей та 1 (4,3 %) хворого (P > 0,05).
Характер запалення бронхів визначали на підставі цитологічного аналізу індукованого мокротиння, одержаного шляхом інгаляції гіпертонічних (3, 5, 7 %) розчинів натрію хлориду: за наявності в мокротинні 3 % та більше еозинофільних лейкоцитів робили висновок про еозинофільний характер запальних змін дихальних шляхів, а за наявності 59 % та більше нейтрофільних та менше 3 % еозинофільних гранулоцитів встановлювали нейтрофільний запальний варіант [12]. Пауцигранулоцитарний варіант запалення бронхів встановлювали при меншому вмісті цих гранулоцитів, тобто еозинофілів менше 3 %, а нейтрофілів — менше 59 %.
Про активність запального процесу в бронхах робили висновок за вмістом метаболітів монооксиду нітрогену в конденсаті повітря, що видихається (КПВ) (Ємченко Н.Л., 1994), а неспецифічну реактивність бронхів оцінювали за індексом лабільності (ІЛБ) та її компонентами — індексом бронхоспазму (ІБС) у пробі з дозованим фізичним навантаженням (6-хвилинний біг) та індексом бронходилатації (ІБД) при вдиханні сальбутамолу. Шкірну чутливість негайного типу до основних аероалергенів оцінювали за допомогою прик-тестів із використанням стандартних наборів виробництва ТОВ «Імунолог» (м. Вінниця, Україна). Генетичні дослідження проводилися на кафедрі молекулярної генетики та біотехнології Чернівецького національного університету ім. Ю. Федьковича. Загальну геномну ДНК виділяли з периферичної крові, генотипування GSTM1, GSTT1 здійснювали за допомогою полімеразної ланцюгової реакції (ПЛР), результати якої аналізували методом електрофорезу в 2% агарозному гелі з використанням трис-боратного буфера. Виявлення делецій у цих генах здійснювали методом мультиплексної ПЛР із використанням відповідних специфічних праймерів. Як позитивний контроль використовували ампліфікацію фрагмента гена BRCA1. Гомозиготні форми з делецією обох копій генів GSTM1 та GSTT1 позначали як M1del та Т1del. Відповідно, наявність цих фрагментів на електрофореграмах свідчила про гомо- або гетерозиготність за нормальними копіями генів та позначалась як М1+ та Т1+.
Отримані результати аналізували методами біостатистики. Правильність нульової гіпотези визначалася з урахуванням рівня значимості Pt (за Стьюдентом) і Pt (метод кутового перетворення Фішера). Дослідження проведене з урахуванням основних положень GCP IH та Гельсинської декларації щодо біомедичних досліджень.
Результати та їх обговорення
Розглядаючи БА як багатофакторне захворювання, у розвитку якого відіграють певну роль генетична схильність до атопії та патогенні чинники зовнішнього середовища, ми вивчали окремі показники взаємодії цих факторів. Так, у створених групах порівняння оцінювали масу тіла при народженні, оскільки вона розглядається як ознака генетичної схильності до БА [3]. Відмічено, що серед хворих І клінічної групи випадки маси тіла при народженні понад 3400 г мали місце у 71,0 % випадків, а менше 2500 г — в 11,0 % спостережень. У ІІ клінічній групі наведена маса тіла при народженні визначалася відповідно у 63,0 та 15,0 % спостережень, а у ІІІ групі ці показники відповідно сягали 52,0 та 4,3 %. Природне вигодовування на першому році життя, що багато в чому є визначальним стосовно імунного статусу дитини в подальшому, у представників І клінічної групи мало місце в 63,0 % випадків, ІІ — у 75,0 % та ІІІ групи — у 43,0 % спостережень.
Генеалогічний індекс за атопічними захворюваннями у дітей з ЕХЗ бронхів становив у середньому 0,061, у ІІ групі — 0,07 та у ІІІ групі — 0,08. У представників І клінічної групи успадкування атопічних захворювань за родоводом матері відмічене у 27,3 %, а батька — 21,7 %; у дітей із НХЗ бронхів такий характер успадкування відмічений у 27,3 та 42,4 % відповідно, а у ІІІ групі — відповідно у 17,4 та 17,4 % випадків. Слід відмітити, що діти сформованих груп порівняння знаходилися під різним пресингом чинників, що сприяють сенсибілізації організму. Так, у представників І клінічної групи наявність килимів в оселях траплялась у 19,0 % випадків, домашніх тварин — у 6,0 %, а експозиція тютюнового диму в побуті — у 17,4 % спостережень. У хворих із НХЗ дихальних шляхів вплив наведених потенційно патогенних чинників відзначався відповідно у 18,0; 6,0 та 24,2 % випадків. Наявність килимів в оселях дітей ІІІ клінічної групи відмічена у 26,0 % випадків, тварин — у 17,4 % та експозиція тютюнового диму, коли дитина виступала як пасивний курець, — у 56,5 % спостережень.
За результатами ПЛР встановлено генетичний дефект у структурі гена GSTT1 у 21,7 % дітей I клінічної групи, 21,2 % осіб II групи та 26 % пацієнтів III групи порівняння (Р > 0,05). Попри відсутність вірогідних відмінностей за частотою поширення генотипу GSTТdel відмічено підвищену схильність до атопічних захворювань за наявності генотипу GSTТdel у дітей із ПХЗ. Так, ознаки атопічного дерматиту в дітей із GSTТdel у III клінічній групі відмічались у 83,3 % випадків, у I групі — у 30 % та у II — у 57,1 % спостережень (Р I : II : III < 0,05). При цьому значна шкірна чутливість негайного типу і вищий рівень загального IgE в крові був притаманний хворим з ЕХЗ. Так, чутливість шкіри на побутові алергени у пацієнтів I групи оцінювалась у середньому 3,83 ± 0,16 «+», а вміст у сироватці загального IgE становив 905,8 МО/мл. У дітей II групи це відповідало 2,75 ± 0,95 «+» (Р < 0,05) і 472,7 МО/мл (Р < 0,05). У III групі чутливість шкіри до цих алергенів не перевищувала «+» реакції (Р < 0,05), а вміст загального IgE становив 669,9 МО/мл (Р < 0,05).
У дітей із НХЗ при GSTТdel відмічалась більш виражена лабільність бронхів. Зокрема, середній показник ІБС у I групі становив 7,5 ± 2,2 % тоді як у II клінічній групі він сягав 16,2 ± 4,5 (Р I : II > 0,05) та у III групі дорівнював 2,3 ± 1,6 % (Р = 0,01). Так, ІЛБ на рівні дрібних бронхів у даних хворих становив 27,1 ± 6,5 %, у I групі — 23,5 ± 4,8 % (Р > 0,05), а у дітей із ПХЗ — 14,6 ± 6,2 % (Р = 0,03).
Гомозиготна делеція GSTM1 частіше визначалась у дітей із НХЗ. Так, генотип GSTMdel у I групі траплявся у 32,6 ± 6,9 % дітей, у II групі у 51,5 ± 8,7 % пацієнтів та у III групі порівняння у 21,7 ± 8,6 % хворих (Р I : II : III < 0,05).
Тяжка БА з генотипом GSTMdel визначалась у 66,7 % випадків, при НХЗ — у 47,0 % (Рф < 0,05), а у представників III групи тяжкого перебігу БА не визначали. Показано, що в дітей груп порівняння визначалась дискордантність частоти виявлення тяжкої БА і показників запалення/гіперреактивності бронхів. Так, середній уміст метаболітів NO у КПВ у дітей I групи становив 39,3 мкмоль/мл, у II групі — 48,5 мкмоль/мл та в III групі — 55,6 мкмоль/мл (Р > 0,05). Чутливість бронхів до гістаміну у даних хворих становила відповідно 2,03; 0,7 та 0,33 мг/мл (Р > 0,05).
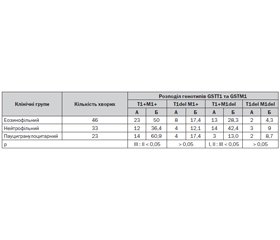
У табл. 1 наведена частота виявлення комбінацій поліморфізму GSTT1 та GSTM1 у дітей груп порівняння.
Варто відмітити, що подана структура комбінацій поліморфізму генів GSTT1 та GSTM1 у дітей із різним характером запалення дихальних шляхів визначала також частоту проявів інших характеристик захворювання. Так, за наявності генотипу T1+M1del у хворих груп порівняння відмічена тенденція до тяжкого перебігу БА. Зокрема, тяжка БА у I клінічній групі визначалась у 61,5 % випадків, у II групі — у 42,9 % та у III — у 66,7 % спостережень. Окрім цього, за наявності цього генотипу у хворих із ПХЗ бронхів частіше визначались супутні атопічні захворювання. Так, в усіх цих хворих виявлявся алергічний риніт, який у I групі відмічався лише у 15,4 % осіб, а у II групі — у 71,4 % пацієнтів (Р < 0,05). На противагу цьому у вказаних дітей III групи не визначались випадки підвищеної чутливості до трофоалергенів, прояви якої були визначені за даного генотипу у 21,4 % випадків серед хворих I групи та у 15,4 % спостережень у дітей із НХЗ бронхів. При цьому генотипі у дітей із НХЗ визначалась більш виражена бронхомоторна реакція бронхів на інгаляцію сальбутамолу. Так, ІБД у цих пацієнтів становив у середньому 33 %, у I групі — 13,8 % і у III групі порівняння — 13,6 % (Р II, I : III < 0,05).
У дітей із генотипом T1delM1+ тяжкий перебіг БА у I групі визначався у 37,5 % випадків, у II — у 50,0 % та у III групі — у 100 % спостережень (Р III : I, II < 0,05). У хворих за вказаного генотипу та НХЗ частіше визначались супутні атопічні захворювання. Так, ознаки алергічного риніту та атопічного дерматиту проявлялись у них відповідно у 75,0 і 50,0 % випадків, у I групі — у 12,5 і 50 % спостережень (Р < 0,05). У пацієнтів із ПХЗ дихальних шляхів ознаки вказаних захворювань не відмічались. Водночас варто відзначити, що такі показники патологічного процесу при БА, як уміст у крові загального IgE, метаболітів монооксиду нітрогену у КПВ і лабільність бронхів (ІЛБ), при даному генотипі виявилися більш вираженими у хворих із ЕХЗ. У таких дітей вказані критерії захворювання відповідно становили 905,8 МО/мл, 63,1 мкмоль/мл і 26,8 %. У пацієнтів із НХЗ бронхів наведені додаткові діагностичні критерії відповідали 578,6 МО/мл, 44,4 мкмоль/мл і 19,2 %. У дітей із ПХЗ дихальних шляхів вказані лабораторні показники відповідно становили 392,3 МО/мл, 45,8 мкмоль/мл і 13,6 %.
Таким чином, у хворих на БА шкільного віку з гетерогенним характером запалення дихальних шляхів залежно від делеційного поліморфізму генів GSTM1, GSTT1 та їх комбінацій виявлені суттєві розбіжності в таких клінічних проявах, як тяжкість патології, шкірна чутливість негайного типу до небактеріальних алергенів та частота наявності супутніх алергічних захворювань. При цьому такі лабораторно-інструментальні характеристики захворювання, як реактивність бронхів, вміст у сироватці крові загального IgE, а в конденсаті видихуваного повітря — метаболітів монооксиду нітрогену, у групах порівняння суттєво не відрізнялися.
Висновки
1. У хворих на бронхіальну астму гомозиготна делеція гена GSTT1 визначалася в кожної п’ятої дитини незалежно від характеру запалення бронхів. У хворих з еозинофільним субтипом запалення бронхів вказана делеція гена GSTМ1 відмічена у 32,6 % випадків, при нейтрофільному — у 51,1 % та пауцигранулоцитарному — у 21,7 % спостережень.
2. У дітей із генотипом GSTT1del та еозинофільним характером запалення бронхів супутній атопічний дерматит траплявся рідше, ніж у хворих груп порівняння, хоча рівень загального IgE у сироватці крові в них був вищий, ніж у пацієнтів з іншими субтипами запалення. У хворих із генотипом GSTМ1del та пауцигранулоцитарним запаленням бронхів визначалася більш виражена гіперреактивність бронхів до гістаміну в поєднанні з високим рівнем умісту метаболітів монооксиду нітрогена в конденсаті повітря, що видихається.
3. Тяжка форма бронхіальної астми у хворих із генотипом GSTT1del/ GSTМ1 визначалася у всіх дітей за пауцигранулоцитарного запалення бронхів, у кожного другого хворого — за нейтрофільного типу запалення та у 37,5 % випадків — при еозинофільному запаленні дихальних шляхів.
1. A large subgroup of mild-to-moderate asthma is persistently noneosinophilic / K.W. McGrath, N. Icitovic, H.A. Boushey [et al.] // Am. J. Respir. Crit. Care Med. — 2012. — Vol. 13 (6). — P. 612-619.
2. A Large-Scale, Consortium-Based Genomewide Association Study of Asthma / M.F. Moffatt, D. Phil, I.G. Gut [et al.] // N. Engl. J. Med. — 2010. — Vol. 363. — P. 1211-1221.
3. Associations between postnatal weight gain, change in postnatal pulmonary function, formula feeding and early asthma / S. Turner, G. Zhang, S. Young [et al.] // Thorax. — 2008. — Vol. 63. — P. 234-239.
4. Asthma management by monitoring sputum neutrophil count / S. Pallan, J.B. Mahony, P.M. O’Byrne [et al.] // Chest. — 2008. — Vol. 134. — P. 628-630.
5. Distribution of sputum cellular phenotype in a large asthma cohort: predicting factors for eosinophilic vs neutrophilic inflammation / F.N. Schleich, M. Manise, J. Sele [et al.] // BMC Pulm. Med. — 2013. — Vol. 13. — P. 11.
6. Douwes J. Non-eozinophilic asthma: importance and possible mechanisms / J. Douwes, P. Gibson, J. Pekkanen // Thorax. — 2007. — Vol. 57. — P. 643-648.
7. Effects of steroid therapy on inflammatory cell subtypes in asthma / D.C. Cowan, J.O. Cowan, R. Palmay [et al.] // Thorax. — 2010. — Vol. 65. — P. 384-390.
8. Haldar P. Noneosinophilic asthma: a distinct clinical and pathologic phenotype / P. Haldar, I.D. Pavord // J. Allergy Clin. Immunol. — 2007. — Vol. 119 (5). — P. 1043-1052.
9. Inflammatory subtypes in asthma: assessment and identification using induced sputum / J.L. Simpson, R. Scott, M.J. Boyle [et al.] // Respirology. — 2006. — Vol. 11. — P. 54-61.
10. Lovett C.J. Asthma inflammatory phenotypes in kids. Eosinophilic airway inflammation and the prognosis of childhood asthma / C.J. Lovett, B.F. Whitehead, P.G. Gibson // Clin. Exp. Allergy. — 2007. — Vol. 37. — P. 1594-1601.
11. Saadat M. Genetic polimorfisms of glutathione S-transferase T1, M1 and asthma, a meta-analysis of the literature (abstract) / M. Saadat // J. Biol. Sci. — 2007. — Vol. 10. — P. 4183-4189.
12. Sputum induction in severe exacerbations of asthma: safety of a modified method / M.O. Vieira, E. Pizzichini, L.J. Steidle [et al.] // Eur. Respir. J. — 2011. — Vol. 38 (4). — P. 979-980.
13. Sputum inflammatory phenotypes are not stable in children whith asthma / L. Fleming, L. Tsartsali, N. Wilson [et al.] // Thorax. — 2012. — Vol. 67 (8). — P. 675-681.

/47/47.jpg)