Международный неврологический журнал 4 (66) 2014
Вернуться к номеру
Связанные с событием вызванные потенциалы мозга у пациентов с непсихотическими психическими расстройствами вследствие частичной потери зрения травматического генеза
Авторы: Чабан О.С., Абдряхимова Ц.Б. - Украинский НИИ социальной и судебной психиатрии и наркологии МЗ Украины, г. Киев; Снегирь А.Г., Ивнев Б.Б. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Эндокринология, Психиатрия
Разделы: Клинические исследования
Версия для печати
Процесс частичной утраты зрения сопровождается негативными психопатологическими проявлениями, обусловленными дополнительным отягчающим влиянием посттравматического стресса на состояние психического здоровья человека. При прохождении пациентами МСЭК было проведено углубленное клинико-психопатологическое обследование 400 пациентов, в результате которого были сформированы две группы исследования: основная — 200 больных, у которых после травматического события, вызвавшего частичную потерю зрения, были диагностированы непсихотические психические расстройства, и группа сравнения — 200 человек, психическое состояние которых соответствовало так называемой условной норме. Субъективную оценку имеющихся клинико-психопатологических проявлений осуществляли с помощью опросника депрессии А.Т. Бека, методики диагностики самооценки реактивной и личностной тревожности Ч.Д. Спилбергера — Ю.Л. Ханина. Анализ объективных проявлений психопатологической симптоматики проводили с использованием клинических рейтинговых шкал депрессии и тревоги Гамильтона — НDRS и НАRS. В результате исследования выявлены характерные показатели связанных с событием слуховых вызванных потенциалов у больных с посттравматическим стрессовым расстройством. Время и корректность сенсомоторной реакции в исследуемых группах не отличались. Найдены достоверные корреляционные связи показателей слуховых вызванных потенциалов и показателей выраженности клинико-психопатологической симптоматики. Авторы предполагают участие адренергических структур неспецифических систем мозга, а также серотонинергических нейронов ядер шва в изменении паттерна вызванной электрической активности мозга.
Процес часткової втрати зору супроводжується негативними психопатологічними проявами, обумовленими додатковим обтяжливим впливом посттравматичного стресу на стан психічного здоров’я людини. При проходженні пацієнтами МСЕК було проведено поглиблене клініко-психопатологічне обстеження 400 пацієнтів, у результаті якого були сформовані дві групи дослідження: основна — 200 хворих, у яких після травматичної події, що викликала часткову втрату зору, було діагностовано непсихотичні психічні розлади, і група порівняння — 200 осіб, психічний стан яких відповідав так званій умовній нормі. Суб’єктивну оцінку наявних клініко-психопатологічних проявів здійснювали за допомогою опитувальника депресії А.Т. Бека, методики діагностики самооцінки реактивної й особистісної тривожності Ч.Д. Спілбергера — Ю.Л. Ханіна. Аналіз об’єктивних проявів психопатологічної симптоматики проводили з використанням клінічних рейтингових шкал депресії й тривоги Гамільтона — НDRS і НАRS. У результаті дослідження виявлені характерні показники пов’язаних із подією слухових викликаних потенціалів у хворих із посттравматичним стресовим розладом. Час і коректність сенсомоторної реакції в досліджуваних групах не відрізнялися. Знайдено вірогідні кореляційні зв’язки показників слухових викликаних потенціалів і показників вираженості клініко-психопатологічної симптоматики. Автори припускають участь адренергічних структур неспецифічних систем мозку, а також серотонінергічних нейронів ядер шва в зміні патерну викликаної електричної активності мозку.
Process of partial vision loss is accompanied by the negative psychopathological manifestations caused by additional aggravating influence of a post-traumatic stress on a mental health of the person. In-depth clinicopsychopathological examination of 400 patients was carried out during medical and social assessment. As a result, two study groups were created: main one — 200 patients who after a traumatic event that caused the partial vision loss were diagnosed with non-psychotic mental disorders, and comparison group — 200 persons, the mental state of which corresponded to the so-called conditional norm. Subjective evaluation of available clinical and psychopathological symptoms was performed using a depression questionnaire of A.T. Beck, a technique of diagnostics of a self-assessment of reactive and personal anxiety by Ch.D. Spielberger — Yu.L. Khanin. Analysis of the objective manifestations of psychopathological symptoms was performed using clinical Hamilton anxiety and depression rating scales — HDRS and HARS. The study revealed the characteristic indicators of event-related auditory evoked potentials in patients with post-traumatic stress disorder. Time and accuracy of the sensorimotor reaction in study groups did not differ. We have found significant correlations of auditory evoked potentials indicators and indicators of clinical-psychopathological symptoms severity. The authors suggest the participation of adrenergic structures of nonspecific brain systems, as well as raphe nuclei in the change of brain electrical activity pattern.
частичная потеря зрения травматического генеза, непсихотические психические расстройства, сенсорные системы, травма, связанные с событием слуховые вызванные потенциалы мозга, сенсомоторная реакция.
часткова втрата зору травматичного генезу, непсихотичні психічні розлади, сенсорні системи, травма, пов’язані з подією слухові викликані потенціали мозку, сенсомоторна реакція.
partial vision loss of traumatic origin, non-psychotic mental disorders, sensor systems, trauma, event-related auditory evoked brain potentials, sensorimotor reaction.
Статья опубликована на с. 96-102
Потеря зрения во взрослом возрасте сопровождается эмоциональными и социальными последствиями, влияющими не только на психофизиологическое состояние самого индивида, но и на его взаимодействие с семьей и обществом [1]. В случае травматического генеза этот процесс сопровождается негативными психопатологическими проявлениями, обусловленными дополнительным отягчающим влиянием посттравматического стресса на состояние психического здоровья человека [2–6].
Однако, несмотря на несомненную актуальность проблемы, психические нарушения у больных с офтальмопатологией, в частности с частичной потерей зрения травматического генеза (ЧПЗТГ), изучены недостаточно. В литературе встречаются единичные сведения о пограничных психических расстройствах у слепых и пациентов со значительным снижением зрения, представленных в основном невротическими или неврозоподобными состояниями с выраженным астеническим синдромом, раздражительностью, головной болью, головокружением [2–6]. Частичная потеря зрения приводит к снижению мобильности и свободы человека, уменьшению объема получаемой информации. Кроме того, некоторые исследователи отмечают возникновение когнитивного дефицита вследствие снижения памяти, внимания и мышления, что дополнительно ограничивает возможности труда и межличностного взаимодействия [2–6].
Между тем, несмотря на актуальность изложенного, в настоящее время в психиатрическом научном пространстве и реальной клинической практике отсутствуют исследования, направленные на изучение предикторов, механизмов развития непсихотических психических расстройств у лиц, частично утративших зрение вследствие травмы. Как следствие, не разработана действенная система диагностики и лечения данных расстройств, конечной целью которой было бы улучшение качества жизни и адаптация пациентов к имеющемуся уровню функционирования.
Материал и методы
На протяжении 2010–2013 гг. на базе отделения травмы глаза, а также кабинета ургентной помощи травмы глаза НИИ травматологии и ортопедии Донецкого национального медицинского университета им. М. Горького с соблюдением принципов биоэтики и деонтологии путем случайного выбора в период после офтальмологического вмешательства и определения объема и прогноза относительно потери зрения нами проведено скрининговое обследование 600 человек с ЧПЗТГ. У всех пациентов были зафиксированы проявления острой стрессовой реакции.
В течение одного–трех месяцев после выписки из стационара при прохождении пациентами МСЭК нами было проведено углубленное клинико–психопатологическое обследование 400 пациентов из числа обследованных ранее, в результате которого были сформированы две группы исследования: основная (ОГ) — 200 больных, у которых после травматического события, вызвавшего частичную потерю зрения, были диагностированы непсихотические психические расстройства (НПР), и группа сравнения (ГС) — 200 человек, психическое состояние которых соответствовало так называемой условной норме.
Критериями исключения из исследования были: отсутствие информированного согласия, наличие в анамнезе психических и поведенческих расстройств, наличие выраженных соматических заболеваний, течение которых может повлиять на психическое состояние пациента.
Клинико–психопатологическое исследование проводилось путем углубленного клинического стандартизированного интервью с использованием диагностических критериев МКБ-10. Субъективную оценку имеющихся клинико-психопатологических проявлений осуществляли с помощью опросника депрессии (Дс) А.Т. Бека [7], методики диагностики самооценки реактивной (РТ) и личностной (ЛТ) тревожности Ч.Д. Спилбергера — Ю.Л. Ханина [8]. Анализ объективных проявлений психопатологической симптоматики проводили с использованием клинических рейтинговых шкал депрессии (До) и тревоги (То) Гамильтона — НDRS и НАRS [9].
Нозологическая структура диагностированных НПР была представлена психическими и поведенческими расстройствами кластера F43 — «реакция на стресс и адаптационные расстройства», среди которых доминировала смешанная тревожно-депрессивная реакция F43.22 (97 человек, 48,5 % ОГ); примерно у трети пациентов были диагностированы: пролонгированная депрессивная реакция F43.21 (44 человека, 22 % ОГ), адаптационные расстройства с преобладанием нарушения других эмоций F43.23 (29 человек, 14,5 % ОГ); у 23 (11,5 %) больных выявлено посттравматическое стрессовое расстройство F43.1, а у 7 (3,5 %) пациентов — адаптационное расстройство со смешанным нарушением эмоций и поведения F43.25.
С целью выявления нейрофизиологических механизмов развития НПР вследствие ЧПЗТГ, а также для определения электрофизиологических маркеров исследуемой патологии из ОГ и ГС методом рандомизированного отбора было выбрано по 20 человек — мужчин в возрасте 22 до 57 лет.
Исследования электрической активности мозга испытуемых проводилась на базе научно-исследовательской лаборатории кафедры физиологии Донецкого национального медицинского университета им. М. Горького. Электрофизиологические исследования проводились при помощи диагностического комплекса Amplaid MK15 (Италия).
Для исследования электрической активности мозга использовали метод связанных с событием вызванных потенциалов (ССП). Принимая во внимание особенность испытуемых основной группы, которые имели нарушения функции зрительного анализатора, использовали ССП слуховой модальности. Продолжительность регистрации ССП, включая монтаж электродов, инструктаж и собственно тестирование, не превышала 45 минут.
Испытуемому бинаурально предъявлялась серия стимулов в псевдослучайной (с заранее заданной вероятностью появления значимых стимулов) последовательности — oddball-парадигма. Значимый стимул — тон с частотой 4000 Гц предъявлялся с вероятностью 20 %, фоновый стимул — тон с частотой 1000 Гц предъявлялся с вероятностью 80 %. Интенсивность звуков составляла 100 дБ над порогом слышимости [10]. Интервал между стимулами составлял 2 с. Испытуемый инструктировался реагировать на появление значимого сигнала нажатием на кнопку, фоновые стимулы игнорировались. При нажатии на кнопку происходила регистрация вызванной электрической активности мозга, а также времени и корректности простой сенсомоторной реакции.
Регистрация ССП осуществлялась с поверхности головы стандартными электроэнцефалографическими электродами, расположенными по системе 10/20 (Jasper) в точках: Cz — активный электрод, A1 + A2 — общий референтный электрод, Fpz — заземляющий электрод. Импеданс не превышал 50 Ом. Эпоха анализа составляла 750 мс, а полоса пропускания усилителя при записи ССП — от 0,1 до 50 Гц. Усреднение вызванного потенциала проводилось по 100 записям [11]. Устранение артефактов, в том числе и артефактов движения глаз, было аппаратным. На кривой ССП, зарегистрированной на значимый стимул, выделяли компоненты P1, N1, P2, N2, P3 (рис. 1). Позитивный компонент в диапазоне латентных периодов от 30 до 80 мс расценивался как P1, негативный от 80 до 140 мс — N1, позитивный компонент P2 дифференцировали во временном диапазоне 120–200 мс, N2 — между 180 и 320 мс от начала развертки, поздний положительный компонент P3 выявляли в диапазоне 270–550 мс.
Для статистической обработки полученных экспериментальных результатов использовался пакет статистических программ Statistica 5.5 (StatSoft, США). При проверке статистических гипотез достоверными считались значения критериев с уровнем значимости p < 0,05. Сравнительный анализ проводили методами непараметрической статистики: Т-критерий Вилкоксона и U-критерий Манна — Уитни, а корреляционный анализ — по методу Пирсона и Спирмена [12, 13].
Результаты и обсуждение
Клинико–психопатологическое и психодиагностическое исследование
В основной группе значения РТ были высокими (47–62 баллов), ЛТ — средними и высокими (42–51), Дс — на уровне субдепрессии и депрессии (15–23), До — от отсутствия до сильно выраженной депрессии (16–27), а значения То — средними и высокими (10–23). В группе сравнения значения РТ были от низких до средних (28–39), ЛТ — низкими (16–30), Дс — от полного отсутствия до субдепрессии (9–14), До — отсутствие депрессии (7–10), То — также отсутствие депрессии (5–7). Средние значения всех показателей клинико–психопатологического тестирования: РТ, ЛТ, Дс, До и То — в основной группе достоверно (p < 0,05) превышают их значения в группе сравнения (рис. 2).
Связанные с событием вызванные потенциалы
Сравнительный анализ времени и результативности сенсомоторной реакции не выявил достоверных различий в группах: в основной группе — 330,40 ± 31,37 мс (Mean ± SD) с результативностью 93,70 ± 4,83 %, в группе сравнения — 333,00 ± 19,62 мс и 93,10 ± 4,38 % соответственно. Показатели латентных периодов ССП в сравниваемых группах были отличны. Достоверные отличия были выявлены для пиковых значений латентных периодов положительных компонентов P1, P2, P3, а также межпиковых интервалов P1N1 и N2P3. Латентный период раннего позитивного компонента P1 в основной группе (65,30 ± 14,84 мс) был достоверно больше, чем в группе сравнения (47,80 ± 1,82 мс, U = 35, p < 0,05). Для поздних компонентов P2 и P3 отмечались обратные зависимости — пиковые значения их латентных периодов были меньше, чем в группе сравнения. Так, значения латентных периодов P2 в основной группе составляли 158,80 ± 14,28 мс, а в группе сравнения — 165,70 ± 11,49 мс (U = 140,5, p < 0,05); P3 в основной группе — 316,90 ± 21,90 мс, а в группе сравнения — 553,80 ± 27,93 мс (U = 71,5, p < 0,05). Межпиковые интервалы раннего комплекса P1N1 (36,10 ± 14,93 мс) и позднего комплекса N2P3 (108,20 ± 23,22 мс) в основной группе были достоверно короче, чем в группе сравнения, в которой они составляли 54,00 ± 7,39 мс (U = 72,5, p < 0,05) для P1N1 и 150,90 ± 33,36 мс (U = 71,5, p < 0,05) — для комплекса N2P3. Практически все компоненты ССП, за исключением, пожалуй, только поздней негативной волны N4, имеют более положительные значения амплитуд в основной группе по отношению к группе сравнения. Эта тенденция имеет характер низкочастотной положительной по знаку модуляции с периодом порядка 400–500 мс (≈ 2 Гц) (рис. 1). Таким образом, амплитуда компонента P1 в основной группе (1,740 ± 5,106 мкВ) имеет более положительные значения, чем P1 в группе сравнения (–6,560 ± 5,862 мкВ, U = 62,5, p < 0,05), значения амплитуды N1 (–3,830 ± 4,434 мкВ) — более положительные, чем в группе сравнения (–12,690 ± 4,133 мкВ, U = 35,0, p < 0,05). Комплекс поздних волн ССП: Р2 с амплитудой в основной группе (2,320 ± 3,486 мкВ) и в группе сравнения (–4,46 ± 4,77 мкВ, U = 54,0, p < 0,05), N2 в основной группе (–3,850 ± 1,919 мкВ) и в группе сравнения (–9,150 ± 3,571 мкВ, U = 69,0, p < 0,05), P3 в основной группе (12,310 ± 2,695 мкВ) и в группе сравнения (8,390 ± 3,825 мкВ, U = 66,0, p < 0,05).
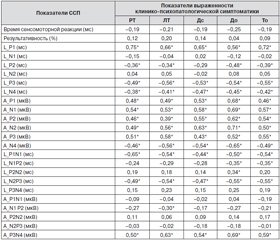
Для выявления возможных ассоциаций между наличием и выраженностью клинико-психопатологических проявлений с электрофизиологическими показателями был проведен корреляционный анализ (табл. 1).
Наиболее сильные ассоциации на уровне высокой (от 0,7 до 0,99) и средней (от 0,5 до 0,69) степени взаимосвязи [14] отмечались для значений латентного периода раннего компонента P1. Причем наиболее высокие значения коэффициентов корреляции отмечались для показателей РТ (Rsp = = 0,75, p < 0,05) и То (Rsp = 0,72, p < 0,05). Остальные показатели клинико–психологического тестирования имели среднюю степень взаимосвязи: ЛТ (Rsp = 0,66, p < 0,05), Дс (Rsp = 0,65 p < 0,05) и До (Rsp = 0,56, p < 0,05). Примечательно, что амплитуда компонента P1 также имела достоверные корреляции со всеми показателями психологического тестирования на среднем уровне взаимосвязи: от 0,53 до 0,69. Следует отметить, что амплитуды всех компонентов ССП демонстрировали статистически значимые корреляции с индексами тестирования на уровне от 0,39 до 0,71 (последний коэффициент корреляции отражает связь показателя До и амплитуды компонента ССП N2). Примечательно, что это именно амплитуды компонентов ССП, а не размах амплитуд, что указывает на значимость выявленной ранее амплитудной модуляции компонентов ССП низкочастотным позитивным смещением у испытуемых основной группы. Помимо латентного периода компонента P1 значимые связи со всеми показателями психологического тестирования были выявлены для латентного периода компонента P3 и межпикового интервала N2P3. Для P3 эта связь была на уровне от –0,49 до –0,56, а для интервала N2P3 — от –0,47 до –0,55.
ССП отражают все этапы мозговой деятельности от момента восприятия сигнала до сенсомоторной реакции на предъявляемый значимый сигнал [15]. Латентный период компонента P1 в основной группе был достоверно выше, чем в контрольной группе, что может свидетельствовать о снижении эффективности физиологических механизмов ранней перцепции, обусловленной автоматическими механизмами селективного внимания [16]. Согласно литературным данным [17], в генерации этого компонента принимает участие ретикулярная формация ствола мозга с вовлечением холинергических медиаторных систем [18]. Более поздние компоненты и комплексы ССП, такие как P2, N2P3 и P3, имеют достоверно меньшие латентные периоды, чем в группе сравнения, что можно рассматривать как компенсацию дефекта ранних этапов восприятия сенсорного сигнала. Вероятно, этот механизм обеспечил нормальную скорость сенсомоторной реакции, время которой не имело достоверных отличий в исследуемых группах. Следует отметить, что поздние компоненты ССП являются электрофизиологическими коррелятами сознательных реакций на значимый стимул. Так, компонент P2, имея множественные корковые и подкорковые генераторы, отражает процесс сознательного выявления дискретных изменений каких-либо параметров звуковых стимулов [19, 20]. Имеются указания на участие в генерации этого компонента неспецифических серотонинергических систем мозга, модулирующих активность первичной слуховой коры [21]. Компонент N2 регистрируется только на целевые стимулы и является первым маркером распознания цели. Его генераторы локализованы в лобных и передних височных областях коры больших полушарий, которые активируются в процессе избирательного внимания и/или представления целевого стимула [22]. Поздний позитивный компонент ССП P3 (или P300) имеет множественные источники генерации [23, 24]. Согласно 7-компонентной теории волны P300 [25], три субкомпонента, генераторы которых расположены в медиальной фронтальной, левой париетально-окципитальной и правой центрально-фронтальной зоне коры больших полушарий, связывают с детекцией новизны. Генератор четвертого субкомпонента, который находится в левых центральных областях коры, связывают с механизмами принятия решения, а остальные три связаны с процессом опознания стимула.
Особое внимание следует уделить эффекту амплитудной модуляции ССП в основной группе, которая затронула как ранние, как и поздние компоненты (включая волну Р300) (рис. 1). Этот феномен требует дальнейшего изучения, однако уже сейчас возможно предположить, что подобная модуляция обусловлена влиянием неспецифических систем мозга аналогично эффекту рrocessing negativity, который регистрируется при активации механизмов внимания к актуальной на данный момент сенсорной информации [26]. В генерации этого феномена принимают участие адренергические структуры неспецифических систем мозга [27]. Нельзя исключать возможность вовлечения в этот фазический процесс серотонинергических нейронов ядер шва, ответственных за генерацию низкочастотных ЭЭГ–ритмов во время фазы глубокого сна. Особенно это актуально на фоне современных исследований медиаторных систем мозга, которые показали сложный характер взаимодействия кортикостероидов — гормонов стресса с центральными серотонинергическими системами [28, 29].
Выводы
1. Выявлены показатели акустических ССП у больных с посттравматическим стрессовым расстройством, отличающие их от группы сравнения.
2. Показатели времени и корректности сенсомоторной реакции в исследуемых группах не отличались.
3. Найдены достоверные корреляционные связи показателей ССП и показателей выраженности клинико-психопатологической симптоматики.
4. Обсуждены возможные нейрофизиологические механизмы выявленных изменений вызванной электрической активности мозга в исследуемых группах.
1. Loprinzi P.D. Association Among Depression, Physical Functioning, and Hearing and Vision Impairment in Adults With Diabetes / P.D. Loprinzi, E. Smit, G. Pariser // Diabetes Spectrum. — Winter 2013. — Vol. 26, № 1. — Р. 6–15.
2. Blindness, Fear of Sight Loss, and Suicide / D. De Leo, P.A. Hickey, G. Meneghel, C.H. Cantor // Psychosomatics. — 1999. — Vol. 40. — P. 339–344.
3. Blindness and High Suicide Risk? / T.J. Hine, N.J. Pitchford, F.A.A. Kingdom, R. Koenekoop // Psychosomatics. — 2000. — Vol. 41, Issue 4. — Р. 370–371.
4. Du Feu M. Sensory impairment and mental health / M. du Feu, K. Fergusson // Advances in Psychiatric Treatment. — 2003. — Vol. 9. — Р. 95–103.
5. Thurston Mh. An inquiry into the emotional impact of sight loss and the counselling experiences and needs of blind and partially sighted people / Mh. Thurston // Counselling and Psychotherapy Research: Linking research with practice. — 2010. — Vol. 10, Issue 1. — Р. 3–12.
6. Vision–Specific Distress and Depressive Symptoms in People with Vision Impairment / G. Rees, H.W. Tee, M. Marella [et al.] // Invest. Ophthalmol. Vis. Sci. — June 2010. — Vol. 51, № 6. — Р. 2891–2896.
7. An Inventory for Measuring Depression / А.Т. Beck, C.H. Ward, M. Mendelson, J. Mock, J. Erbaugh // Archives of General Psychiatry. — 1961. — Vol. 4, June. — Р. 8–18.
8. Райгородский Д.Я. Практическая психодиагностика. Методики и тесты / Райгородский Д.Я. — Самара: Бахрах, 2002. — 668 с.
9. Подкорытов В.С. Депрессии (современная терапия) / В.С. Подкорытов, Ю.Ю. Чайка. — Харьков: Торнадо, 2003. — 350 с.
10. Goodin D., Desmedt J., Maurer K., Nuwer M.R. IFCN recommended standards for longlatency auditory eventrelated potentials // Electroencephalogr. Clin. Neurophysiol. — 1994. — Vol. 91. — P. 18–20.
11. Polich J., Ellerson P.C., Cohen J. P300, stimulus intensity, modality, and probability // Int. J. Psychophysiol. — 1996. — Vol. 23. — № 1–2. — P. 55–62.
12. Кендал М., Стюарт А. Статистические выводы и связи. — М.: Наука, 1973. — 734 с.
13. Боровиков В.П., Боровиков И.П. STATISTICA. Статистический анализ и обработка данных в среде Windows. — М.: Информационно-издательский дом «Филин», 1997. — 608 с.
14. Гланц С. Медико–биологическая статистика: Пер. с англ. — М.: Практика, 1998. — 459 с.
15. Гнездицкий В.В. Вызванные потенциалы мозга в клинической практике. — Таганрог: Изд–во ТРТУ, 1997. — 252 с.
16. Schnyer D.M., Allen J.J. Attention-related electroencephalographic and event–related potential predictors of responsiveness to suggested posthypnotic amnesia // Int. J. Clin. Exp. Hypn. — 1995. — Vol. 43, № 3. — P. 295–315.
17. Green J.B., Burba A., Freed D.M. et al. The P1 component of the middle latency auditory potential may differentiate a brainstem subgroup of Alzheimer disease // Alzheimer Dis. Assoc. Disord. — 1997. — Vol. 11, № 3. — P. 153–157.
18. Bushwald J.S., Rubinstein E.N., Schwafel J., Strandburg R.J. Midlatency auditory evoked responses: differential effects of cholinergic agonist and antagonist // EEG and Clin. Neurophysiol. — 1991. — Vol. 80, № 4. — P. 303–312.
19. Hyde M. The N1 response and its applications // Audiol. Neurootol. — 1997. — Vol. 2, № 5. — P. 281–307.
20. Uhlén I.T., Borg E., Persson H.E., Spens K.E. Topography of auditory evoked cortical potentials in children with severe language impairment: the N1 component // Electroencephalogr. Clin. Neurophysiol. — 1996. — Vol. 100, № 3. — P. 250–260.
21. Juckel G., Molnár M., Hegerl U. et al Auditory-evoked potentials as indicator of brain serotonergic activity — first evidence in behaving cats // Biol. Psychiatry. — 1997. — Vol. 41, № 12. — P. 1181–1195.
22. Potts G.F., Dien J., Hartry–Speiser A.L. et al. Dense sensor array topography of the event-related potential to task-relevant auditory stimuli // Electroencephalogr. Clin. Neurophysiol. — 1998. — Vol. 106, № 5. — P. 444–456.
23. Glabus M.F., Blackwood D.H., Ebmeier K.P. et al. Metho–dological considerations in measurement of the P300 component of the auditory oddball ERP in schizophrenia // Electroencephalogr. Clin. Neurophysiol. — 1994. — Vol. 90, № 2. — P. 123–134.
24. Костандов Э.А., Захарова Н.Н., Концевой В.А., Медведев А.В. Особенности когнитивного дефицита у больных с различными вариантами позднего параноида // Журнал неврологии и психиатрии им. Корсакова. — 1995. — Т. 95, № 1. — С. 64–71.
25. Makeig S., Westerfield M., Jung T.–P. et al. Functionally Independent Components of the Late Positive Event-Related Potential during Visual Spatial Attention // J. Neuroscience. — 1999. — Vol. 19, № 7. — P. 2665–2680.
26. Shelley A.M., Catts S.V., Ward P.B. et al. The effect of decreased catecholamine transmission on ERP indices of selective attention // Neuropsychopharmacology. — 1997. — Vol. 16, № 3. — P. 202–210.
27. Shelley A.M., Catts S.V., Ward P.B. et al. The effect of decreased catecholamine transmission on ERP indices of selective attention // Neuropsychopharmacology. — 1997. — Vol. 16, № 3. — P. 202–210.
28. Joels M., Hesen W., De Kloet E.R. Mineralocorticoid hormones suppress serotnin-induced hyperpolarization of rat hippocampal CA1 neurons // J. Neurosci. — 1991. — 11. — P. 2288–2294.
29. Karten Y.J., Nair S.N., Van Essen L. et al. Long-term exposure to high corticosterone levels attenuates serotonin responses in rat hippocampal CA1 neurons // Proc. Nat. Acad. Sci. USA. — 1999. — 93. — P. 13456–13461.

/98/98.jpg)
/99/99.jpg)