Международный неврологический журнал 4 (66) 2014
Вернуться к номеру
Инновационные возможности объективизации качества жизни пациентов с болезнью Паркинсона
Авторы: Карабань И.Н., Карасевич Н.В., Крицкая О.В., Чивликлий М.А., Мельник Н.А. - ГУ «Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины», г. Киев
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 7-15
Болезнь Паркинсона (БП), как хроническое, прогрессирующее заболевание центральной нервной системы (ЦНС), фатально вторгается в жизнь пациента и близких ему людей. Ухудшение качества повседневной жизни больного во всех сферах жизнедеятельности — профессиональной, семейно-бытовой, в сфере самообслуживания, а также изменение роли больного в семье и обществе, зависимость от окружающих его людей, изменение привычного уклада жизни — все это требует определенной психологической поддержки со стороны врача. Эта поддержка должна включать полную информацию о заболевании, позитивной возможности лекарственной терапии как средства фармакологического контроля за течением и прогнозом болезни [1].
Для осуществления программ комплексной реабилитации и лечения пациента с БП ключевую роль играет самооценка качества жизни. Известно, что основным инвалидизирующим фактором при БП является нарастающее нарушение двигательной активности и сопутствующие расстройства постуральных, когнитивных, эмоциональных, вегетативных функций, составляющие клинический блок так называемых немоторных нарушений [2–4].
Качество жизни больных с хроническими заболеваниями ЦНС, в том числе с БП, зависит не только от степени функционального дефекта, но и от субъективного восприятия и личностной реакции больных. Концепция внутренней картины болезни (ВКБ), разработанная выдающимся отечественным нейропсихологом А.Р. Лурия, как нельзя лучше подходит к характеристике качества жизни пациентов с БП [4]. А.Р. Лурия писал: «Внутренней картиной болезни я называю все то, что испытывает и переживает больной, всю массу его ощущений… весь тот огромный внутренний мир больного, который состоит из весьма сложных сочетаний восприятия и ощущения, эмоций, аффектов, конфликтов, психических переживаний и травм» [5].
Таким образом, на качество жизни пациентов с БП, помимо двигательных нарушений, оказывают влияние аффективные, когнитивные и другие немоторные нарушения, совокупность которых определяет внутреннюю картину заболевания и формирует тип отношения к болезни.
Базовыми инструментами при проведении исследования качества жизни являются специально разработанные опросники, которые, как правило, заполняются самими больными [6]. В связи с этим новый инструмент оценки функционального состояния пациента с БП — «Карта самочувствия пациента с болезнью Паркинсона»ТМ дает возможность оценить, как влияет ВКБ, формирующаяся у больных, на качество их жизни [15].
«Карта самочувствия пациента с болезнью Паркинсона» (Parkinson’s Well-Being Map, WBM), предназначенная для самооценки симптомов заболевания, впервые была представлена в апреле 2012 г. в Международный день болезни Паркинсона. Карта разработана компанией UCB Pharma совместно с Европейской ассоциацией по проблеме болезни Паркинсона (EPDA), Испанской федерацией болезни Паркинсона и фондом Cure Parkinson’s Trust (Великобритания) с учетом предложений и пожеланий пациентов и ухаживающих за ними лиц.
Инновация призвана помочь людям с БП в самооценке выраженности двигательных и немоторных симптомов заболевания для обсуждения своего состояния с врачами и медицинским персоналом, что способствует установлению более эффективного партнерства больного с лечащим врачом-неврологом.
Собираясь на прием к врачу, пациент и его родственники знают, о чем они будут говорить со специалистом, что беспокоит в большей степени. При заполнении карты пациент может точно зафиксировать изменения двигательной активности, связанные с приемом противопаркинсонических препаратов, что должно помочь клиницистам при подборе медикаментозного лечения и титровании доз.
Востребованность карты за прошедший год превысила все ожидания, тысячи пациентов и специалистов здравоохранения по всему миру уже используют этот инструмент. Карта на семи языках с подробной инструкцией по ее использованию находится в открытом доступе на образовательном сайте компании UCB Parkinson’s voices [7].
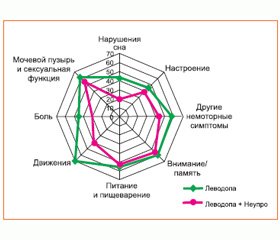
Главным преимуществом WBM является доступность и простота формулировок вопросов для самостоятельного заполнения пациентами и наглядное представление как для врача, так и для пациента динамики субъективных симптомов за определенный период наблюдения. Карта представляет собой круговую диаграмму, восемь разноцветных осей которой отображают основные симптомы БП: моторику, расстройства сна, поведения, памяти и внимания, пищеварения, мочеиспускания и сексуальной функции, боль и отдельные немоторные нарушения. Индивидуальный у каждого больного «портрет» субъективного состояния создается по мере ответов на вопросы о частоте и выраженности тех или иных симптомов, ограничивающих функциональную активность и влияющих на качество жизни. WBM помогает людям, живущим с БП, в наглядной динамичной форме обратить внимание на преобладающие симптомы в общей синдромологии болезни, а также проанализировать чувствительность к назначенному лечению.
Анализ WBM’s группы пациентов дал возможность выявить влияние на качество жизни людей, живущих с БП, таких осложнений леводопа–терапии, как флюктуации, а также немоторных проявлений в виде расстройств поведения, сна, слюнотечения, болевых ощущений, что отражает их негативное влияние на жизнедеятельность [8].
Цель исследования: определить информативность «Карты самочувствия пациента с БП» (WBM-PD8) и возможность ее использования для оценки динамики клинической симптоматики заболевания и эффективности патогенетической терапии.
В отделе клинической физиологии и патологии экстрапирамидной нервной системы ГУ «Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины» обследовано 158 пациентов с БП в возрасте от 45 до 79 лет (86 женщин, 72 мужчины) со стадией заболевания по Хен — Яру от 1,0 до 4,0 (в среднем 2,2 ± 1,1), длительностью заболевания от 2 до 16 лет (10,5 ± 4,7 года), с установленным диагнозом идиопатической БП согласно UK Brain Bank Criteria [9]. Количественная оценка клинической симптоматики БП определялась с помощью международной шкалы UPDRS (II и III часть), динамика повседневной активности — с использованием шкалы Schwab и England [10].
Количественная оценка характера и степени выраженности моторных, немоторных и фармакологических факторов, а также определение эффективности противопаркинсонической терапии агонистами дофаминергических рецепторов (DA-рецепторов) (ротиготин) проводилась с помощью «Карты самочувствия пациента с БП»ТМ согласно разработанной инструкции и после предварительного инструктажа пациента.
Обследованные пациенты с БП были разделены на две группы: I группа — не принимающие леводопасодержащие препараты (n = 64) и II группа — принимающие комплексную терапию с включением препаратов леводопы (n = 94). Гистограмма распределения пациентов обеих групп показывает преобладание у них 1,5–2,0 стадии заболевания с общим моторным показателем от 30 до 40 баллов (UPDRS, III часть) и равномерное распределение пациентов с начальной (оценка моторики до 30 баллов) и поздней стадией БП (оценка моторики свыше 40 баллов) (рис. 1, табл. 1).
/9/9.jpg)
При последующем комплексном анализе самооценки пациентами основных симптомов заболевания мы использовали условную ранжировку их на подгруппы с учетом сочетания стадийности течения БП с общим баллом моторной активности. Так, пациентов с моторной активностью ниже 30 баллов относили к начальной стадии БП (стадия I), от 31 до 40 баллов — к стадии средней тяжести (стадия II) и свыше 40 баллов — к более тяжелым стадиям (стадия III).
Установлено, что «Карта самочувствия пациента с БП» (WBM-PD8) является чрезвычайно чувствительным инструментом, объективизирующим клиническую симптоматику БП как для пациента, так и для курирующего врача. Проведенный последовательный анализ выраженности предложенных больным восьми основных признаков, влияющих на их повседневную активность, дает основание определить в целом качество жизни каждого пациента и составить общее представление о лимитирующих звеньях, определяющих индивидуальную картину течения заболевания в каждом конкретном случае.
Так, нарушение сна, как один из ведущих немоторных симптомов БП, в виде сложностей с засыпанием после пробуждения (см. пункт 3) было значительно выражено у пациентов на леводопном этапе лечения и доминировало у всех пациентов на всех стадиях течения болезни (рис. 2). К этому пациенты добавляли и такую характеристику своей дневной активности, как чувство утомляемости в течение дня, которое возникало вне зависимости от вида лечения (пункт 5).
Значительно влиял на повседневную жизнь пациентов и общий фон настроения, что представлено у всех пациентов в виде определения «Я чувствую себя несчастным» (пункт 3), «Я тревожен, напуган, испытываю панику» (пункт 4) и «Я подавлен» (пункт 5). Этот признак меньше беспокоит пациентов со II стадией процесса, что можно объяснить их социальной адаптацией к факту наличия заболевания и необходимостью постоянного приема препаратов. Однако в этих случаях достаточно представленной оказывается ангедония как определение «Я не получаю удовольствия от вещей, которые ранее радовали» (пункт 2) (рис. 3).
Неоднозначный акцент был сделан пациентами на такую позицию в WBM-PD8, как другие немоторные симптомы. Так, жалоба «У меня головокружение, когда встаю после лежания» (пункт 1) чаще беспокоила пациентов, принимающих леводопасодержащие препараты. Обращает на себя внимание значительная представленность в этой группе и таких симптомов вегетативной дисрегуляции, как изменение веса, не связанное с диетой (пункт 4), и повышенная потливость (пункт 5). Головокружением страдали преимущественно пациенты на начальных (I группа) и стадиях средней тяжести (II группа), в то время как изменение веса было свойственно пациентам на всех стадиях заболевания и вне зависимости от вида лекарственной терапии (рис. 4).
Различные нарушения внимания/памяти разной степени выраженности были свойственны всем пациентам, что соответствует известным представлениям о частоте этого симптома в общей клинической синдромологии БП [17, 18]. Это проявлялось в основном замедленностью речи (пункт 2), забывчивостью (пункт 3), сложностью с запоминанием имен, номеров, событий (пункт 4) и значительно преобладало у пациентов на леводопном этапе лечения, что соответствовало более выраженным стадиям болезни (рис. 5).
Отдельной оценки заслуживает такой немоторный синдром БП, как боль, которой отводится особое место в стpуктуре заболевания [11, 12]. Различные по качеству и сенсорной активности болевые ощущения оказались представленными преимущественно в виде определения «У меня болезненность и скованность конечностей в течение дня (пункт 2) и ночью» (пункт 3). Болезненные ощущения представлены у больных достаточно активно на всех стадиях БП в виде конкретных определений: «Я испытываю болезненные судороги (дискинезии) пальцев ног и рук, в щиколотках и запястьях, которые будят меня рано утром» (пункт 1), «У меня тяжелые головные боли» (пункт 7) и др., которые усиливались у пациентов на леводопном этапе лечения (рис. 6).
Отдельный раздел при анализе WBM-PD8 составляет качественная оценка больными каждого признака в карте с определением частоты симптомов по шкале от 0 до 4, при которой эти значения предлагается отразить как 0 = никогда, 1 = изредка, 2 = иногда, 3 = часто, 4 = постоянно. Частота представленности интенсивности отдельных симптомов БП (в проценте случаев) представлена на рис. 7–11. Здесь достаточно демонстративны отличия графических «портретов» в группах пациентов, находящихся на различных этапах лекарственной терапии. Так, в группе пациентов на леводопа-терапии почти никогда не встречаются случаи, в которых нет болевых ощущений, нарушений мочеиспускания, сексуальной функции, питания и пищеварения (красный цвет диаграммы (рис. 7)), в то время как у пациентов на начальных стадиях БП велик процент случаев, в которых нет болевых ощущений и нарушений настроения (зеленый цвет диаграммы). Оценка «иногда» и «часто» почти с одинаковой частотой встречается в группах больных, что может отражать клиническую конвергенцию моторных и немоторных симптомов на всех стадиях БП. Интенсивность симптомов БП с их оценкой «все время» (рис. 11) имеет резко выраженный акцент на частоту их проявлений в виде боли, нарушения двигательной активности, возможности полноценного питания и пищеварения, отодвигая на второй план такие немоторные симптомы, как память, настроение, нарушение сна и функции органов малого таза.
На следующем этапе исследований нам удалось определить информативность карты WBM-PD8 для оценки современной трансдермальной формы агониста DА-рецепторов ротиготина (Неупро) у пациентов с БП в виде монотерапии на начальных стадиях заболевания (группа А, n = 12) и в комплексной терапии в сочетании с леводопасодержащими препаратами (группа Б, n = 8). Известны роль и место агонистов DА-рецепторов в комплексной патогенетической терапии заболевания и преимущество трансдермальной формы введения препаратов перед традиционными таблетированными вариантами [13, 15]. Ротиготин рассматривают как специфический агонист дофаминовых рецепторов с преобладанием агонизма к D3-рецепторам над агонизмом к D2- и D1-рецепторам. По сравнению с дофамином ротиготин в 2600 раз сильнее в отношении D3-рецепторов и примерно в 20 раз сильнее остальных подтипов DА-рецепторов, в связи с чем высока вероятность более физиологического ответа базальных ганглиев на лечение ротиготином. Среди прочих рецепторов ротиготин продемонстрировал аффинность к b-адренергическим (2в) и серотониновым (5НТ1а) рецепторам [16].
Главное преимущество трансдермальной формы ротиготина (Неупро) состоит в транспорте препарата вне его взаимодействия с пищей и другими лекарственными средствами для перорального приема. Более того, фармакокинетика препарата предусматривает попадание действующего вещества в кровоток, минуя печень, что повышает приверженность больных к терапии. Психологически пластырь воспринимается легче, чем еще один таблетированный препарат, и не вызывает каких-либо неудобств. Пластырь наклеивается на кожу один раз в сутки, что значительно облегчает соблюдение режима терапии.
Профиль субъективной оценки симптомов у пациентов с БП до и после применения препарата Неупро в наших наблюдениях представлен на секторных диаграммах (рис. 12, 13). Препарат назначался методом титрования дозы от 2 до 8 мг в сутки согласно инструкции. Установлено значительное уменьшение под влиянием лечения частоты встречаемости болевых ощущений, улучшение двигательных функций, фона настроения у пациентов, получающих препарат в виде монотерапии (рис. 12). В группе Б, куда были определены пациенты, получавшие Неупро в сочетании с комплексной патогенетической терапии, включающей препараты, содержащие леводопу, явной положительной динамике были подвержены такие проявления БП, как движения (куда вошли феномен wearing-off, on-off и end-off-dose), а также болевые феномены и нарушения сна (рис. 13).
Таким образом, применение карты WBM-PD8 для оценки самочувствия пациентов с БП дает возможность считать ее высокоинформативным инструментом для оценки субъективного состояния больных в их повседневной жизни. WBM-PD8 может применяться в качестве объективного показателя качества жизни пациентов, определяя состояние внутренней картины заболевания и формирование типа индивидуального отношения к болезни в каждом конкретном случае.
/14/14_2.jpg)
Использование карты WBM-PD8 позволяет количественно оценить степень выраженности отдельных симптомов БП на разных стадиях клинического течения заболевания.
Применение карты WBM-PD8 в повседневной практике врача-невролога объективно отражает темп прогресса нейродегенеративного процесса при БП и эффективность комплексной патогенетической терапии.
1. Маньковский Н.Б., Карабань Н.В. Качество жизни больных болезнью Паркинсона // Журн. псих. и медпсихологии. — 2004. — № 2 (12). — С. 9–13.
2. Болезнь Паркинсона (этиология, патогенез, клиника, диагностика, лечение, профилактика) / Г.Н. Крыжановский, И.Н. Карабань, С.В. Магаева и др. — М.: Медицина, 2002. — 335 с.
3. Шток В.Н., Федорова Н.В. Болезнь Паркинсона // Экстрапирамидные расстройства: Руководство по диагностике и лечению / Под ред. В.Н. Штока, И.А. Ивановой-Смоленской, И.С. Левина. — М.: Медпресс-информ, 2002. — С. 87–124.
4. Лурия А.Р. и психология XXI века / Под ред. Т.В. Ахутиной, Ж.М. Глозмана. — M., 2003. — С. 114–121.
5. Левин О.С., Глозман Ж.М., Лычева Н.Ю. Внутренняя картина болезни у пациентов с болезнью Паркинсона // Экстрапирамидные расстройства вчера, сегодня, завтра / Под ред. О.С. Левина. — М., 2013. — С. 183–187.
6. Chaudhuri K.R., Martinez-Martin P., Brown R.G. et al. The metric properties of a novel non-–motor symptoms scale for Parkinson’s disease: results anunternational pilot study // Mov. Disord. — 2007. — 22. — 1901–11.
7. http://www.parkinsonsvoices.eu/well-being-map/uk.
8. В помощь клиницисту. Карта самочувствия пациента с болезнью Паркинсона. Parkinson’s Well-Being MapТМ // Здоров’я України. — 2013, март. — № 1 (24). — С. 38–39.
9. Hughes A.J. Diagnosis of idiopatic Parkinson’s disease: a clinico-pathоlogical study of 100 cases // J. Neurol. Neurosurg. Psychiatry. — 1992. — Vol. 55. — Р. 181–184.
10. Fahn S., Elton R.L. and members of the UPDRS Committee. Unified Parkinson’s disease rating scale // Recent developments in Parkinson’s disease / S. Fahn, C.D. Marsden, D. Calne, M. Goldstein (Eds). — Florham Park, NJ: Macmillam Healthcare Information, 1987. — Р. 153–163.
11. Rascol O., Negre-Pages L., Brefel-Courbon C. et al. Chronic pain and Parkinson’s disease // Non-Motor symptoms of Parkinson’s disease / Eds Chaudhuri K.R., Tolosa E., Scapira A., Poewe W. — Oxford Univ. Press, 2009. — Р. 287–296.
12. Tinazzi M., Del Vesco C., Fincati E. et al. Pain and motor complications in Parkinson’s disease // J. Neurol. Neurosurg. Psychiatry. — 2006. — 77. — Р. 822–825.
13. Scheller D. et al. The in vitro receptor profile of rotigotine: a new agent for the treatment of Parkinson’s disease // Naunyn-Schmiedeberg’s Arch. Pharmacol. — 2009. — 379. — 73–86.
14. Jrenkwalder C., Kies B., Rudsinska M. et al. Rotigotine Effects on Early Morning Motor Function and Sleep in Parkinson’s Disease: A Double-Blind, Randomized, Placebo-Controlled Study (RECOVER) // Mov. Disorders, n/a, doi: 10.1002/mds.23441.
15. LeWitt P.A., Lyons K.E., Pahwa R. Advanced Parkinson disease treated with rotigotine transdermal system: PREFER Study // Neurology. — 2007. — 68. — 1262–1267.
16. Aasland D., Marsh L., Schrag A. Neuropsychiatric Symptoms in Parkinson’s Disease // Mov. Disord. — 2009. — Vol. 24. — Р. 2175–2186.
17. Левин О.С., Батукаева Л.А., Смоленцева И.Г. Диагностика и лечение деменции при болезни Паркинсона // Журн. неврол. и психиатрии. — 2008. — № 6. — С. 85–91.

/9/9_2.jpg)
/10/10.jpg)
/11/11.jpg)
/13/13.jpg)
/14/14.jpg)