Журнал «Здоровье ребенка» 4 (55) 2014
Вернуться к номеру
Метаболічний синдром як основа розвитку неалкогольної жирової хвороби печінки в дітей з ожирінням
Авторы: Крючко Т.О., Пилипенко О.А., Несіна І.М. - ВДНЗ «Українська медична стоматологічна академія», м. Полтава
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Мета дослідження: визначення взаємозв’язку між наявністю й поширеністю основних компонентів метаболічного синдрому та розвитком неалкогольної жирової хвороби печінки (НАЖХП) у пацієнтів дитячого та підліткового віку.
Матеріали та методи. Обстежено 39 дітей віком від 7 до 17 років. Основну групу (n = 23) становили діти, у яких на фоні вираженого ожиріння було діагностовано НАЖХП, до групи порівняння ( n = 16) увійшли пацієнти з аліментарним ожирінням.
Результати. В обстежених дітей та підлітків із НАЖХП на фоні ожиріння найбільш поширеним компонентом метаболічного синдрому була інсулінорезистентність, що відмічалася в 56,5 % дітей, 43,5 % пацієнтів мали прояви артеріальної гіпертензії, дисліпідемія за рахунок зниження фракції загального холестерину ліпопротеїдів високої щільності відмічалася у 43,5 % випадків, гіпертригліцеридемія — у 34,7 %. Повна форма метаболічного синдрому з п’яти компонентів була виявлена майже в кожного четвертого пацієнта (24,5 %) із НАЖХП, у 31 % хворих відмічалася наявність чотирьох компонентів, усі інші діти (44,5 %) мали різні комбінації з двох-трьох компонентів метаболічного синдрому.
Цель исследования: определение взаимосвязи между наличием и распространенностью основных компонентов метаболического синдрома и развитием неалкогольной жировой болезни печени (НАЖБП) у пациентов детского и подросткового возраста.
Материалы и методы. Обследовано 39 детей в возрасте от 7 до 17 лет. Основную группу (n = 23) составили дети, у которых на фоне выраженного ожирения была диагностирована НАЖБП, в группу сравнения (n = 16) вошли пациенты с алиментарным ожирением.
Результаты. У обследованных детей и подростков с НАЖБП на фоне ожирения наиболее распространенным компонентом была инсулинорезистентность, которая отмечалась в 56,5 % детей, 43,5 % пациентов имели проявления артериальной гипертензии, дислипидемия за счет снижения фракции ХС ЛПВП отмечалась в 43,5 % случаев, гипертриглицеридемия — 34,7 %. Полная форма метаболического синдрома из пяти компонентов была обнаружена почти у каждого четвертого пациента (24,5 %) с НАЖБП, у 31 % больных отмечалось наличие четырех критериев, все остальные дети (44,5 %) имели разные комбинации из двух-трех компонентов.
The aim of the research: to determine the relationship between the presence and prevalence of major components of metabolic syndrome and the development of nonalcoholic fatty liver disease (NAFLD) in patients in childhood and adolescence.
Materials and methods. We examined 39 children aged from 7 to 17 years. The study group (n = 23) included children in whom NAFLD was diagnosed against the background of gross obesity, the comparison group (n = 16) included patients with alimentary obesity.
Results. In examined children and adolescents with NAFLD against obesity, insulin resistance was the most common component, it was observed in 56.5 % of children, 43.5 % of patients had evidence of hypertension, dyslipidemia due to lowered HDL fraction was observed in 43.5 % of cases, hypertriglyceridemia — in 34.7 %. The full form of the metabolic syndrome of the five components was found almost in every four patient (24.5 %) with NAFLD, 31 % of patients had four criteria, all other children (44.5 %) had different combinations of two or three components.
метаболічний синдром, неалкогольна жирова хвороба печінки, діти.
метаболический синдром, неалкогольная жировая болезнь печени, дети.
metabolic syndrome, nonalcoholic fatty liver disease, children.
Статья опубликована на с. 21-25
На сьогодні метаболічний синдром (МС) є однією з найактуальніших світових медико-соціальних проблем. Значна поширеність МС, його роль у розвитку коморбідних захворювань — цукрового діабету 2-го типу, артеріальної гіпертензії, дисліпідемії, атеросклерозу не викликає сумнівів і визначає інтенсивність наукових пошуків ключових ланок патогенезу, діагностики, профілактики та лікування даного синдрому [11]. Інтерес лікарів різних спеціальностей до симптомокомплексу, що отримав назву «метаболічний синдром», зростає в міру вивчення даного феномена. Багатьма науковими дослідженнями доведено, що фактори ризику, об’єднані в МС, значно поширені і їх поширеність зростає у всьому світі внаслідок збільшення численності людей з ожирінням та неправильним способом життя. Патогенез, клінічні прояви та принципи лікування МС залишаються предметом досліджень та дискусій у медичному науковому світі [4]. Серед населення економічно розвинених країн, за даними різних авторів, поширеність МС становить від 25 до 40 %. На сьогодні реєструється омолоджування цієї патології. Так, частота розвитку МС у підлітків та осіб молодого віку підвищилася за останні 60 років в 1,5 раза, а частка надмірної маси тіла в дітей в економічно розвинених країнах досягає 14 % [2, 6, 7]. Поширеність МС зростає з кожним роком, на даний час експерти ВООЗ оцінюють ситуацію як нову пандемію XXI століття, що охоплює індустріально розвинені країни [9]. Поширеність МС у 2 рази вища, ніж цукрового діабету, і до 2035 року прогнозується її зростання на 50 % [17, 18]. Спочатку метаболічний синдром, що включає абдомінальне ожиріння, дисліпідемію, порушення толерантності до глюкози та артеріальну гіпертензію, описувався як виключно «дорослий» феномен. У результаті протягом тривалого часу було відсутнє єдине уявлення про даний симптомокомплекс у дітей та підлітків, не були розроблені чіткі діагностичні критерії цього стану. Однак сьогодні прояви метаболічного синдрому значно поширені в дитячій і підлітковій популяції і відзначається чітка тенденція до їх подальшого поширення [8]. На даний час не викликає сумнівів той факт, що коріння метаболічних порушень — у дитячому та підлітковому віці. Стрімке зростання поширеності ожиріння, особливо в країнах, що розвиваються, призводить до істотного збільшення числа дітей та підлітків, які мають ознаки інсулінорезистентності та ризик метаболічних порушень [14]. А досить висока частота поширеності серед осіб до 18 років інших компонентів метаболічного синдрому (артеріальна гіпертензія, порушення толерантності до глюкози тощо) та їх негативний вплив на розвиток серцево-судинних та ендокринних захворювань у дорослому житті обумовлюють актуальність вивчення проблеми метаболічного синдрому в дітей. Серед сучасних науковців медичного світу тривають дискусії щодо критеріїв діагностики даного симптомокомплексу в дітей різних вікових груп [13]. На сьогодні діагностика метаболічного синдрому в дітей та підлітків заснована на узгоджених критеріях, запропонованих Міжнародною діабетичною федерацією (IDF) у 2007 році [7, 19]. Згідно з цими критеріями, основою даного симптомокомплексу є абдомінальне ожиріння, що оцінюється за центильними таблицями окружності талії. Абдомінальне ожиріння прийняли за основний критерій, ґрунтуючись як на патогенезі синдрому, так і на епідеміологічних дослідженнях, у яких було показано, що окружність талії найбільш тісно корелює з іншими проявами метаболічного синдрому.
Синдром діагностують за наявності в дитини трьох із наведених нижче критеріїв:
— індекс маси тіла (ІМТ) ≥ 85-го перцентиля для відповідної статі дитини;
— окружність талії ≥ 90-го перцентиля для відповідних віку та статі;
— артеріальний тиск ≥ 95-го перцентиля для відповідного віку дитини;
— глікемія натщесерце ≥ 6,1 ммоль/л, або порушення толерантності до глюкози, або цукровий діабет;
— рівень тригліцеридів (ТГ) ≥ 1,2 ммоль/л;
— рівень ліпопротеїдів високої щільності (ЛПВЩ) < 0,9 ммоль/л.
Згідно з критеріями IDF, метаболічний синдром не формується у віці до 6 років, а у віці 6–10 років можна говорити тільки про групу ризику формування метаболічного синдрому, установлення діагнозу дітям у цьому віці невиправдана.
Стан органів травної системи та їх роль у розвитку метаболічного синдрому на даний час є недостатньо вивченими та практично невідомі клініцистам, у той час як самі органи системи травлення мають пряме відношення до розвитку МС та нерідко самі стають органами-мішенями [3, 10]. На думку ряду авторів, тригером прогресування коморбідної патології системи травлення за наявності МС виступає запалення, тісно пов’язане з розвитком як стеатогепатиту, стеатопанкреатиту, холедохолітіазу, кишечної ендотоксемії, супутніх захворювань та їх ускладнень, так і ожиріння — облігатного для метаболічного синдрому [5]. Частота патології біліарного тракту у хворих із метаболічним синдромом становить 41,9 %, патології печінки — 64 %. Пацієнти з метаболічним синдромом мають максимальний ризик розвитку неалкогольної жирової хвороби печінки (НАЖХП) та, як наслідок, неалкогольного стеатогепатиту (НАСГ), що виявляється в 37 % випадків. НАЖХП у 90 % випадків асоційована з цукровим діабетом 2-го типу, абдомінальним ожирінням, атерогенною дисліпідемією [1, 16]. У літературі наведені численні дані про патогенетичні механізми пошкодження печінки при МС, а також роль самої печінки у виникненні та прогресуванні метаболічного синдрому. Саме печінка внаслідок різноманітності виконуваних нею функцій визначає тяжкість патологічного процесу та сама виступає в ролі органа-мішені [3, 10]. Неалкогольна жирова хвороба печінки характеризується накопиченням ліпідів у гепатоцитах та інфільтрацією в інші органи (скелетні м’язи, міокард, підшлункову залозу), спричиняє ліпотоксичні процеси й розвиток діабету. Згідно з результатами досліджень, у 70–80 % осіб з ожирінням діагностовано НАЖХП і в 15–20 % — неалкогольний стеатогепатит [5]. У 50–100 % пацієнтів із НАСГ супутньою патологією є ожиріння, а у 60 % із них діагностують гіпертензію та дисліпідемію [16].
В Україні статистичні дані щодо взаємозв’язку між наявністю МС та розвитком НАЖХП у дорослих та пацієнтів дитячого віку відсутні. Етіологія НАЖХП залишається до кінця не визначеною, але виявлено та доведено тісний взаємозв’язок цієї патології з інсулінорезистентністю та порушеннями ліпідного обміну [12, 15].
Метою нашого дослідження стало визначення взаємозв’язку між наявністю та поширеністю основних компонентів МС та розвитком НАЖХП у пацієнтів дитячого та підліткового віку.
Матеріали та методи
Дослідження проводилося на базі гастроентерологічного відділення Полтавської обласної дитячої клінічної лікарні та ендокринологічного відділення Дитячої міської клінічної лікарні м. Полтави. Усього під спостереженням перебувало 39 дітей віком від 7 до 17 років, у яких діагностовано ожиріння згідно з міжнародними рекомендаціями та чинним протоколом діагностики та лікування ендокринних захворювань у дітей. Діагноз НАЖХП формулювали згідно з класифікацією МКХ-10 (К 76.0 — жирова дегенерація печінки). Усі пацієнти були розподілені на дві групи. Основну групу (n = 23) становили діти, у яких на фоні вираженого ожиріння було діагностовано неалкогольну жирову хворобу печінки, до групи порівняння (n = 16) увійшли пацієнти з діагностованим ожирінням без порушень функцій печінки, контрольну групу становили здорові діти (n = 10), порівнянні за статтю та віком. Діагноз НАЖХП верифікували за допомогою даних ультразвукового обстеження печінки (підвищення ехогенності та дифузна неоднорідність паренхіми печінки, поглинання ультразвукового променя та ознаки помірної гепатомегалії) та змін у біохімічному аналізі крові (підвищення сироваткових трансаміназ). З метою скринінгу для виключення уражень вірусної та автоімунної етіології всі пацієнти були обстежені на HBs-Ag та анти-HCV, визначали антинуклеарні (ANA) та антимітохондріальні антитіла, а також рівень a-трипсину та церулоплазміну як маркерів обмінних порушень печінки. Усім дітям було проведено комплексне обстеження, що включало збір анамнестичних даних, антропометрію та загальноклінічні аналізи. Надлишкова маса тіла/ожиріння розраховувалася за відсотком надлишкової маси від потрібної з використанням перцентильних таблиць згідно з віком і статтю. Абдомінально–вісцеральний тип ожиріння визначали за допомогою відношення окружності талії до стегон (От/Ос). Для виявлення порушень вуглеводного обміну всім пацієнтам визначали концентрацію глюкози крові натще, проводили пероральний глюкозотолерантний тест, концентрацію імунореактивного інсуліну (ІРІ) визначали імунохімічним методом з використанням тест-системи Roche Diagnostics (Швейцарія). Розраховували індекс НОМА-IR, що є критерієм інсулінорезистентності за формулою: НОМА-IR = інсулін (мкОд/мл) · глюкоза (ммоль/л)/22,5.
Показники ліпідного спектра крові — загальний холестерин (ЗХС), тригліцериди, холестерин ліпопротеїдів високої щільності (ХС ЛПВЩ), холестерин ліпопротеїдів низької щільності та холестерин ліпопротеїдів дуже низької щільності визначали ферментативно-колометричним методом за допомогою тест-систем Roche Diagnostics (Швейцарія). Інтегральний показник — коефіцієнт атерогенності (КА) розраховували за формулою: КА = (ЗХС – ХС ЛПВЩ)/ХС ЛПВЩ.
Обробка числових даних здійснювалася загальноприйнятими в медичній статистиці математичними методами. Вираховували показники середніх величин (М), помилок середніх величин (m) досліджуваних показників. Статистичну вірогідність обчислювали, використовуючи критерій t Стьюдента. Різницю показників вважали вірогідною при значенні р < 0,05.
Результати та обговорення
Аналіз статевого складу обстежуваних дітей показав, що переважну більшість пацієнтів із діагностованою неалкогольною жировою хворобою печінки становили дівчатка (60,8 %), у той час як діти з екзогенно-конституціональним ожирінням (ЕКО) за статевим складом був розподілені практично рівномірно. Середній вік усіх пацієнтів становив 12 років (у діапазоні 7–17 років), вірогідної різниці за віком не було.
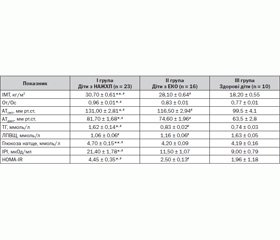
Оскільки одним із базових критеріїв установлення діагнозу МС є абдомінально-вісцеральний тип ожиріння, обстеження дітей розпочали з визначення їх антропометричного статусу. Згідно з даними нашого дослідження, підвищення індексу маси тіла щодо перцентильних таблиць за віком та статтю відмічалося у пацієнтів обох груп, але показники були вірогідно вищими в дітей з діагностованою НАЖХП (30,70 ± 0,61 та 28,10 ± 0,64 відповідно, р < 0,05). Слід відмітити, що майже 34,7 % дітей даної групи мали ІМТ > 30 кг/м2, на відміну від пацієнтів з ЕКО, серед яких даний показник відмічався лише у 18,7 % обстежених, але вірогідної різниці виявлено не було.
Абдомінально–вісцеральний тип ожиріння прийнято визначати за відношенням окружності талії до стегон: > 0,8 для дівчаток та > 0,9 для хлопчиків. Показники От/Ос були вірогідно вищими в групі дітей із НАЖХП (0,96 ± 0,01 та 0,83 ± 0,01 відповідно, р < 0,01) (табл. 1).
Причому в 40 % дітей із порушенням функції печінки відношення От/Ос перевищувало 1,0, що статистично відрізнялося від групи пацієнтів з ЕКО, у якій такий показник був зафіксований лише в 13 % дітей. Даний факт ще раз доводить, що даний тип жиророзподілу є найбільш несприятливим, призводить до виражених дисметаболічних порушень організму і є одним із вагомих предикторів розвитку НАЖХП.
Одним з основних критеріїв підтвердження МС у дітей, згідно з критеріями IDF, є наявність артеріальної гіпертензії. Діагноз артеріальної гіпертензії верифікували у випадку, коли в дитини артеріальний тиск перевищував середні величини на два стандартних відхилення або був вищим за 95-й перцентиль вікової норми. Згідно з отриманими нами даними, підвищення артеріального тиску відмічалося у 43,5 % дітей із НАЖХП, що вірогідно відрізнялося від поширеності даного показника в групі дітей з екзогенно-конституціональним ожирінням (16 %, р < 0,05). Серед усіх обстежених з артеріальною гіпертензією в обох групах переважали хлопчики (майже 60 % хворих).
Моніторинг стану вуглеводного обміну показав, що вміст глюкози натще був у межах норми практично у всіх обстежуваних дітей (90,5 %), лише два пацієнти з виявленим жировим гепатозом мали збільшення глікемії натще понад 5,6 ммоль/л, а в однієї дитини був діагностований цукровий діабет 2-го типу. Проте, незважаючи на те, що базальний рівень глюкози був у межах норми в більшості пацієнтів обох груп, середні показники були вірогідно вищими в дітей із діагностованою жировою хворобою печінки (4,70 ± 0,15 та 4,20 ± 0,09 відповідно, р < 0,05) (табл. 2).
Важливо відмітити, що майже 60 % дітей обох груп із нормоглікемією натще при дослідженні глікемічного профілю мали підвищений рівень постпрандіальної глюкози. Отримані дані свідчать про значну поширеність порушення толерантності до вуглеводів серед дітей та підлітків з ожирінням і підтверджують необхідність включення перорального глюкозотолерантного тесту в програму обстеження даної категорії пацієнтів. Дослідження рівня ІРІ показало, що базальна гіперінсулінемія (із середнім значенням 21,40 ± 1,78 мкОд/мл) виявлялася у 26 % хворих із діагностованою НАЖХП — значно частіше, ніж у дітей з ожирінням без порушення функції печінки (6,25 %, р < 0,05), відповідно, вірогідно вищим в цій групі дітей був індекс інсулінорезистентності НОМА-IR (р < 0,01).
Аналіз ліпідного спектра крові виявив, що практично 90 % усіх обстежених дітей з ожирінням мали виражені зміни в ліпідограмі, що проявлялося тенденцією до підвищення загального холестерину плазми, тригліцеридів, ліпопротеїдів низької щільності з підвищенням коефіцієнту атерогенності. У групі дітей із НАЖХП, на відміну від пацієнтів з ЕКО, відмічалися найвища концентрація рівня ТГ сироватки крові (1,62 ± 0,14 ммоль/л проти 0,83 ± 0,02 ммоль/л відповідно, р < 0,01) та менший рівень ЛПВЩ (1,06 ± 0,06 ммоль/л). Виявлена тенденція до відносного зниження антиатерогенного класу ліпопротеїдів та підвищення індексу атерогенності в пацієнтів із зайвою вагою відображає процес формування атерогенної дисліпідемії вже в дитячому віці й може бути пояснена впливом гіперінсулінемії та інсулінорезистентності при ожирінні.
Висновки
Проведене нами дослідження дозволило проаналізувати вираженість та поширеність основних складових компонентів МС у дітей із неалкогольною жировою хворобою печінки. Отримані результати показали, що в обстежених дітей та підлітків із НАЖХП на фоні ожиріння найбільш поширеним компонентом була інсулінорезистентність, яка відмічалася в 56,5 % дітей, 43,5 % пацієнтів мали прояви артеріальної гіпертензії, дисліпідемія за рахунок зниження фракції ЗХ ЛПВЩ також відмічалася в 43,5 % випадків, гіпертригліцеридемія — у 34,7 %, при цьому майже 40 % дітей мали виражене ожиріння за абдомінально-вісцеральним типом.
Слід зазначити, що повна форма МС з п’яти компонентів була виявлена майже в кожної четвертої дитини (24,5 %) з НАЖХП, у 31 % пацієнтів відмічалася наявність чотирьох критеріїв, усі інші діти (44,5 %) мали різні комбінації з двох-трьох компонентів. На противагу цьому в групі дітей із діагностованим ожирінням без порушення функції печінки не вдалося зафіксувати випадків повного МС, лише у 25 % з усіх обстежених відмічалися три компоненти МС, решта (75 %) мали неповний МС із двох компонентів (рис. 1).
/24/24.jpg)
Отримані результати дають змогу діагностувати високу поширеність МС у дітей та підлітків із НАЖХП, що підкреслює актуальність даної проблеми в педіатричній практиці. Активне виявлення та попередження початкових проявів МС у дітей та підлітків з ожирінням допоможе знизити ризик розвитку асоційованих із ним захворювань, зокрема неалкогольної жирової хвороби печінки.
1. Белоусов Ю.В., Бабаджанян Е.Н. Жировой гепатоз у детей: дефиниция и диагноз / Белоусов Ю.В., Бабаджанян Е.Н. // Современная педиатрия. — 2010. — № 5(33). — С. 107–109.
2. Берштейн Л.М., Коваленко И.Г. «Метаболически здоровые» лица с ожирением и метаболические признаки ожирения у лиц с нормальной массой тела: что за этим стоит / Берштейн Л.М., Коваленко И.Г. // Пробл. эндокринол. — 2010. — № 3. — С. 47–51.
3. Звягинцева Т.Д., Чернобай А.И. Применение препарата Антраль в лечении неалкогольного стеатогепатита: настоящее и будущее / Звягинцева Т.Д., Чернобай А.И. // Здоров’я України. — 2009. — № 1–2. — С. 68–69.
4. Кайдашев И.П. Эволюция понятия «метаболический синдром» и его современное значение / И.П. Кайдашев // Український медичний часопис. Актуальні питання клінічної практики. — 2012. — № 2(88).
5. Лазебник Л.Б., Звенигородская Л.А. Метаболический синдром и органы пищеварения / Лазебник Л.Б., Звенигородская Л.А. — М., 2009. — 182 с.
6. Мітченко О.І., Корпачев В.В.; Робоча група з проблем метаболічного синдрому, цукрового діабету, предіабету і серцево-судинних захворювань Української асоціації кардіологів, Української асоціації ендокринологів. Діагностика і лікування метаболічного синдрому, цукрового діабету, предіабету і серцево-судинних захворювань: Метод. рекомендації. — К., 2009. — 42 с.
7. Сергеев В.П. Метаболический синдром: причины, лечение и профилактика / Сергеев В.П. // Врач. — 2009. — № 2. — С. 36–41.
8. Синицын П.А. Метаболический синдром у детей и подростков. Клинико-генетические параллели: Автореф. дис... канд. мед. наук: спец. 14.01.10 «Педиатрия» / П.А. Синицын. — М., 2009. — 27 с.
9. Скрипник И.Н. Избыточный вес как основа НАСГ и актуальная медико-социальная проблема / И.Н. Скрипник // Здоров’я України. — 2009. — № 20(225).
10. Ткаченко Е.И., Успенский Ю.П., Белоусова Л.Н. и др. Неалкогольная жировая болезнь печени и метаболический синдром: единство патогенетических механизмов и подходов к лечению / Ткаченко Е.И., Успенский Ю.П., Белоусова Л.Н. // Экспериментальная и клиническая гастроэнтерология. — 2008. — № 2. — С. 92– 96.
11. Bagry H.S., Raghavendram S., Carli F. Metabolic syndrome and insulin resistance / Bagry H.S., Raghavendram S., Carli F. // Anesthesiology. — 2008. — Vol. 108(3). — P. 506–523.
12. Chang Y., Ryu S., Sung E., Jang Y. Higher concentrations of alanine aminotransferase within the reference interval predict nonalcoholic fatty liver disease / Chang Y., Ryu S., Sung E., Jang Y. // Clin. Chem. — 2007. — Vol. 53. — P. 686–692.
13. Inge Gies, Jesse Vanbesien et al. Insulin resistance as a leading cause of hyperthyrotropine mia in overweigth children / Inge Gies, Jesse Vanbesien et al. // Horm Res. — 2007. — Vol. 68 (suppl. 1). — P. 30.
14. Mishra A., Khurana L. Obesity, and the Metabolic Syndrome in Developing Countries. / Mishra A., Khurana L. // J. Clin. Endocrinol. Metab. — 2008. — Vol. 93 (Suppl. 1). — Р. 9–30
15. Musso G., Gambino R., Bo S. et al. Should nonalcoholic fatty liver disease be included in the definition of metabolic syndrome? A cross-sectional comparison with Adult Treatment Panel III criteria in nonobese nondiabetic subjects / Musso G., Gambino R., Bo S. // Diabetes Care. — 2008.— Vol. 31. — P. 562–568.
16. Ogden C., Yanovski S., Carrel M. The epidemiology of obesity / Ogden C., Yanovski S., Carrel M. // Gastroenterology. — 2007. — Vol. 132. — P. 1087–2102.
17. Sun S.S., Grave G.D., Siervogel R.M. et al. Systolic Blood Pressure in Childhood Predicts Hypertension and Metabolic Syndrome Later in Life / Sun S.S., Grave G.D., Siervogel R.M. et al. // Pediatrics. — 2007. — Vol. 119(2). — Р. 237–246.
18. Weiss R., Dziura J., Burgert T.S. et al. Obesity and the metabolic syndrome in children and adolescents / Weiss R., Dziura J., Burgert T.S. // NEJM. — 2004. — Vol. 350. — Р. 2362–2374.
19. Zimmet P., Alberti K.G., Kaufman F. et al. IDF Consensus Group. The metabolic syndrome in children and adolescents — an IDF consensus report / Zimmet P., Alberti K.G., Kaufman F. et al. // Pediatr. Diabetes. — 2007. — Vol. 5. — Р. 299–306.

/23/23.jpg)
/24/24_2.jpg)