Международный неврологический журнал 3 (65) 2014
Вернуться к номеру
Лечение рефрактерной к НПВС боли в спине
Авторы: Зайченко А.В. - Национальный фармацевтический университет, г. Харьков; Баринов А.Н., Махинов К.А. - Первый Московский государственный медицинский университет им. И.М. Сеченова, Россия;
Брюханова Т.А. - Национальный фармацевтический университет, г. Харьков
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Статья посвящена проблеме боли в спине. Рассматривается вопрос выбора лекарственных препаратов для лечения этого синдрома. Сделан акцент на факторах, влияющих на эффективность и безопасность того или иного препарата группы нестероидных противовоспалительных средств — базисной терапии дорсалгий. Кроме того, уделяется внимание препаратам других групп — антидепрессантам, нейротропным средствам, глюкокортикоидам.
Стаття присвячена проблемі болю в спині. Розглядається питання вибору лікарських препаратів для лікування цього синдрому. Зроблено акцент на факторах, що впливають на ефективність і безпеку того чи іншого препарату групи нестероїдних протизапальних засобів — базисної терапії дорсалгій. Крім того, приділяється увага препаратам інших груп — антидепресантам, нейротропним засобам, глюкокортикоїдам.
Article deals with the problem of back pain. The question of the choice of drugs for the treatment of this syndrome is considered. Focus is on the factors affecting the efficacy and safety of one or another drug from group of nonsteroidal anti-inflammatory drugs — basic therapy for dorsalgia. In addition, attention is paid to drugs of other groups — antidepressants, neurotropic agents, glucocorticoids.
боль, лечение, препараты, эффективность, безопасность.
біль, лікування, препарати, ефективність, безпека.
pain, treatment, medications, efficacy, safety.
Статья опубликована на с. 89-96
Боль в области шейного, грудного или поясничного отделов позвоночника периодически возникает у 84–90 % людей. Ежегодно хотя бы один эпизод боли в спине испытывает каждый пятый человек, при этом у половины больных наблюдается спонтанное исчезновение болей в течение недели, у 3/4 — в срок до месяца, а у 90 % боли проходят за 6 недель [20, 21]. У каждого десятого пациента заболевание становится хроническим: боль в спине находится на втором месте среди причин нетрудоспособности, уступая пальму первенства лишь суставным болям. Пациенты, страдающие болью в спине, в подавляющем большинстве случаев не обращаются за помощью к специалистам и самостоятельно купируют болевой синдром парацетамолом или нестероидными противовоспалительными средствами (НПВС), причем назначают себе эти средства исходя из рекламы в СМИ, советов друзей и собственного положительного опыта. Таким образом, говорить о «спонтанном» разрешении боли в спине не совсем корректно — мало кто из современных людей станет ждать, когда боль исчезнет сама. Наиболее частой (около 90 %) причиной боли в спине является дисфункция мышечного и суставно–связочного аппарата позвоночника, обозначающаяся в современной литературе термином «неспецифическая боль в спине», ввиду того, что вне зависимости от первопричины, вызвавшей боль в спине, патогенетические механизмы развития этого заболевания одинаковы [2, 7, 11]. Второй по частоте встречаемости причиной боли в спине является дискогенная радикулопатия, вызванная дискорадикулярным конфликтом вследствие механической компрессии и аутоиммунного воспаления [20]. На третьем месте находятся вторичные (специфические) причины боли в спине, обозначаемые в литературе как «красные флажки» [2, 5–8]. И если в первом и втором случае самолечение НПВС хотя и нежелательно, но все же не всегда приводит к катастрофическим последствиям, то при вторичных болях в спине бесконтрольное назначение НПВС абсолютно недопустимо — больные теряют драгоценное время, когда еще возможно вылечить первопричину боли, и обращаются к специалистам в некурабельном состоянии, когда остается только проводить паллиативную терапию.
«Красные флажки» — признаки возможной вторичной боли в спине:
— возраст дебюта боли старше 55 лет и менее 20 лет;
— сохранение боли в покое, утренняя скованность;
— независимость боли от положения тела и движений в позвоночнике, пульсирующий характер боли;
— значимая травма в недавнем анамнезе (падение с высоты и т.п.);
— наличие в анамнезе злокачественного новообразования;
— беспричинное снижение веса и/или лихорадка;
— болезненность при пальпации и перкуссии позвоночника;
— наличие в анамнезе наркотической зависимости, ВИЧ-инфекции, применение иммуносупрессантов, длительное применение кортикостероидов;
— симптомы поражения спинного мозга (чувствительные расстройства на туловище и в конечностях («проводниковые нарушения чувствительности»), слабость в конечностях, тазовые расстройства);
— отсутствие улучшения через 1 месяц оптимального лечения.
Во всех перечисленных случаях необходима рентгенография соответствующих отделов позвоночника в прямой и боковой проекции, проведение общего анализа крови и мочи, а при подозрении на остеомиелит, эпидуральный абсцесс, поражение спинного мозга и корешков, а также в диагностически сомнительных случаях — магнитно-резонансная томография пояснично-крестцового отдела позвоночника. При необходимости уточнения состояния костных структур в ряде случаев после проведения рентгенографии показана рентгеновская компьютерная томография (КТ) и сцинтиграфия позвоночника. При подозрении на злокачественное новообразование предстательной железы необходимо исследовать уровень специфического антигена простаты. При наличии травмы в недавнем анамнезе (падение с высоты, дорожно-транспортные происшествия и т.п.), а также при длительном применении кортикостероидов и возрасте пациентов старше 55 лет необходимо провести рентгенографию позвоночника с функциональными пробами, а при недостаточной ее информативности и сохранении боли свыше 10 дней — сцинтиграфию или КТ позвоночника для исключения компрессионного и иного травматического перелома позвонков. Всем пациентам с интенсивным болевым синдромом длительностью свыше 1 месяца, а также всем больным с хроническими болями в спине показано однократное проведение рентгенографии позвоночника в прямой и боковой проекции с целью исключения в первую очередь опухолевого или инфекционного поражения позвоночника, а также остеопороза. При болевом синдроме в грудной клетке всем пациентам уже при первом обращении целесообразно проведение электрокардиографии и рентгенографии легких для исключения соматической патологии (ишемической болезни сердца, инфекционного и опухолевого поражения легких и плевры и др.) как основной причины болевого синдрома.
При обследовании пациентов с явными ортопедическими дефектами в виде грубого сколиоза, спондилолистеза, нестабильности поясничного отдела позвоночника, асимметрии длины ног, косого и скрученного таза, патологии тазобедренных суставов определить этиологию боли не составляет больших трудностей. А вот точное выявление источников болевой импульсации, особенно при хронической неспецифической боли в спине, весьма затруднительно [1, 4, 8]. По мнению отдельных ведущих исследователей в этой области, без применения инвазивных методов диагностики (дискографии, диагностических блокад) оно возможно примерно у 40 % пациентов с острыми и подострыми болями в спине и не более чем в 15 % случаев хронических скелетно-мышечных болевых синдромов [8, 10–12]. С одной стороны, это отражает сложность строения структур поясничной области и связанную с ней трудность точного определения ноциогенной структуры, с другой — утрату первостепенной роли периферических источников при неспецифической боли в спине, особенно при ее хронизации. В качестве основных источников локальной боли в поясничной области в 70–80 % случаев обсуждаются миогенные нарушения (спазм, микротравматизация, ишемия паравертебральных мышц), дисфункция фасеточных суставов (до 40 % случаев) и в 5 % — дискогенная боль [5, 7, 8]. Фасеточный, миофасциальный и мышечно-тонический синдромы нередко являются во многом гомогенными со стороны жалоб пациентов и в большинстве случаев имеют «перекрывающиеся» характеристики при клиническом обследовании больных. Но точная диагностика первопричины боли на первом этапе лечения и не важна — все равно препаратами выбора при острой боли в спине являются НПВС или парацетамол. И пациенты, имеющие необходимость максимально быстро избавиться от мучительных болей, принимают их как по назначению врача, так и самостоятельно. Как было указано выше, у половины пациентов острая боль в спине проходит в течение недели, у 3/4 — в течение месяца. Нередко приходится производить замену НПВС из–за недостаточной эффективности или вследствие непереносимости. И в 25 % случаев НПВС оказываются либо недостаточно эффективны для купирования острой боли в спине, либо не переносимы из-за побочных явлений со стороны желудочно-кишечного тракта (ЖКТ) или сердечно-сосудистой системы — именно эти больные, рефрактерные к НПВС, являются наиболее сложными для курации.
Многочисленные исследования свидетельствуют, что генетический полиморфизм является одним из важнейших факторов, влияющих на эффективность и безопасность НПВС-терапии. Современная фармакология накопила большое количество новых данных по фармакогенетике НПВС, которые значительно расширяют устоявшиеся представления и углубляют наше понимание проблемы рефрактерности боли в спине к НПВС-терапии. Генетический полиморфизм пациента может обусловливать широкий спектр изменчивости фармакодинамического и фармакокинетического профиля лекарств, что непременно будет влиять на эффективность и безопасность их применения. Наибольшее количество исследований, которые касаются фармакогенетики НПВС, посвящено изучению полиморфизма генов системы CYP, которые кодируют ключевые ферменты биотрансформации препаратов этой группы. В табл. 1 обобщены некоторые данные относительно роли отдельных представителей суперсемейства CYP в превращении НПВС.
Из данных, приведенных в табл. 1, видно, что ключевым ферментом метаболизма большинства НПВС, в том числе оксикамов и коксибов, является CYP2C9. Для гена, который кодирует CYP2C9, также характерен полиморфизм (табл. 2) [17, 18].
Вариабельные аллели (CYP2C9*2 и CYP2C9*3) часто встречаются среди представителей европеоидной расы (кавказской группы) и определяют замедленный в сравнении с «дикой» аллелью CYP2C9*1 метаболизм по CYP2C9 [18]. В связи с этим была выдвинута гипотеза, согласно которой носители медленных аллелей CYP2C9*2 и CYP2C9*3 имеют повышенный риск развития побочных реакций на фоне применения НПВС. Результаты исследований, проведенных испанскими учеными, свидетельствуют, что соотношение пациентов с геморрагическими осложнениями, которые обусловлены применением НПВС (субстратов CYP2C9), составляет 2,5 для гетерозиготных и 3,7 для гомозиготных носителей мутантных аллелей гена CYP2C9 [18]. Эти данные подтверждают предположения о том, что унаследованные нарушения активности CYP2C9 повышают риск гастроинтестинальных осложнений НПВС–терапии. В пользу этой гипотезы в различных этнических группах свидетельствует тот факт, что частота аллелей CYP2C9*2 и CYP2C9*3 в бразильской популяции близка к той, которая наблюдается среди представителей кавказской группы, при этом выявляется взаимосвязь между носительством этих аллелей и замедлением биотрансформации теноксикама [19].
Распределение частот встречаемости аллельных вариантов CYP2C9 в российской популяции составляет: CYP2C9*1 — около 80 %; CYP2C9*2 — около 12 %; CYP2C9*3 — около 8 %. Преобладающим генотипом в российской популяции является CYP2C9*1/CYP2C9*1.
Следует отметить также, что для большого количества НПВС CYP2С9 — основной фермент, который обеспечивает их обезвреживание, а роль альтернативных систем биотрансформации в большинстве случаев является мизерной. Так, М. Nakajima и соавт. указывают на роль CYP2C9 и CYP2C19 в превращении индометацина в неактивные метаболиты, но при оценке этой роли отмечают, что вклад CYP2C9 в 16 раз более высокий [18]. Показано, что полиморфизм CYP2C8 может быть причиной развития диклофенак–индуцированной гепатотоксичности и острого желудочно-кишечного кровотечения при использовании этого НПВС [22]. Следовательно, важную позитивную роль в случае унаследованных нарушений активности ферментов биотрансформации лекарств играет возможность реализации альтернативных путей их обезвреживания.
Полиморфизм белков системы CYP, и вообще ферментов биотрансформации, не является единственным генетическим фактором, который определяет реакцию пациентов на эти препараты. Следует иметь в виду целый ряд других генов (Ugt1А6, Ptgs1, Ptgs2 и т.п.) в формировании фармакокинетического и фармакодинамического профиля НПВС у больных. Для многих из них описан широкий полиморфизм, однако оценка влияния этих генетических маркеров на результаты НПВС–терапии еще нуждается в проведении детальных и методологически верно построенных исследований [22].
Выбор «правильного» НПВС зачастую осуществляется самим больным эмпирическим путем, но, помня о фармакогенетической составляющей успеха НПВС-терапии, для первичного назначения наиболее безопасного и эффективного аналгетика можно воспользоваться опытом ближайших родственников больного. Следует отметить, что при боли в спине НПВС не рекомендуются для монотерапии более 10–14 дней. Если недельный курс приема препарата не купирует болевой синдром, то это должно побудить пациента и его лечащего врача пересмотреть тактику лечения с привлечением невролога, который поможет разобраться в структуре болевого синдрома с целью выявления признаков «серьезной патологии» и выяснить причины неэффективности НПВС в каждом конкретном случае [2, 5, 6]. А причин такой неэффективности может быть несколько: плохое кровоснабжение в очаге воспаления (тогда НПВС или глюкокортикоид можно ввести адресно прямо в «триггерную зону» — эпицентр боли и воспаления путем блокады с местными анестетиками) или стойкий спазм паравертебральных мышц с формированием порочного круга «боль — спазм — боль» [3]. Для воздействия на патогенетические механизмы хронификации боли в спине (прежде всего на мышечный спазм) на втором этапе лечения используют миорелаксанты (баклосан 10–30 мг/сут, тизанидин 6–12 мг/сут, толперизон 150–450 мг/сут). Основным механизмом действия вышеперечисленных препаратов является торможение возбуждения двигательного нейрона в ответ на болевые стимулы и эмоциональный дискомфорт. Альфа-2-адреномиметик тизанидин нормализует повышенный мышечный тонус, блокируя выделение возбуждающего нейротрансмиттера глутамата в двигательных нейронах переднего рога спинного мозга, а также активирует нисходящие антиноцицептивные влияния голубого пятна ствола мозга. Блокатор натриевых каналов толперизон подавляет ретикулоспинальные растормаживающие воздействия на гамма-мотонейроны, регулирующие тонус мышц. Активатор рецепторов гамма-аминомасляной кислоты баклосан опосредованно воздействует на кальциевые каналы двигательных и чувствительных нейронов спинного мозга, подавляя медленные постсинаптические потенциалы, суммирующиеся в болевые импульсы и повышение тонуса мышц, а также уменьшая возбудимость нейронов лимбической системы и, соответственно, тревожность пациентов. Таким образом, миорелаксанты оказывают аналгетическое действие, помогая расторможенным отделам нервной системы вернуться в состояние покоя, то есть стирая «болевую память». Это не только уменьшает выраженность боли при хроническом болевом синдроме, но и предотвращает усиление острой боли и переход ее в хроническую форму [2, 3].
При недостаточной эффективности НПВС в сочетании с миорелаксантами возможно кратковременное (7–10 дней) назначение слабых наркотических аналгетиков (трамал 50–200 мг/сут). Наркотические аналгетики на время дают облегчение, но к ним возникает привыкание (с каждым разом требуются все большие дозы) и лекарственная зависимость (пациент уже не может обходиться без этих препаратов). Поэтому применение опиатов дольше 10 дней не рекомендуется и допустимо лишь при самых интенсивных (> 70 мм по визуально-аналоговой шкале) болях в спине при неэффективности НПВС и адъювантных аналгетиков в качестве третьей ступени обезболивающей терапии, рекомендованной Всемирной организацией здравоохранения [2, 5, 6].
В качестве базисной терапии фасеточного синдрома, вызванного остеоартрозом (спондилоартроз) дугоотростчатых суставов и крестцово-подвздошных сочленений, при хронической боли в спине широко используются так называемые симптом-модифицирующие препараты медленного действия — SYSADOA, в частности содержащие глюкозамина и хондроитина сульфат [1]. Они обладают умеренно выраженным обезболивающим и противовоспалительным действием, но лишены характерных для НПВС побочных эффектов. Поскольку механизм противовоспалительного действия хондропротекторов не связан с подавлением синтеза простагландинов, а обусловлен блокированием ядерного фактора каппа В, инициирующего распад хрящевой ткани, то обезболивающий эффект глюкозамина проявляется не сразу, а спустя 4–6 недель после начала регулярного приема, с умеренным снижением боли, поэтому при обострении заболевания используются комбинации хондропротекторов с НПВС [1, 16]. Обоснованием для применения SYSADOA являются как результаты многолетнего, безопасного и успешного применения при остеоартрозе (уровень доказательности 1А), так и общность воспалительно-дегенеративных процессов, происходящих в суставах конечностей и межпозвоночных (фасеточных) суставах. Терапия SYSADOA позволяет постепенно снижать дозы применяемых НПВС в арифметической прогрессии: в первый месяц потребность в НПВС сокращается вдвое, через 2 месяца — в 4 раза, через 3 месяца приема — почти в 10 раз сокращается применение НПВС, при этом боль в покое и при движении уменьшается на 70 % [16]. Учитывая хроническое течение суставной патологии, требующее длительной противовоспалительной и обезболивающей фармакотерапии, и распространенную коморбидность, прием SYSADOA существенно понижает риск возникновения побочных реакций, связанных с употреблением НПВС при лечении боли в спине.
При отсутствии противопоказаний желательно дополнить лечение немедикаментозным лечением: тепловыми физиопроцедурами, криотерапией, мануальной терапией, вакуумным и ручным массажем, ударно-волновой терапией. Эффективность этих процедур с точки зрения доказательной медицины пока окончательно не установлена (это связано с невозможностью подбора адекватного плацебо для двойной слепой рандомизации — исследователь и пациент легко узнают, проводилось ли реальное физиолечение или его имитация), однако высокая приверженность определенной категории больных методам немедикаментозной терапии не позволяет исключить физиопроцедуры из клинической практики. Кроме того, применение для массажа и самомассажа при боли в спине раздражающих средств местного действия, истощающих выработку субстанции Р, обосновано результатами двойных слепых рандомизированных плацебо-контролируемых исследований [5, 6].
Препараты местного действия должны обладать следующими характеристиками:
— оказывать действие только на локальную активность в периферических тканях, например, периферические ноцицепторы в коже;
— их концентрация в крови не достигает уровня, измеряемого лабораторными тестами;
— не иметь системных побочных эффектов;
— не вступать в реакции лекарственного взаимодействия.
Глубина проникновения местных форм НПВС варьирует от нескольких миллиметров до 2 см и зависит от липофильности действующего вещества, анатомических особенностей кожи (толщины подкожной жировой клетчатки, состояния капиллярной сети, степени напряженности мышц и т.п.), интенсивности втирания и других факторов. Эта относительно небольшая глубина проникновения и является основной причиной недостаточной эффективности местных форм НПВС, особенно в тех случаях, когда воспаление локализовано в глубоких слоях мышц (например, паравертебральные мышцы), надкостнице и крупных суставах (тазобедренном, плечевом и т.п.).
Более полутора веков для лечения боли применяются препараты красного жгучего перца, механизм действия которых заключается в селективной стимуляции немиелинизированных С–волокон, вызывающей высвобождение субстанции Р и, возможно, других нейротрансмиттеров из терминалей ноцицепторов. Последовательное истощение запасов субстанции Р приводит к десенситизации ваниллоидных рецепторов и уменьшению ноцицептивной афферентации в центральную нервную систему. Местное применение капсаицина (алкалоида жгучего перца) в виде кожных мазей, кремов и трансдермальных систем оказалось эффективным в лечении как ноцицептивных скелетно-мышечных, так и невропатических болевых синдромов. Однако многие пациенты плохо переносят лечение капсаицинсодержащими препаратами из-за жжения, что снижает их комплайентность (приверженность проводимому лечению).
В отличие от жгучих разогревающих мазей Ваксикум крем («Верваг Фарма», Германия) содержит растительные компоненты, которые при нанесении на кожу вызывают умеренное местное раздражающее и выраженное обезболивающее действие при мышечно-тоническом и миофасциальном синдромах, а также улучшают микроциркуляцию в зоне ишемии и спазма. Эфирное камфорное масло, полученное из древесины камфорного дерева, издавна используется как антисептическое, охлаждающее средство в виде растираний и компрессов при скелетно-мышечных болевых синдромах. Фармакологи рассматривают камфору как важный представитель аналептических средств (при введении под кожу раствор камфоры в растительном масле тонизирует дыхательный центр, стимулирует сосудодвигательный центр). Камфора ингибирует агрегацию тромбоцитов, в связи с чем она рекомендована к применению для улучшения микроциркуляции. Кроме того, аромат камфорного масла обладает расслабляющим, успокаивающим действием. Экстракт розмарина оказывает умеренное согревающее действие, улучшает кровоснабжение в зоне ишемии. А эфирное масло лаванды узколистной обладает бактерицидным, ранозаживляющим и спазмолитическим действием. Вышеперечисленные компоненты крема Ваксикум взаимно потенцируют аналгетическое, спазмолитическое и сосудорасширяющее действие друг друга, не вызывая при этом неприятных ощущений и дискомфорта в зоне контакта с кожей ни у больных, ни у того, кто втирает Ваксикум крем в спину больного. Это позволяет использовать Ваксикум крем как на начальных этапах заболевания больными самостоятельно, так и в ходе комплексной терапии, например, при массаже и мануальной терапии для того, чтобы расслабить паравертебральные мышцы и восстановить в них микроциркуляцию при мышечно-тонических и миофасциальных синдромах, подготовить больного к мобилизационным воздействиям при фасеточном синдроме или к выполнению упражнений ЛФК.
Следует отметить, что на первом и втором этапах лечения пациенты с острыми болями в спине не нуждаются в обязательной консультации невролога или ревматолога и представляют контингент больных для врачей общей практики, а затем физиотерапевтов и специалистов по лечебной физкультуре. При острых скелетно-мышечных болях в спине нет необходимости в соблюдении постельного режима даже в первые дни заболевания, а также в использовании опоры при передвижении (трости или костыля). Необходимо убедить пациента, что небольшая физическая нагрузка не опасна, посоветовать поддерживать повседневную активность, а после купирования острого болевого синдрома как можно скорее приступить к работе, не забывая при этом о лечебной физкультуре, необходимой для предотвращения последующих эпизодов болей в спине [2, 4–8].
Дополнительным и наиболее эффективным малоинвазивным методом терапии скелетно-мышечных болей в спине на любом этапе лечения оказывается локальное инъекционное введение лекарственного препарата (блокада), обладающего противоотечным и противовоспалительным действием, в очаг воспаления и устойчивого мышечного спазма [2, 7, 10–13]. Такой способ введения применяется для местных анестетиков, а также НПВС и глюкокортикоидов эпидурально, фораминально, параартикулярно в фасеточные суставы, в миофасциальные триггерные точки и др.
При проведении лечебных блокад используется большой арсенал медикаментозных средств, что, с одной стороны, определяется фармакодинамикой и механизмом их действия, с другой — этиопатогенетическими особенностями развития боли. Применяемые препараты делятся на две группы: основные (базовые) и дополнительные. В связи с широким спектром действия в качестве базового средства для всех видов блокад (лечебных, диагностических или прогностических) наибольшее применение нашли местные анестетики. В качестве базовых средств для лечения неспецифической боли в спине используются глюкокортикоиды (дипроспан), применение которых основано на их противовоспалительном, десенсибилизирующем и противоотечном действии как локально в тканях, так и системно в организме [2, 10, 13]. Однако из–за системного действия глюкокортикоиды необходимо с осторожностью применять у пожилых пациентов, больных сахарным диабетом, гипертонической болезнью, заболеваниями ЖКТ, сердечной недостаточностью, со сниженным иммунным статусом и при инфекционных заболеваниях. Альтернативными дополнительными препаратами, лишенными побочных эффектов глюкокортикоидов, являются НПВС (мелоксикам, диклофенак, теноксикам, лорноксикам и др.), повышающие эффективность и длительность обезболивающего действия местных анестетиков за счет воздействия на механизмы патогенеза миофасциального болевого синдрома.
Помимо лечебных целей, в ряде случаев проведение блокад необходимо для диагностики и определения оптимальной стратегии последующего лечения. Так, например, диагностическая блокада фасеточного сустава или крестцово-подвздошного сочленения раствором местного анестетика (2% лидокаина или 0,5% новокаина) не только позволяет определить источник боли в спине, но и предсказать эффективность малоинвазивной нейрохирургической процедуры — высокочастотной денервации сустава [4, 11]. Понятно, что без НПВС и/или глюкокортикоида длительность обезболивающего действия анестетика составит всего лишь несколько часов, но в случае исчезновения у пациента после блокады болевого синдрома хотя бы на час мы можем уверенно говорить о том, что процедура денервации будет эффективна. В этом случае блокаду можно рассматривать как прогностическую.
Таким же образом определяется прогноз эффективности внутридисковой электротермической аннулопластики, лазерной вапоризации или холодноплазменной абляции межпозвоночного диска при радикулопатии. Если интрафораминальное введение анестетика под контролем компьютерной томографии устраняет болевой синдром, то проведение вышеуказанных малоинвазивных пункционных нейрохирургических воздействий может быть эффективным [9, 10, 12]. Следует отметить, что в ряде случаев достаточный терапевтический эффект имеет интрафораминальное введение вместе с местным анестетиком раствора глюкокортикоида (дипроспана), обеспечивающего патогенетическое воздействие на аутоиммунные и компрессионно-ишемические механизмы дискорадикулярного конфликта (противовоспалительное, противоотечное и ремиелинизирующее действие). Обычно фораминальной блокады бывает достаточно для того, чтобы уменьшить выраженность болевых ощущений и чувствительных (а иногда и двигательных) расстройств до следующего обострения радикулопатии. В случае недостаточной по времени эффективности лечебных фораминальных блокад и при условии наличия несеквестрированной латеральной (фораминальной) грыжи диска менее 7 мм проводится малоинвазивная процедура лазерной вапоризации (или ее модификации — фораминопластики), холодноплазменной абляции или внутридисковой электротермической аннулопластики, которая эффективна у 50–65 % пациентов [9]. Если и эта пункционная процедура не приводит к регрессу болевого синдрома, тогда производится оперативное нейрохирургическое вмешательство открытым доступом. Вопрос о проведении пункционных или открытых нейрохирургических вмешательств при болях в спине ставится в случае неэффективности правильно проводимой консервативной терапии в течение трех месяцев. К сожалению, нередко оперативное вмешательство проводится при отсутствии должных показаний (прогрессирующий парез иннервируемых пораженным корешком мышц конечности, тазовые нарушения, перемежающаяся хромота, вызванная стенозом позвоночного канала), что чревато формированием хронического постдискэктомического болевого синдрома, обусловленного множеством факторов (нарушением биомеханики движения в оперированном сегменте позвоночника, спаечным процессом, хроническим эпидуритом и т.п.) [2, 7, 8].
При хроническом течении болевого синдрома на третьем этапе лечения боли в спине применяются психотропные препараты из разряда антидепрессантов. Частое наличие депрессии у пациентов с хронической болью в спине послужило поводом к включению в стандарты терапии антидепрессантов, которые неожиданно оказались весьма эффективны в лечении всех видов хронической боли, независимо от наличия коморбидной депрессии. Более того, оказалось, что аналгетический эффект антидепрессантов развивается значительно раньше тимолептического, что побудило исследователей к поиску механизмов действия этой группы препаратов при болевых синдромах. Полагают, что антидепрессанты повышают активность эндогенной подавляющей боль (антиноцицептивной) системы мозга за счет повышения концентрации ключевых нейромедиаторов антиноцицептивной системы — серотонина и норадреналина [2, 8]. Ограничивающим фактором применения трициклических антидепрессантов в лечении хронических болей в спине является наличие выраженных побочных явлений (сонливость, потеря координации движений, повышение артериального давления, задержка мочи и т.д.) и синдрома отмены (возобновление болей, развитие тревоги, психомоторного возбуждения и даже судорожных припадков при резком прекращении приема этих лекарств). В связи с этим более безопасно назначение антидепрессантов из группы селективных ингибиторов обратного захвата серотонина, таких как эсциталопрам, не имеющих вышеуказанных побочных эффектов при доказанной эффективности в лечении хронической боли в спине и невропатической боли при радикулопатии [14].
Для активации регенеративных процессов в периферических нервах успешно применяется нейротропный комплекс Мильгамма® («Верваг Фарма», Германия), содержащий большие дозы витаминов группы В (В1, В6, B12) и лидокаин. Регенеративные свойства Мильгаммы основаны на фармакологических эффектах, характерных для высоких доз этих витаминов, не зависящих от их дефицита [4, 5, 14]. Одновременное применение тиамина (В1), пиридоксина (В6) и цианокобаламина (В12) влияет на стимуляцию аксоплазматической части транспорта структурных элементов мембраны или миелиновой оболочки, например холина. Тиамин способствует ремиелинизации через активацию фосфолипазы A, что усиливает гидролиз эфиров жирных кислот, кроме того, посредством усиления энергообеспечения в форме АТФ поддерживает аксоплазматический транспорт, что особенно важно для восстановления трофической функции нерва при множественном аксоплазматическом сдавлении (МАС-синдроме). Пиридоксин участвует в синтезе транспортных белков и сфингозина — структурного элемента мембраны нервного волокна и нейромедиаторов антиноцицептивной системы (серотонина, норадреналина). Цианокобаламин обеспечивает доставку жирных кислот для клеточных мембран и миелиновой оболочки. Применение витамина В12 способствует не только ремиелинизации (за счет активации реакции трансметилирования, обеспечивающей синтез фосфатидилхолина мембран нервных клеток), но и снижению интенсивности болевого синдрома, что связано с собственным антиноцицептивным действием высоких доз цианкобаламина. Таким образом, нейротропные компоненты Мильгаммы улучшают скорость проведения нервного импульса, улучшают репаративные процессы в периферическом нерве. Анестетик лидокаин в составе Мильгаммы предназначен для обеспечения безболезненности процедуры инъекции, что повышает комплайенс больных. Применяется схема лечения тоннельных невропатий, включающая курс из 10 внутримышечных инъекций Мильгаммы с последующим переходом на Мильгамма® таблетки 3 раза в день в течение 2–8 недель (в зависимости от тяжести невропатии) [4, 5]. В отличие от инъекционной формы Мильгаммы, Мильгамма® таблетки не содержит В12, длительный прием которого сопряжен с рядом побочных эффектов, поэтому может применяться в течение нескольких месяцев.
Получены данные об эффективности антиоксидантов (Тиогамма® («Верваг Фарма», Германия) 600 мг утром натощак за 30 минут до еды в течение 2 месяцев) в патогенетическом лечении чувствительных и двигательных расстройств у больных с радикулопатиями.
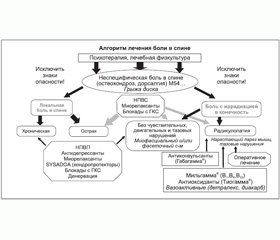
Стратегия лечения боли в спине должна включать в себя комплексный подход (рис. 1) в зависимости от клинических проявлений и стадии заболевания.
Необходимо также учитывать психологическое состояние пациента — наличие у него признаков тревоги и/или депрессии. Например, к тревожно-фобическим расстройствам относится необоснованный страх движения у пациента с болью в спине. Такое состояние обозначается как «кинезиофобия». У пациентов, страдающих ею, отмечаются скованность, замедленность, осторожность и ограничение амплитуды при движении. Как правило, кинезиофобия связана не столько с болью, сколько со страхом повредить позвоночник или конечность и спровоцировать обострение болезни. Пациенты, страдающие кинезиофобией, часто не могут наклониться вперед, опасаясь «смещения позвонков» и «сдавления корешков», полностью избегают положения сидя и стараются постоянно «держать спину прямой», а также выполняют ритуальные действия при одевании, раздевании, перемене положения тела. Основной целью такого ограничительного поведения, по мнению больных, является максимально возможное ограничение движений для предотвращения повреждения позвоночника. Такое поведение ведет, в свою очередь, к гипотрофии и укорочению мышц от бездействия. Поэтому попытки увеличить физическую активность в этом случае нередко приводят к нарастанию интенсивности боли из-за большей нагрузки на детренированные мышцы, что, в свою очередь, при отсутствии надлежащей психотерапевтической помощи и разъяснений со стороны врача может приводить к усилению страха перед физической активностью. Поведенческая и когнитивно-поведенческая психотерапия помогают скорректировать вышеуказанные неправильные, препятствующие выздоровлению представления пациента о природе своего заболевания, изменить социальное подкрепление болевого поведения, уменьшить зависимость от аналгетической терапии и увеличить уровень повседневной активности. Эта концепция легла в основу разработки психотерапевтических программ лечения боли — школ боли. При реализации этих программ результаты в лечении хронической боли наиболее высоки, так как в них используется комплексный подход, сочетающий в себе методы психотерапии, рефлексотерапии, лечебной физкультуры и фармакотерапии [2, 4–6, 8].
1. Алексеев В.В., Алексеева Л.И. Хондропротекторы в терапии неспецифической боли в спине // Российский журнал боли. — 2013. — № 1. — С. 31.
2. Алексеев В.В., Баринов А.Н., Кукушкин М.Л., Подчуфарова Е.В., Строков И.А., Яхно Н.Н. Боль: руководство для врачей и студентов / Под ред. Н.Н. Яхно. — М.: МедПресс, 2009. — 302 с.
3. Баринов А.Н. Сегментарные механизмы формирования мышечного спазма, спастичности и хронизации боли // Врач. — 2012. — № 5. — С. 17–23.
4. Баринов А.Н., Мурашко Н.К., Терентьева Н.В., Яворский В.В. Невропатическая боль при поражении периферической нервной системы: стратификация лечения // Медицинский совет. — 2013. — № 4. — С. 54–62.
5. Европейские рекомендации по лечению неспецифической боли в пояснично-крестцовой области в условиях первичной медицинской помощи: Реферат под науч. ред. Яхно Н.Н., Подчуфаровой Е.В. — М.: Практическая медицина, 2010. — 24 с.
6. Неспецифическая боль в нижней части спины: клинические рекомендации / Под ред. Ш.Ф. Эрдеса. — М.: КомплектСервис, 2008. — 70 с.
7. Павленко С.С. Боли в нижней части спины (эпидемиология, клинико-диагностическая классификация, современные направления в диагностике, лечении и стандартизации медицинской помощи): руководство. — Новосибирск: Сибмедиздат НГМУ, 2007. — 172 с.
8. Яхно Н.Н., Баринов А.Н., Подчуфарова Е.В. Невропатическая и скелетно-мышечная боль. Современные подходы к диагностике и лечению // Клиническая медицина. — 2008. — Т. 86, № 11. — С. 9–15.
9. Andersson G.B., Mekhail N.A., Block J.E. Treatment of intractable discogenic low back pain. A systematic review of spinal fusion and intradiscal electrothermal therapy (IDET) // Pain Physician. — 2006. — Vol. 9(3). — 237–248.
10. Benyamin R.M., Manchikanti L., Parr A.T. et al. The Efectiveness of Lumbar Interlaminar Epidural Injections in Managing Chronic Low Back and Lower Extremity Pain, Systematic Review // Рain Physician. — 2012. — Vol. 15, Issue 4. — E363–404.
11. Boswell M.V., Colson J.D., Sehgal N. et al. A systematic review of therapeutic facet joint interventions in chronic spinal pain // Pain Physician. — 2007. — Vol. 10(1). — 229–253.
12. Datta S., Everett C.R., Trescot A.M. et al. An updated systematic review of the diagnostic utility of selective nerve root blocks // Pain Physician. — 2007. — Vol. 10(1). — 113–128.
13. Manchikanti L., Buenaventura R.M., Manchikanti K.N. et al. Efectiveness of Therapeutic Lumbar Transforaminal Epidural Steroid Injections in Managing Lumbar Spinal Pain, Systematic Review // Рain Physician. — 2012. — Vol. 15, Issue 3. — E199–E245.
14. Mazza M., Mazza O., Pazzaglia C. et al. Escitalopram 20 mg versus duloxetine 60 mg for the treatment of chronic low back pain // Expert. Opin. Pharmacother. — 2010. — Vol. 11(7). — 1049–52.
15. Sayegh F.E., Kenanidis E.I., Papavasiliou K.A. et al. Efficacy of steroid and nonsteroid caudal epidural injections for low back pain and sciatica: a prospective, randomized, double-blind clinical trial // Spine. — 2009. — Vol. 34(14). —1441–7.
16. Singh G., Alekseeva L., Alexeev V., Triadaflopoulos G. Glucosamine-chondroitin sulfate reduces pain, disability and NSAID consumption in patients with chronic low back pain: a large, community-based, pilot, open prospective observational study // EULAR. — 2013. — SAT0419.
17. Agundez J.A., Garcia–Martin E., Martinez C. Genetically based impairment in CYP2C8– and CYP2C9-dependent NSAID metabolism as a risk factor for gastrointestinal bleeding: is a combination of pharmacogenomics and metabolomics required to improve personalized medicine? // Expert Opin. Drug Metab. Toxicol. — 2009. — 5. — 607–620.
18. Martinez C., Blanco G., Ladero J. et al. Genetic predispositions to acute gastrointestinal bleeding after NSAID use // Br. J. Pharmacol. — 2004. — 141. — 205–208.
19. Vianna-Jorge R., Perini J.A., Rondinelli E., Suarez-Kurtz G. CYP2C9 genotypes and the pharmacokinetics of tenoxicam in Brazilians // Clin. Pharmacol. Ther. — 2004. — 76. — 18–26.
20. Balague F., Mannion A.F., Pellisé F., Cedraschi C. Non-specifc low back pain // Lancet. — 2012. — V. 379. — Р. 482–491.
21. Prevalence and most common causes of disability among adults — United States // MMWR Morb. Mortal. Wkly. Rep. — 2009. — 58(16). — 421–6.
22. Wyatt J.E., Pettit W.L., Harirforoosh S. Pharmacogenetics of nonsteroidal anti-infammatory drugs // The Pharmacogenomics Journal. — 2012. — 12. — 462–467.

/91/91.jpg)
/95/95.jpg)