Журнал «Медицина неотложных состояний» 2 (57) 2014
Вернуться к номеру
Передумови ефективного використання екстракорпоральних технологій у лікуванні гострих отруєнь
Авторы: Шейман Б.С. - ДУ «Науковий центр превентивної токсикології, харчової та хімічної безпеки імені академіка Л.І. Медведя МОЗ України», м. Київ; Національна дитяча спеціалізована лікарня «Охматдит» МОЗ України, м. Київ; Проданчук М.Г. - ДУ «Науковий центр превентивної токсикології, харчової та хімічної безпеки імені академіка Л.І. Медведя МОЗ України», м. Київ; Волошина Н.О. - Національний медичний університет ім. О.О. Богомольця, м. Київ;
Постернак Г.І. - Луганський державний медичний університет
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
У статті наведені параметри токсикокінетики отруйних речовин, що мають важливе значення в питаннях вибору і призначення в комплексній терапії методів екстракорпоральної детоксикації для лікування гострих отруєнь. Визначені умови для ефективного застосування екстракорпоральних технологій із метою прискорення елімінації екзогенних токсинів з організму в цілому і з кров’яного русла зокрема.
В статье приведены примеры токсикокинетики отравляющих веществ, имеющих важное значение в вопросах выбора и назначения в комплексной терапии методов экстракорпоральной детоксикации для лечения острых отравлений. Определены условия для эффективного применения экстракорпоральных технологий с целью ускорения элиминации экзогенных токсинов из организма в целом и из кровяного русла в частности.
The article gives examples of toxicokinetics of toxic substances that are important in the selection and administration in the complex therapy of extracorporeal detoxification methods for the treatment of acute poisonings. There were determined conditions for the effective use of extracorporeal technologies to accelerate the elimination of exogenous toxins from the body as a whole and from the blood in particular.
гострі отруєння, токсикокінетика речовин, екстракорпоральні методи детоксикації, критерії ефективного застосування екстракорпоральних технологій.
острые отравления, токсикокинетика веществ, экстракорпоральные методы детоксикации, критерии эффективного применения экстракорпоральных технологий.
acute poisonings, substance toxicokinetics, extracorporeal detoxification methods, criteria for effective use of extracorporeal technologies.
Статья опубликована на с. 123-133
Вступ
Передумовами для ефективного використання методів екстракорпоральної детоксикації є знання процесу токсикокінетики токсичних речовин, їх фізико-хімічних характеристик та властивостей, системно-органної токсичності, метаболізму та шляхів елімінації, що дозволяє, у поєднанні зі знаннями про селективні детоксикаційні властивості різних екстракорпоральних технологій, вибрати найефективнішу з них та визначити її модальність. Серед найбільш важливих параметрів токсикокінетики отруйних речовин провідними є такі: об’єм розподілу отрути в організмі, доза і час напіввиведення отрути, зв’язок із білками крові, гідрофільність, гідрофобність і молекулярна маса токсиканту.
Об’єм розподілу отрути в організмі. Одним із найважливіших параметрів токсикокінетики отрути, що зумовлюють побудову стратегії лікування гострого отруєння, вибір тактики й виду детоксикаційної терапії, є об’єм розподілу отрути в організмі (Vd, л/кг). Цілком зрозуміло, що методи екстракорпоральної детоксикації в першу чергу здатні ефективно впливати на концентрацію отрути в кров’яному руслі, зокрема в плазмі крові, у зв’язку з чим багато авторів часто називають їх методами гемокорекції. У свою чергу, кількість отрути в плазмі крові зумовлюється її об’ємом розподілу (Vр, мг/л). Vp — це деякий умовний об’єм, у якому повинна була б розподілитися токсична речовина, якби її концентрація скрізь була такою ж, як у плазмі. Незважаючи на те, що Vp зазвичай не відповідає жодному реальному об’єму, цей показник є дуже важливим. Від нього залежить частка отрути, що перебуває у внутрішньосудинному просторі (у плазмі), і, у зв’язку з цим, доступність для органів, що відповідають за її елімінацію, а в нашому випадку — її доступність для ефективного використання методів екстракорпоральної детоксикації.
Найбільшу ефективність методи екстракорпоральної детоксикації демонструють при малих об’ємах розподілу отрути в організмі — менше 0,5 л/кг. У цих умовах істотна кількість отрути за допомогою тих або інших методів екстракорпоральної терапії може бути видалена як із плазми, так і з центральних компартментів через швидкий перерозподіл від них до фактичної «порожньої» плазми. Оперативне застосування екстракорпоральних технологій лікування на тлі малих об’ємів розподілу отрути зазвичай призводить до швидкого клінічного покращення постраждалих. При значних об’ємах розподілу токсичної речовини (понад 1 л/кг) отрута також за допомогою екстракорпоральних методів детоксикації може бути видалена з кров’яного русла. Проте її концентрація в плазмі крові після процедури буде набагато нижчою порівняно з такою в периферичних компартментах, що відбивається на повільній динаміці клінічної картини отруєння, асоціюється з недостатньою ефективністю детоксикаційної терапії. Слід зазначити, що навіть при значних об’ємах розподілу отрути й незначних (порівняно з прийнятою дозою) концентраціях токсичної речовини, видаленої за допомогою екстракорпоральних технологій з кров’яного русла, досягнуті детоксикаційні ефекти все ж таки заслуговують на увагу. По-перше, чим більша кількість отрути буде видалена з кров’яного русла, тим менша її кількість буде розподілена по периферичних компартментах, що неминуче відіб’ється на ступені тяжкості отруєння. По-друге, зменшення навіть незначної кількості токсичної речовини може впливати на характеристику прийнятої дози отрути в цілому, знижуючи її рангове місце в систематизації (наприклад, із летальної до токсичної або субтоксичної), що впливає на результат виходу з отруєння в цілому. І по-третє, екстракорпоральні технології, видаляючи отруту з кров’яного русла, захищають тим самим основні органи й системи фізіологічної елімінації токсинів (печінку, нирки, макрофагально-лімфоцитарну систему тощо), тобто виконують органопротекторну функцію.
Доза й час напіввиведення отрути. Концентрація токсикантів у крові перебуває в динамічній рівновазі з їх концентрацією в органах і тканинах, регулюючи їх утримування (акумуляцію) в компартменті. Утримування токсиканта в конкретному компартменті зазвичай має тимчасовий характер, при цьому є можливим перерозподіл токсиканта в інші тканини. Процеси утримування й акумуляції отрути засновані на різниці в швидкості абсорбції та елімінації. Токсичність різних речовин неоднакова. Токсичність речовини є інтегральною характеристикою, що відображає як дозу (концентрацію речовини в біологічному середовищі) й ушкоджувальну активність (токсичність) самої речовини, так і реакцію біологічної системи на цю речовину, тобто зумовлюється взаємодією ксенобіотика з біологічним об’єктом. Виходячи з цього, прояв і міра вираженості токсичності залежить, з одного боку, від прийнятої дози і властивостей токсиканта, з іншого — від стану й активності адаптаційних і антитоксичних властивостей біосистеми. Ці дві складові зумовлюють появу клінічної маніфестації отруєння та ступінь її тяжкості, які у своїй сукупності обґрунтовують показання до застосування екстракорпоральних методів детоксикаційної терапії.
Розрізняють наступні види доз отруйливої речовини:
— субпорогова доза — така, що не викликає фізіологічного ефекту за обраним показником;
— порогова доза — така, що викликає початкові прояви фізіологічної дії за реєстрованим показником;
— терапевтична доза — діапазон доз, що викликають лікувальний ефект в умовах експериментальної терапії;
— токсична доза — така, що викликає отруєння (клінічні прояви порушень функцій і структури організму);
— максимально переносима (толерантна) доза — така, що викликає отруєння без смертельних результатів;
— ефективна доза (ЕД) — така, що викликає програмований ефект у певному (заданому) відсотку випадків;
— доза ЛД50 — така, що викликає загибель 50 % піддослідних тварин;
— доза ЛД100 — така, що викликає загибель 100 % піддослідних тварин.
Дози токсичної речовини (з урахуванням біодоступності прийнятої кількості отрути), при яких можуть бути розглянуті показання до застосування методів екстракорпоральної терапії, відповідають токсичній максимально переносимій дозі, дозі ЛД50 і ЛД100. Біодоступність — частина дози отрути (%), що досягла системного кровотоку після позасудинного введення (не вся кількість токсиканта досягає системного кровотоку). При цих дозах показання до застосування методів екстракорпоральної детоксикації мають бути розглянуті навіть за відсутності клінічних симптомів отруєння (латентний період) або при проявах легкого або середнього ступеня тяжкості (період розпалу).
Важливо пам’ятати, що, незважаючи на широке вживання терміну «норма», у біології й медицині дотепер не існує його універсального визначення. Існуючі середньостатистичні дані не можуть бути достатніми критеріями розділення норми й патології. Статистична поширеність ознаки або явища не є достатньою підставою для визнання їх нормою, а абсолютизація середньостатистичних норм може привести до теоретичних і практичних помилок, до шаблону в клінічному мисленні (І.М. Трахтенберг, 2001). Ось чому середньостатистичний підхід має бути доповнений уявленням про норму як інтервал, у межах якого кількісні коливання психофізіологічних процесів здатні утримувати живу систему на рівні функціонального оптимуму, це оптимальна зона, у межах якої організм не переходить на патологічний рівень саморегуляції. Тобто відхилення від норми пов’язані не лише з самою природою біологічних показників, але й з індивідуальною мінливістю, індивідуальною специфікою біологічного об’єкта. Індивідуальна норма завжди конкретна й специфічна (І.М. Трахтенберг, 2001). Будь-яка жива система може існувати як така у своєму середовищі доти, доки її внутрішні сили здатні врівноважувати дію зовнішніх чинників, що безперервно порушують рівновагу (І.П. Павлов, 1909).
З огляду на вищевикладене можна зробити важливий висновок про те, що відсутність скарг і клінічних проявів у пацієнта, що могли б свідчити про ушкоджувальну дію ксенобіотика на організм, при виявленні підвищеного вмісту (вище за середньостатистичну норму) токсиканта в біологічних середовищах не може вказувати на гостре екзогенне отруєння, не дозволяє встановити діагноз гострого отруєння, а лише може свідчити про достатню активність адаптаційних і антитоксичних фізіологічних систем, що дозволяє забезпечити баланс гомеостазу в конкретного індивідуума. Так само, як і наявність токсикологічного анамнезу, клініко-параклінічної маніфестації гострого екзогенного отруєння при виявленні нормального вмісту (на рівні середньостатистичної норми) або незначних відхилень від норми токсиканта в біологічних середовищах може свідчити про гостре екзогенне отруєння, дозволяє верифікувати діагноз гострого отруєння і може свідчити про недостатність адаптаційних і антитоксичних фізіологічних систем індивідуума для забезпечення балансу гомеостазу.
Тривалість утримування токсичної речовини в окремому компартменті виражається періодом її біологічного напіврозпаду. Це період часу, протягом якого 50 % токсиканта виводиться з тканини або органу, при цьому відбувається його перерозподіл, транслокація в інші органи, тканини й біологічні рідинні сектори організму з подальшим потраплянням у кров’яне русло і виведенням з організму.
Токсиканти можна розділити на чотири основні групи відповідно до їх здатності утворювати з’єднання, переважного утримування й акумуляції в конкретному компартменті:
1. Розчинні в біологічних рідинах організму токсиканти, що рівномірно розподіляються залежно від умісту вологи в компартментах (в основному моновалентні катіони — літій, натрій, калій, рубідій і деякі аніони — хлор, бром).
2. Ліпофільні токсиканти, яким притаманна високою мірою властивість утворювати з’єднання з багатими на ліпіди органами (ЦНС) і тканинами (жирова тканина).
3. Токсиканти, що створюють колоїдні частки, які потім захоплюються клітинами макрофагально-лімфоцитарної системи органів і тканин, що фагоцитують (переважно три- й чотиривалентні катіони — лантанум, цезій, хафній).
4. Токсиканти, яким притаманна високою мірою властивість утворювати з’єднання з речовинами, що містяться в кістковій і сполучній тканинах (переважно двовалентні катіони — кальцій, барій, стронцій, радон, берилій, алюміній, кадмій, свинець).
Тривалість перебування токсичної речовини в кров’яному руслі зумовлюється її періодом напіввиведення (Т1/2, хв) — це час, за який сироваткова концентрація отрути під час стадії рівноваги зменшується удвічі.
Інформація про розподіл отрути в організмі, лінійну або нелінійну кінетику абсорбції й елімінації, частку та концентрацію токсичної речовини в кров’яному руслі, період напіввиведення як із кров’яного русла, так і з організму в цілому дозволяє визначити показання, кратність процедур та інтервали використання методів екстракорпоральної детоксикації.
Зв’язок із білками крові. Відомо, що більшість тих токсичних речовин, що надійшли в організм, утворюють комплекси або хімічні сполуки з білками, ліпопротеїдами, форменими елементами крові й іншими речовинами. Міцність комплексів або з’єднань, що утворилися в організмі, залежить від природи токсиканта і від типу зв’язків у вказаних комплексах або з’єднаннях. При взаємодії отрут із білками можуть утворюватися ковалентні, іонні, водневі, дипольні, диполь-дипольні зв’язки. Скріплення білкових речовин з отрутами може здійснюватися і за допомогою сил Ван-дер-Ваальса. Зі всіх перерахованих вище зв’язків ковалентні є найміцнішими.
З білкових речовин плазми крові альбумін найактивніше з’єднується з багатьма отруйними речовинами. Фібриноген, глобулін і деякі інші білкові речовини зв’язуються лише з незначною кількістю отрут. До речовин, які зв’язуються з альбуміном, відносяться сульфаніламідні препарати, ароматичні кислоти, йодумісні з’єднання (рентгеноконтрастні речовини), основні й кислотні фарбники, деякі нейтральні речовини (кумарини, глікозиди, нафтохінони, порфірини тощо).
Іони цинку й міді добре зв’язуються з глобуліном. Металеві отрути (катіони металів) утворюють міцні комплексні та внутрішньокомплексні з’єднання з амінокислотами, пептидами й білками. Стероїдні гормони зв’язуються з ліпопротеїдами, деякі антибіотики — з нуклеїновими кислотами, а оксид вуглецю — з гемоглобіном крові.
Лише незначне число токсикантів, що надійшли в організм, не зв’язується з альбуміном та іншими білками (етиловий ефір, глюкоза, сечовина та ін.).
Наявність зв’язків між отрутами й білками плазми крові та їх міцність необхідно враховувати при виборі екстракорпоральних технологій елімінації отруйних речовин із біологічних середовищ. Окрім вибору безпосередньо виду екстракорпорального лікування, міцність зв’язку отрути з білком і його вид у багатьох випадках обумовлює вибір модальності екстракорпоральної методики — пре- або постдилюція, поєднання діалізних і сорбційних технологій та ін. для створення оптимальних умови, що забезпечують розрив зв’язків між цими речовинами й білками.
Рівень приєднання токсиканта до білка зазвичай виражається у відсотках зв’язаної фракції.
Гідрофільність, гідрофобність і молекулярна маса отрути. Гідрофільність і гідрофобність — терміни, що характеризують спорідненість речовин або утворених ними тіл до води: ця спорідненість обумовлена силами міжмолекулярної взаємодії. Загальною мірою гідрофільності є енергія зв’язку молекул води з поверхнею тіла. Гідрофобність слід розглядати як малу міру гідрофільності, оскільки між молекулами води й будь-якого тіла завжди діятимуть більшою чи меншою мірою міжмолекулярні сили тяжіння.
Відомо, що більшість ксенобіотиків із малою молекулярною масою (менше 500 Да) і малими розмірами молекул (менше 10 нм) у результаті метаболізму стають менш гідрофільними, надходять у плазму крові, звідки вони видаляються нирками із сечею. Речовини більш гідрофільні, з великою молекулярною масою (понад 5000 Да) і середнім і великим розміром часток (10–200 нм або понад 200 нм), зазвичай виводяться через печінку із жовчю в кишечник і потім видаляються з організму.
Таким чином, гідрофільність або гідрофобність токсичної речовини, її (або продуктів її метаболізму) молекулярна маса, розміри молекул і часток багато в чому зумовлюють переважний шлях фізіологічної елімінації отрути з організму. Саме викладені характеристики токсиканта впливають та обумовлюють вибір технології екстракорпорального лікування, її поєднання з іншими видами інтракорпорального лікування та модальність. Проте ми не знайшли у медичній літературі систематизованої інформації про умови ефективного застосування діалізних технологій у лікуванні гострих отруєнь [2, 5–9, 22, 26–40].
Мета роботи — провести систематизацію літературних повідомлень щодо ефективності використання діалізних та гемофільтраційних технологій у лікуванні гострих отруєнь.
I. Гемодіалізні технології в лікуванні хворих із гострим отруєнням
Діалізна прескрипція, що застосовується за позанирковими показаннями (ендо- та/або екзогенні інтоксикації, гіперамоніємія або інші прояви дискоординації метаболізму), дещо відрізняється від такої в пацієнтів із нирковою недостатністю. У таких ситуаціях швидке очищення крові від отруйної речовини є першочерговим завданням. Саме тому необхідно мати добре працюючий судинний доступ, щоб отримати кровотік по артеріовенозній магістралі на рівні 10–15 мл/кг/хв. У таких пацієнтів дизеквілібріум-синдром практично не зустрічається, оскільки уремії (накопичення високоосмолярних сполук) немає. Але ці хворі зазвичай перебувають у тяжкому стані, у багатьох випадках мають внутрішньосудинний дефіцит об’єму (на момент госпіталізації за різними обставинами має місце летаргічний стан, погане живлення або блювота). До того ж нирки в них продовжують виконувати свої функції та процес сечовиділення певний час залишається на нормальному рівні. Зазначене спонукає клініциста до здійснення спостереження за внутрішньосудинним об’ємом та електролітним балансом постраждалого. У багатьох випадках виникає потреба у внутрішньовенній саплементації рідини та застосуванні пресорів для підтримки тиску під час діалізного лікування. Калій і бікарбонат у діалізаті слід підібрати так, щоб під час гемодіалізу не відбувалося виснаження калієм і не виникав метаболічний алкалоз. Слід уникати вживання діалізату з високим умістом кальцію. Рівень фосфору в плазмі крові може впасти, і тоді виникає потреба в його корекції. Досить часто виникає потреба у повторних тривалих за часом сеансах діалізної терапії. Слід також враховувати ребаунд (рикошет) метаболіту (екзотоксину та/або продуктів летального синтезу) після закінчення діалізу.
При застосуванні діалізних технологій у постраждалих з екзогенними інтоксикаціями слід пам’ятати про необхідність проведення всіх заходів медичної допомоги при гострих отруєннях (наказ МОЗ України № 897 від 20.10.2010 р. «Про затвердження клінічних протоколів надання медичної допомоги при гострих отруєннях») із використанням антидотних препаратів, проведення заходів з деконтамінації шлунка та ін. Діалізні технології мають переваги перед іншими існуючими методами екстракорпоральної детоксикації у видаленні низькомолекулярних речовин (з молекулярною масою менше 500 Да або з розміром молекул менше 10 нм), що в кров’яному руслі не зв’язуються з протеїнами або мають неміцні зв’язки з ними та мають невеликий об’єм розподілу в організмі. Крім цього, застосування діалізних технологій при гострих отруєннях може чинити позитивний вплив на метаболічні розлади, викликані всмоктуванням екзотоксину, на концентрацію продуктів летального синтезу.
Модальність гемодіалізних технологій
1. HD — гемодіаліз.
Характеристика процедури:
— високий ступінь елімінації низькомолекулярних речовин;
— фільтрація залежить від швидкості кровотоку;
— присутня зворотна фільтрація;
— погане виведення високомолекулярних сполук;
— складне технічне обладнання.
2. CAVHD — пролонгований артеріовенозний гемодіаліз.
Характеристика процедури:
— високий ступінь елімінації низькомолекулярних речовин;
— фільтрація залежить від швидкості кровотоку;
— присутня зворотна фільтрація;
— погане виведення високомолекулярних сполук;
— складне технічне обладнання;
— утруднений контроль балансу рідини;
— ризики кровотечі з артеріального доступу та підвищеного тромбоутворення.
3. CVVHD — пролонгований вено-венозний гемодіаліз.
Характеристика процедури:
— високий ступінь елімінації низькомолекулярних речовин;
— фільтрація залежить від швидкості кровотоку;
— присутня зворотна фільтрація;
— погане виведення високомолекулярних сполук;
— складне технічне обладнання;
— утруднений контроль балансу рідини.
Передумови ефективного використання діалізних технологій у лікуванні гострих отруєнь
Для ефективного застосування ГД із метою видалення екзотоксину та/або продуктів летального синтезу останні повинні мати такі кінетичні характеристики [3, 5, 6, 21, 22, 30, 33–35, 39–41]:
— відносна молекулярна вага < 500 Да;
— розмір молекул < 10 нм;
— малий об’єм розподілу (< 1 л/кг);
— слабкий зв’язок із протеїнами;
— кінетика пов’язана з одним компартментом;
— низький ендогенний кліренс (< 4 мл/хв–1 • кг–1).
Застосування перитонеального діалізу (ПД) для елімінації екзотоксину та/або продуктів летального синтезу з організму обмежується тільки тими випадками, коли метод ГД не може бути використаним у зв’язку з індивідуальними особливостями пацієнта або ГД у лікувальному закладі є недоступним.
Виведення екзотоксину та/або продуктів летального синтезу під час діалізу є клінічно значущим при виконанні двох основних умов:
— діалізний кліренс повинен не менше ніж на 30 % перевищувати ендогенний загальний плазмовий кліренс;
— об’єм розподілу екзотоксину та/або продуктів летального синтезу не повинен перевищувати 0,5 л/кг маси тіла (якщо Vd > 0,5 л/кг, то лише незначна фракція екзотоксину та/або продуктів летального синтезу знаходиться в кров’яному руслі і може бути виведена під час діалізу).
Показання щодо застосування діалізних технологій при гострих отруєннях
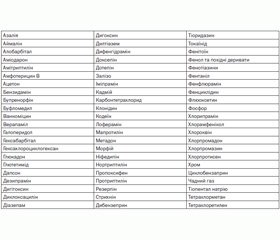
Токсичні речовини, щодо яких діалізні технології можуть бути використані при настанні гострого отруєння, подані в табл. 1–3.
II. Гемофільтраційні технології в лікуванні хворих із гострим отруєнням
Гемофільтрація (ГФ) — технологія, при якій у результаті різниці між тиском з кров’яного та некров’яного боку мембрани здійснюється конвекційне перенесення речовин через пори напівпроникної мембрани діаметром 200–250 нм. Виходячи з цих характеристик, за допомогою методу гемофільтрації можна ефективно видаляти з кров’яного русла значні об’єми плазмової води й речовин із відносною молекулярною масою від 500 до 40–70 тис. Да або з розміром часток переважно 10–200 нм та понад 200 нм. Для гемофільтрації на відміну від гемодіалізу на сьогодні чітко не визначено місце та роль у терапії гострих отруєнь. Більшість авторів вказують на ефективність використання гемофільтраційних технологій для елімінації з кров’яного русла токсичних субстанцій великого розміру (наприклад, аміноглікозидів, метал-хелатуючих комплексів). Залежно від тривалості та кратності процедур гемофільтраційні технології поділяються на безперервні (пролонговані) та інтермітуючі. Теоретично переваги інтермітуючої гемофільтрації порівняно зі звичайною діалізною технологією полягають у більш суттєвій елімінації високомолекулярних речовин, що погано видаляються гемодіалізом. Проте потреба у великих об’ємах стерильної заміщуючої рідини, необхідність точного механізму для контролю балансу рідини й підвищена вартість методу обмежили популярність лікування з використанням гемофільтрації в США [13].
Безперервні (пролонговані) методи гемофільтраційних технологій (CRRT) виявилися ефективними в першу чергу в лікуванні хворих із гострим пошкодженням нирок, критичною гіпергідратацією, що супроводжується синдромом поліорганної недостатності, гемодинамічною нестабільністю. До сьогодні ці методи довели свою ефективність і в лікуванні ряду гострих отруєнь ксенобіотиками. Методи пролонгованої гемофільтрації включають 2 основних різновиди: безперервну артеріовенозну гемофільтрацію (CAVHF) та безперервну вено-венозну гемофільтрацію (CVVHF), що можуть застосовуватися з паралельним введенням інфлюенту в екстракорпоральний контур у режимі предилюції (до масообмінника), постдилюції (після масообмінника), пре- та постдилюції одночасно і без паралельного введення інфлюенту.
Зазвичай за сеанс видаляють 25–30 л ультрафільтрату й заміщують його необхідною кількістю стерильного розчину.
Безперервні методи гемофільтрації порівняно недавно увійшли до клінічної практики в ролі методів детоксикаційної терапії. Вони були використані також і при гострих отруєннях алкоголями, літієм, мепробаматом, метанолом, метотрексатом, гербіцидом, прокаїнамідом, талієм. При цьому опубліковані авторами інформаційні повідомлення про отримані результати лікування є неоднозначними і, відповідно, їх роль у лікуванні гострих отруєнь чітко не визначена. Та все ж найбільшу ефективність методи безперервної гемофільтрації продемонстрували в лікуванні гострих отруєнь, при яких токсична речовина мала значні об’єми розподілу в організмі. При отруєнні токсикантами, що мали малий об’єм розподілу, які вимагають видалення з кров’яного русла великих кількостей отрути в найкоротший термін, ці методи виявилися найменш ефективними.
Таким чином, у двох ситуаціях конвекційні процедури мають певні переваги перед іншими технологіями екстракорпоральної детоксикації: перша — при гострому отруєнні, яке супроводжується високою концентрацією токсиканта, що приводить до насичення всіх місць зв’язування токсичної речовини і, тим самим, до підвищення її концентрації у вільній циркуляції в плазмі. У цьому випадку вільноциркулююча фракція легше елімінується з кров’яного русла методом постійної (пролонгованої) гемофільтрації. Друга ситуація — коли молекулярна маса токсичного агента є дуже великою для ефективного видалення дифузійними методами (наприклад, у випадку з міоглобіном, молекулярна маса якого 17 000 Да).
Модальність гемофільтраційних технологій
У 1977 р. P. Kramer запропонував проводити безперервну артеріовенозну гемофільтрацію. Швидкість ультрафільтрації (УФ) при пролонгованих технологіях гемофільтрації зазвичай становить 8–12 мл/хв. Технологію проводять безперервно протягом декількох діб. Серед різновидів пролонгованих технологій розрізняють такі: CАVHF — пролонгована артеріовенозна гемофільтрація; SCUF — повільна пролонгована ультрафільтрація; CVVHF — пролонгована вено-венозна гемофільтрація; CVVHDF — пролонгована вено-венозна гемодіафільтрація; CVVHDF (dil.) — пролонгована вено-венозна гемодіафільтрація з дилюцією.
Перевагами пролонгованих режимів технологій гемофільтрації порівняно з інтермітуючим короткотривалим гемодіалізом є добра переносимість УФ (збільшення серцевого викиду та підвищення АТ), достатньо високий кліренс токсичних речовин із молекулярною масою від 500 до 17000 Да або розміром молекул від 10 до 200 нм, висока біосумісність (через мінімальний контакт крові з мембраною), можливість проведення повного парентерального харчування, у тому числі й ведення необхідних ліків під час процедури.
Інтермітуючі режими технологій гемофільтрації порівняно з пролонгованими слід застосовувати переважно для елімінації з кров’яного русла токсичних речовин із молекулярною масою від 500 до 17000 Да або розміром молекул від 10 до 200 нм, що мають великий об’єм розподілу (> 1 л/кг), нелінійну кінетику елімінації токсиканту з періодами (відповідно до характеристик токсикокінетики токсиканта) максимального накопичення речовини в кров’яному руслі.
1. CАVHF — пролонгована артеріовенозна гемофільтрація.
Характеристика:
— Позитивні риси: технічно нескладна методика виконання.
— Негативні риси: залежність фільтрації від швидкості кровотоку (зниження ефективності); необхідність артеріального доступу (загроза кровотечі, тромбоутворення).
2. SCUF — повільна пролонгована ультрафільтрація.
Характеристика:
— Позитивні риси: немає артеріального доступу, достатній рівень кровотоку, достатньо високий рівень фільтрації.
— Негативні риси: складна техніка, значна вартість технології, утруднений контроль за балансом рідини.
3. CVVHF — пролонгована вено-венозна гемофільтрація.
Характеристика:
— Позитивні риси: немає артеріального доступу, достатній рівень кровотоку, високий рівень елімінації речовин із високомолекулярною масою, достатньо високий рівень фільтрації.
— Негативні риси: складна техніка, значна вартість технології, утруднений контроль за балансом рідини.
4. CVVHDF — пролонгована вено-венозна гемодіафільтрація.
Характеристика:
— Позитивні риси: немає артеріального доступу, достатній рівень кровотоку, високий рівень елімінації речовин із високо- та низькомолекулярною масою, достатньо високий рівень фільтрації.
— Негативні риси: складна техніка, значна вартість технології, утруднений контроль за балансом рідини.
5. CVVHDF (dil.) — пролонгована вено-венозна гемодіафільтрація з дилюцією.
Характеристика:
— Постдилюція: значні рівні кліренсу речовин із молекулярною масою 500–17 000 Да, незначні об’єми інфлюенту.
— Предилюція: значні рівні кліренсу речовин із молекулярною масою 500–17 000 Да, незначні ризики тромбозу гемофільтру, значна вартість технології.
Передумови ефективного використання гемофільтраційних технологій у лікуванні гострих отруєнь
Видалення (фільтрація) екзотоксину та/або продуктів летального синтезу під час процедури гемофільтрації повинно становити істотне доповнення до природного механізму їх елімінації з організму (з урахуванням процесів метаболізму отруйної речовини в організмі, стану антитоксичних адаптогенних систем пацієнта, елімінаційних властивостей печінки, кишечника та нирок щодо конкретного екзотоксину та/або продуктів летального синтезу).
Для ефективного застосування пролонгованих гемофільтраційних технологій із метою видалення екзотоксину та/або продуктів летального синтезу останні повинні мати такі кінетичні характеристики:
— відносна молекулярна маса від 500 до 17000 Да;
— розмір молекул або часток від 10 до 200 нм;
— незначний об’єм розподілу (від 0,5 до 1,0 л/кг);
— лінійна кінетика елімінації токсиканта;
— слабкий зв’язок із протеїнами;
— кінетика пов’язана з одним або кількома компартментами;
— низький ендогенний кліренс (< 4 мл/хв–1 • кг–1).
Режим предилюції під час процедури гемофільтрації доцільно застосовувати для підвищення ефективності видалення токсиканта в таких випадках:
— наявність клінічних ознак тяжкого перебігу гострого отруєння;
— значні рівні прийнятої дози токсичної речовини (яка відповідає LD50 або LD100 або наближається до неї);
— значні рівні концентрації токсичної речовини (що відповідає LD50 або LD100 або наближається до неї);
— наявні (відомі) гідрофільні властивості отруйної речовини (або її токсичних метаболітів);
— наявні (відомі) неміцні зв’язки токсиканта з протеїнами плазми крові;
— лінійна кінетика елімінації токсиканта.
Виведення екзотоксину та/або продуктів летального синтезу під час гемофільтрації є клінічно значущим при виконанні таких умов:
— фільтраційний кліренс повинен не менше ніж на 30 % перевищувати ендогенний загальний плазмовий кліренс; або
— доза елімінованого токсину за час проведення гемофільтраційної технології є такою, що разом з ендогенним загальним плазмовим кліренсом впливає на характеристику концентрації отруйної речовини в кров’яному руслі, змінюючи її, наприклад, із рівня LD100 на LD50;
— об’єм розподілу екзотоксину та/або продуктів летального синтезу не повинен перевищувати 1 л/кг маси тіла (якщо Vd > 1 л/кг, то лише незначна фракція екзотоксину та/або продуктів летального синтезу знаходиться в кров’яному руслі і може бути виведена під час гемофільтрації).
Необхідно чітко розуміти, що гемофільтраційні технології не тільки можуть бути використані для прискорення елімінації токсичної речовини з організму людини, але й можуть застосовуватися при виникненні в пацієнта патологічних реакцій унаслідок порушення гомеостатичних функцій, метаболізму та водно-електролітного балансу. Саме тому слід розрізняти показання до застосування цих технологій у лікуванні гострих отруєнь для прискорення процесу елімінації токсичної речовини та такі, які використовуються для корекції порушень гомео–стазу, що можуть виникати під час перебігу гострого отруєння.
При гострому отруєнні, якщо об’єм розподілу екзотоксину та/або продуктів летального синтезу перевищує 1 л/кг маси тіла, є доцільним застосування пролонгованих гемофільтраційних технологій із режимом постдилюції за таких умов:
— токсикогенна стадія гострого отруєння;
— лінійна характеристика кінетики та елімінації токсиканта;
— прийнята доза токсиканта (або його концентрація в сироватці крові) є такою, що відповідає летальній або сублетальній;
— накопичення токсиканта в кров’яному руслі переважно у вільній циркуляції;
— період напіввиведення токсичної речовини з організму більше 24 год;
— доза елімінованого токсину за час проведення гемофільтраційної технології є такою, що разом з ендогенним загальним плазмовим кліренсом впливає на характеристику концентрації отруйної речовини в кров’яному руслі, змінюючи її, наприклад, із рівня LD100 на LD50.
Показання щодо застосування фільтраційних технологій при гострих отруєннях
Токсичні речовини, щодо яких фільтраційні технології можуть бути використані при настанні гострого отруєння, подані в табл. 4.
Висновки
Передумовами для ефективного використання екстракорпоральних технологій в клінічній токсикології є знання процесів токсикокінетики токсикантів, їх фізико-хімічних характеристик і властивостей, системно-органної токсичності, метаболізму й шляхів елімінації, що дозволяє, поряд із інформацією про селективні детоксикаційні властивості методів екстракорпорального лікування, вибрати найефективнішу з них і визначити її опції та модальність.
1. Agarwal R., Cronin R.E. Heterogeneity in gentamicin clearance between high-efficiency hemodialyzers // Am. J. Kidney Dis. — 1994. — 23. — 47-51 (A).
2. Agha-Razii M. et al. Continuous veno-venous hemodiafiltration for the treatment of spontaneous tumor lysis syndrome complicated by acute renal failure and severe hyperuricemia // Clin. Nephrol. — 2000. — 54(1). — 59-63.
3. Babb A.L., Farrell P.C., Uvelli D.A., Scribner B.H. Hemodialyzer evaluation by examination of solute molecular spectra // ASAIO Trans. — 1972. — 18. — 98-105, 122 (B).
4. Bunchman T.E. et al. Continuous arterial-venous diahemofiltration and continuous veno-venous diahemofiltration in infants and children // Pediatr. Nephrol. — 1994. — 8. — 96-102.
5. Burgess E. Prolonged hemodialysis in methanol intoxication // Pharmacotherapy. — 1992. — 12(3). — 238-9.
6. Chow M.T. et al. Hemodialysis-induced hypophosphatemia in a normophosphate-mic patient dialyzed for ethylene glycol poisoning: treatment with phosphorus-enriched hemodialysis // Artif. Organs. — 1998. — 22. — 905-907.
7. Chow M.T. et al. Treatment of acute methanol intoxication with hemodialysis using an ethanol-enriched, bicarbonate-based dialysate // Am. J. Kidney Dis. — 1997. — 30. — 568-570.
8. Church E. Lab testing in alcohol, methanol, ethylene glycol, isopropanol toxicities // J. Emerg. Med. — 1997. — 15(5). — 687-692.
9. Ellenhorn M.J., Barceloux D.G. Medical Toxicology: Diagnosis and Treatment of Human Poisoning. — New York: Elsevier, 1988. — 440-461.
10. Davenport A. Hemofiltration in patients with fulminant hepatic failure // Lancet. — 1991. — № 338. — P. 1604-1608.
11. Susan R. Mendley. Acute Dialysis in Children // Principles and Practice of Dialysis. Ed. Henrich, William L. — 4th еd. — 2009. — 641-650;
12. Fleming F. et al. Renal replacement therapy after repair of congenital heart disease in children. A comparison of hemofiltration and peritoneal dialysis // J. Thorac. Cardiovasc. Surg. — 1995. — 109(2). — 322-331.
13. Handbook of Dialysis / Eds J.Т. Daugirdas, T.І. Ing. — 2nd ed. — 1994. — P. 196.
14. Honoré P.M., Joannes-Boyau O., Merson L. et al. The big bang of hemofiltration: the beginning of a new era in the third millennium for extracorporeal blood purification! // Int. J. Artif. Organs. — 2006. — Vol. 29, № 7. — P. 649-659.
15. Jaing T.H. et al. Tumor lysis syndrome in an infant with Langerhans cell histiocytosis successfully treated using continuous arteriovenous hemofiltration // J. Pediatr. Hematol. Oncol. — 2001. — 23(2). — 142-144.
16. Latta K. et al. Continuous arteriovenous haemofiltration in critically ill children // Pediatr. Nephrol. — 1994. — 8. — 334-337.
17. Paret G. et al. Continuous arteriovenous hemofiltration after cardiac operations in infants and children // J. Thorac. Cardiovasc. Surg. — 1992. — 104. — 1225-1230.
18. Riegel W., Habicht A., Ulrich C., Kohler H. Hepatoactive substances eliminated by continuous venovenous hemofiltration in acute renal failure patients // Kidney Int. — 1999. — Vol. 56 (suppl. 72). — P. 67-70.
19. Ronco C. et al. Acute renal failure in infancy: treatment by continuous renal replacement therapy // Intensive Care Med. — 1995. — 21. — 490-499.
20. Sakarcan A. et al. Hyperphosphatemia in tumor lysis syndrome: the role of hemodialysis and continuous veno-venous hemofiltration // Pediatr. Nephrol. — 1994. — 8. — 351-353.
21. Schoumacher R., Chevalier R., Gomez R. et al. Enhanced clearance of vancomycin by hemodialysis in a child // Pediatr. Nephrol. — 1989. — 3. — 83-85.
22. Seyffart Günter. Poison Index: The Treatment of Acute Intoxication. — Lengerich; Berlin; Dusseldorf; Leipzig; Riga; Scottsdale (USA); Wien; Zagreb: Pabst, 1997. — 673 p.
23. Zobel G. et al. Continuous extracorporeal fluid removal in children with low cardiac output after cardiac operations // J. Thorac. Cardiovasc. Surg. — 1991. — 101. — 593-597.
24. Zobel G. et al. Continuous renal replacement therapy in critically ill neonates // Kidney Int. — 1998. — 53 (Suppl 66). — S169-S173.
25. Алексеев Г.И., Бидерман Ф.М. Организационно-тактические и лечебные аспекты неотложной помощи при острых отравлениях // Неотложные состояния в клинике внутренних болезней: Докл. VI Всероссийского съезда терапевтов. — Горький, 1990. — С. 257-258.
26. Амберт Э. Избирательная токсичность: Пер. с англ. — М.: Мир, 1971. — 227 с.
27. Бидерман Ф.М., Сосюкин А.Е. Концентрационные критерии рациональной инфузионной терапии тяжелых форм острых пероральных отравлений // Инфузионная терапия неотложных состояний. — Л.: Медицина, 1990. — С. 23-27.
28. Виллерт О.Х., Баботина И.К., Андреев A.M., Белокуров А.Ю. Инфузия 37 л жидкости в сутки при остром отравлении // Анестезиология и реаниматология. — 1983. — № 6. — С. 60-61.
29. Глозман О.С, Касаткина А.П. Детоксикационная терапия при острых отравлениях и аутоинтоксикациях. — Ташкент: Медицина, 1970. — 320 с.
30. Голиков С.Н., Саноцкий И.В., Тиунов Л.А. Общие механизмы токсического действия. — Л.: Медицина, 1986. — 280 с.
31. Гудивок И.И., Волошинский А.В., Харенко Т.Р., Палийчук Ю.Р. Клинические аспекты лимфогенной экстракорпоральной детоксикации при острых эндотоксикозах // Экстракорпоральная детоксикация и гемокоррекция в клинической практике: Тр. Воен.-мед. акад. — Т. 223. — СПб.: ВМедА, 1993. — С. 81-84.
32. Лопаткин Н.Д., Лопухин Ю.М. Эфферентные методы в медицине. — М.: Медицина, 1989. — С. 350.
33. Лужников Е.А., Гольдфарб Ю.С. Актуальные проблемы диагностики и лечения острых экзогенных отравлений // Терапевт. арх. — 1996. — Т. 68, № 10. — С. 74-79.
34. Лужников Е.А., Гольдфарб Ю.С, Мусселиус С.Г. // Анестезиология и реаниматология. — 1993. — № 1. — С. 55-66.
35. Лужников Е.А., Гольдфарб Ю.С. Физиогемотерапия при острых экзо- и эндотоксикозах. — М., 1991. — С. 5-14.
36. Лужников Е.А., Костомарова Л.Г. Острые отравления. — М.: Медицина, 1989. — С. 432.
37. Лужников Е.А., Ярославский А.А., Мусселиус С.Г., Барсуков Ю.Р. Применение перитонеального диализа при лечении тяжелых форм отравлений, осложненных экзотоксическим шоком // Анестезиология и реаниматология. — 1977. — № 1. — С. 82-85.
38. Маркова И.В., Афанасьев В.В., Цыбулькин Э.К., Неженцев М.В. Клиническая токсикология детей и подростков. — СПб.: Интермедика, 1998. — С. 302.
39. Сосюкин А.Е. Сорбционно-диализная терапия при острых пероральных отравлениях фосфорорганическими инсектицидами // Экстракорпоральная детоксикация и гемокоррекция в клинической практике: Тр. Воен.-мед. акад. — Т. 223. — СПб.: ВМедА, 1993. — С. 37-42.
40. Цыбулькин Э.К. Активная детоксикационная терапия // Клиническая токсикология детей и подростков / Под ред. И.В. Марковой и др. — СПб.: Интермедика, 1998. — С. 105-110.

/128/128.jpg)
/129/129.jpg)
/130/130.jpg)
/132/132.jpg)