Журнал «Медицина неотложных состояний» 2 (57) 2014
Вернуться к номеру
Особенности диагностики нарушений гемостаза и оптимизация инфузионной терапии при тяжелом течении деструктивного панкреатита
Авторы: Тарабрин О.А., Щербаков С.С. - Одесский национальный медицинский университет
Рубрики: Медицина неотложных состояний, Хирургия
Разделы: Клинические исследования
Версия для печати
В работе патогенетически обосновываются и апробируются способы повышения эффективности лечения деструктивного панкреатита с помощью экспресс-диагностики и коррекции нарушений гемостаза, а также проанализирован клинический опыт применения многокомпонентного, полиионного, коллоидно-гиперосмолярного раствора нового поколения Гекотон в комплексном лечении панкреатического шока. Исследование проведено у 86 больных с тяжелыми формами ОДП. Состояние системы гемостаза оценивали с помощью показателей анализатора АРП-01 «Меднорд» (низкочастотная пьезоэлектрическая тромбоэластография, НПТЭГ), классическими лабораторными тестами. Использование метода тромбоэластографии позволило своевременно оценить нарушения гемостаза в остром периоде деструктивного панкреатита, с минимальными материальными затратами в короткие сроки, непосредственно у постели больного. Специфическая коррекция нарушений гемостаза при деструктивном панкреатите посредством воздействия на ключевые патогенетические факторы с помощью Гекотона, целевого назначения НПТЭГ с разным механизмом действия, Латрена, трасилола, свежезамороженной плазмы и лечебного плазмафереза позволяет уменьшить частоту легочных осложнений в 1,7 раза, сокращает время пребывания в стационаре на 23 %, а также снижает летальность на 30,9 % при тяжелом течении заболевания.
У роботі патогенетично обґрунтовуються і апробуються способи підвищення ефективності лікування деструктивного панкреатиту за допомогою експрес-діагностики і корекції порушень гемостазу, проаналізовано клінічний досвід застосування багатокомпонентного, полііонного, колоїдно-гіперосмолярного розчину нового покоління Гекотон у комплексному лікуванні панкреатичного шоку. Дослідження проведено у 86 хворих із тяжкими формами ОДП. Стан системи гемостазу оцінювали за допомогою показників аналізатора АРП-01 «Меднорд» (низькочастотна п’єзоелектрична тромбоеластографія, НПТЕГ), класичними лабораторними тестами. Використання методу тромбоеластографії дозволило вчасно оцінити порушення гемостазу в гострому періоді деструктивного панкреатиту, з мінімальними матеріальними витратами в короткий термін, безпосередньо біля ліжка хворого. Специфічна корекція порушень гемостазу при деструктивному панкреатиті за допомогою впливу на ключові патогенетичні фактори за допомогою Гекотону, цільового призначення НПТЕГ із різним механізмом дії, Латрену, трасилолу, свіжозамороженої плазми й лікувального плазмаферезу дозволяє зменшити частоту легеневих ускладнень в 1,7 раза, скорочує час перебування в стаціонарі на 23 %, а також знижує летальність на 30,9 % при тяжкому перебігу захворювання.
The paper pathogenetically substantiates and approves ways to improve the efficacy of treatment for destructive pancreatitis using rapid diagnosis and correction of hemostasis disorders, as well analyzes the clinical experience of application Gekoton, a multi-component, polyion colloid hyperosmolar solution of new generation, in the complex treatment of pancreatic shock. The study was conducted in 86 patients with severe forms of acute destructive pancreatitis. The hemostatic system was evaluated using indicators of analyzer ARP-01 Mednord (low-frequency piezoelectric thromboelastography, LPTEG), classical laboratory tests. Using the method of thrombelastography enables to evaluate timely the hemostatic disorders in acute period of destructive pancreatitis, with minimal material costs in the short term, at the bedside. Specific correction of hemostatic disorders in destructive pancreatitis by acting on the key pathogenetic factors using using Gekoton, purpose use of LPTEG with different mechanisms of action, Latren, trasylol, fresh frozen plasma and therapeutic plasmapheresis can decrease the incidence of pulmonary complications by 1.7 times, reduces the duration of hospital stay by 23 %, as well as and reduces mortality by 30.9 % in severe course of disease.
Статья опубликована на с. 40-44
В структуре заболеваемости острым панкреатитом растет число деструктивных его форм, летальность при которых, по данным разных авторов, варьирует от 8 до 70 % из-за развития тяжелой эндогенной интоксикации и формирования полиорганной недостаточности [1, 12]. В патогенезе острого панкреатита значительное место занимают нарушения системы гемостаза, которые проявляются развитием тромбозов и/или геморрагий. Сложность патологии объясняет существование различных, порой противоположных взглядов на состояние системы гемостаза при ранних формах острого деструктивного панкреатита (ОДП) [3, 6]. Остаются спорными вопросы прогнозирования течения и исходов ОДП, выбора методов и режимов терапии, мониторинга деструктивных процессов в железе.
В этом контексте неудивительно, что наряду с вопросами диагностики и хирургической тактики продолжает активно обсуждаться проблема интенсивной терапии. Устранение волемических расстройств является одной из задач базисной интенсивной терапии у пациентов с ОДП. Наиболее адекватно она решается в ходе инфузионной терапии использованием волемически активных плазмозаменителей. За последнее десятилетие во многих странах мира класс препаратов на основе гидроксиэтилированного крахмала занял лидирующее положение среди коллоидных объемзамещающих растворов, отодвинув на второй план плазмозамещающие средства на основе декстрана и желатина [2, 7].
Неуклонный рост заболеваемости острым панкреатитом, особенно его деструктивными формами, высокий уровень летальности и большое число осложнений, нередко приводящих к тяжелым нарушениям функции органа вплоть до инвалидизации, а также существующие сложности диагностики и отсутствие единого подхода к лечению этого заболевания заставляют обращать особое внимание на изучение данной патологии.
Цель исследования — патогенетически обосновать и апробировать способы повышения эффективности лечения деструктивного панкреатита с помощью экспресс–диагностики и коррекции нарушений гемостаза, а также проанализировать клинический опыт применения многокомпонентного, полиионного, коллоидно–гиперосмолярного раствора Гекотон в комплексном лечении панкреатического шока.
Материалы и методы
Исследование проведено у 86 больных с тяжелыми формами ОДП, которые были разделены на 2 группы: 1-я группа (n = 32) — больные с традиционным ведением деструктивного панкреатита; 2-я группа (n = 54) — пациенты, которым дополнительно проводилась специфическая коррекция выявленных коагуляционных расстройств. Полученные данные сравнивались с данными в группе контроля, 25 практически здоровых лиц (доноры). Распределение больных в 1-й и 2-й группах по возрасту, полу, тяжести заболевания и осложнениям острого панкреатита было достаточно сопоставимо. Во всех случаях наличие панкреатического шока было установлено на основании клинического и инструментальных методов обследования. Средний балл тяжести по шкале SAPS II в 1-й группе составил 33,6 ± 9,2, во 2-й группе — 34,1 ± 8,4 балла. Через 1–2 суток больным делали лапаротомию, носившую санационный характер. Состояние системы гемостаза оценивали с помощью показателей анализатора АРП-01 «Меднорд» (низкочастотная пьезоэлектрическая тромбоэластография — НПТЭГ), который согласно данным литературы [4, 5] позволяет качественно оценить состояние всей системы гемостаза, а не уровень ее отдельных параметров. Предварительно было установлено, что данные показатели гемостаза коррелируют с показателями, определяемыми классическими лабораторными тестами. Эффективность проводимой ИТ оценивали по динамике показателей системы гемостаза, амилолитической активности крови и экссудата из брюшной полости на 1-е, 3-и, 5-е, 7-е сутки от начала заболевания, характеру осложнений, длительности лечения в отделении АРИТ и койко-дня в стационаре, по летальности и ее причинам.
Результаты и их обсуждение
Уже в первые 24 часа у больных с деструктивным панкреатитом наблюдались существенные сдвиги в составных звеньях системы гемостаза, причем они имели неоднозначный характер (табл. 1).
За первые 24 часа в среднем на 15 % увеличивается интенсивность спонтанной агрегации тромбоцитов (An) и их ретрактильная способность. Время начала образования сгустка (r) уменьшается на 70 %, а константа тромбина (k) — на 25 %. Интенсивность тромбинообразования (Kk) увеличивается на 73 %. В результате максимальная плотность сгустка (АМ) увеличивается на 14 %. При этом время образования фибрин-тромбоцитарной структуры сгустка (Т) значимо не изменяется.
К 3-м суткам константа тромбина (k) уменьшается в среднем на 30 %, плотность сгустка увеличивается на 20 %. Фибринолитическая активность (F) уменьшается на 60 %. Несмотря на имеющуюся гемоконцентрацию по данным исследования гематокрита (Ht = 0,49 ± 0,05) и повышение показателя An НПТЭГ, число тромбоцитов в крови оказалось несколько сниженным и составило 184,5 ± 29,3 • 109/л (Р > 0,05). На повышение агрегационной активности последних указывало увеличение показателя r НПТЭГ.
Через 7 суток от начала заболевания показатель r остается в среднем на 10 % меньше, чем в контроле, константа тромбина и максимальная плотность сгустка существенно не изменяются. Интенсивность тромбинообразования и спонтанная агрегация тромбоцитов остаются повышенными на 40 и 15 % соответственно. Показатель активности фибринолиза увеличивается на 53 % по сравнению с первыми сутками, но остается ниже контрольных значений на 35 %. Показатели коагуляционного гемостаза у пациентов с деструктивным панкреатитом отражали выраженный гиперкоагуляционный сдвиг, отчетливо проявлявшийся изменениями всех хронометрических и структурных параметров НПТЭГ, хотя не все из них статистически достоверны. Изменения показателей биохимических тестов коагулограммы имели разнонаправленный характер: протромбиновое время (ПВ) увеличивалось с 15,4 ± 0,3 с до 16,2 ± 0,4 с (Р < 0,05), тромбиновое время (ТВ) практически не изменилось, а показатель АЧТВ снизился с 44,6 ± 0,8 с до 35,7 ± 1,2 с (Р < 0,05). Эти изменения свидетельствовали не только о гиперкоагуляции, но и о развитии острого диссеминированного внутрисосудистого свертывания (ДВС) крови с признаками коагулопатии потребления. Обращает на себя внимание выраженная активация фибринолиза. По сравнению со здоровыми лицами значение показателя F НПТЭГ возросло. Повышение показателя фибринолитической активности крови коагулограммы тоже имело место, однако оно статистически недостоверно. Наряду с этим закономерны положительные результаты этанолового и протамин-сульфатного тестов коагулограммы. Таким образом, при ОДП с первых суток развиваются нарушения в системе гемостаза, соответствующие коагуляционному клинико-патогенетическому варианту ДВС-синдрома — угнетение фибринолиза и выраженная активация свертывания крови, которые сохраняются на протяжении 7 суток и имеют фазное течение.
Было установлено, что изменения в системе гемостаза увеличиваются с нарастанием степени тяжести течения деструктивного панкреатита, а наиболее значительны при панкреатическом шоке на фоне нестабильной гемодинамики. С нашей точки зрения, нестабильность гемодинамики обусловлена в этот период состоянием микроциркуляции, регулируемой объемом адекватной инфузионной терапии. Реология крови коррелировала со степенью интоксикации (ЛИИ). Несмотря на признаки гемоконцентрации, начальный показатель НПТЭГ оказался сниженным более чем на 40 % по сравнению с показателем у здоровых лиц (Р < 0,05). Число тромбоцитов у пациентов этой группы составило 105,2 ± 23,4 • 109/л, что в 2,5 раза меньше, чем у здоровых людей. Особенно заметно был снижен показатель Ar НПТЭГ. Дезагрегационная активность определялась не у всех пациентов. Коагуляционное звено гемостаза характеризовалось выраженным гипокоагуляционным сдвигом по всем хронометрическим и структурным показателям НПТЭГ и коагулограммы. При этом показатели коагуляционного звена (r, k, Kk) после первоначального изменения (первые сутки от начала заболевания) в дальнейшем значимо не нормализуются. Максимальная плотность сгустка по сравнению с 1-ми сутками, несмотря на повышение фибринолитической активности, увеличивается на 15 %. Столь существенные изменения с учетом двукратного снижения концентрации общего фибриногена (Р < 0,001) и тромбоцитов не оставляли сомнений в том, что имеет место тяжелый острый ДВС-синдром с яркими лабораторными проявлениями коагулопатии потребления, т.е. фибринолитический вариант ДВС-синдрома [11]. Летальность среди этих больных составляет в среднем 70 %.
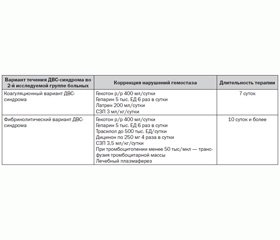
Чрезвычайная сложность, многообразие и неоднородность морфологических и функциональных нарушений гомеостаза не позволяют предложить неоднозначную и четко очерченную схему инфузионно-трансфузионной терапии для всех пациентов. Больным 1-й группы традиционная инфузионно-трансфузионная терапия проводилась по общепризнанным схемам, включая использование коллоидных, кристаллоидных растворов и препаратов крови (СЗП, альбумин), кровезаменителей гемодинамического действия, вазопрессоров, дезагрегантов и антикоагулянтов (гепарин 5 тыс. ЕД 6 раз в сутки). Ее реальное содержание определялось клинико-лабораторной ситуацией у конкретного больного на данный момент времени.
Во 2-й группе больных мы придерживались базисной программы интенсивной терапии, включающей целенаправленную специфическую коррекцию расстройств системы гемостаза, дифференцируя ее в зависимости от выявленного клинико-патогенетического варианта ДВС-синдрома. Подобная модификация дала положительный эффект — летальность снизилась на 30,9 %.
С позиции полученных результатов нами была разработана лечебная тактика, включающая следующие компоненты (табл. 2): инфузионно-трансфузионную терапию с интенсивной коррекцией ОЦК в первые 12–24 часа под контролем показателей центральной гемодинамики и восстановления адекватного почасового диуреза. Дефицит ОЦК достигает 40 % при деструктивных формах панкреонекроза и связан с резким дефицитом плазмы.
С позиций патогенеза органных расстройств при ОДП для коррекции гиповолемии с управляемым реологическим эффектом нам представляется оптимальным выбор многокомпонентного, полиионного, коллоидно-гиперосмолярного раствора Гекотон, учитывая его улучшенный профиль безопасности, подтвержденный в многократных исследованиях [9, 10].
По результатам исследования выявлено (табл. 3), что инфузия Гекотона в дозе 400 мл обладает выраженным гемодинамическим эффектом, в среднем повышая артериальное давление на 28–30 мм рт.ст. Показатели системы гемостаза (запись НПТЭГ, АЧТВ, ПТИ, фибриноген, тромбоциты) не отразили существенного влияния Гекотона на гемостаз. Практические наблюдения показали наибольшую эффективность препарата при раннем его назначении, на дооперационном этапе.
С учетом комплексного подхода к программе ИТ следует признать, что полученный успех объясняется не только использованием Гекотона, а программы в целом при условии быстрых и адекватных действий хирурга.
Роль же Гекотона — формирование «первой линии защиты» от шока, удержание ОЦК до порога необратимой гиповолемии, что дает время для точной диагностики и сбора ингредиентов инфузионной программы.
При ОДП гиперкоагуляция сопровождается истощением противосвертывающих факторов: АТ ІІІ, протеина С, компонентов фибринолитической системы плазминогена и плазмина. С целью их возмещения считаем целесообразным включение в комплекс корригирующей терапии свежезамороженной плазмы, содержащей в оптимальных концентрациях и соотношениях данные компоненты. Для оптимальной активации АТ ІІІ в используемую СЗП добавляют гепарин (2500 ЕД/250 мл СЗП).
Более эффективное ограничение избыточной агрегации тромбоцитов достигается использованием дезагреганта Латрена (200 мл/сутки).
При тяжелом течении заболевания и недостаточно быстрой нормализации основных показателей гемостаза считаем целесообразным назначение ингибиторов протеаз в сочетании с препаратом, снижающим сосудистую проницаемость, — дициноном. Дополнительно проводится лечебный плазмаферез, который способствует удалению токсичных продуктов распада и агрегатов клеток, образующихся в результате воздействия первичного повреждающего фактора, активированных факторов свертывания, продуктов деградации фибриногена — фибрина.
В результате сравнительного анализа установлено, что эффективность специфической коррекции нарушений гемостаза зависит от выраженности клинической симптоматики. При тяжелом течении нормализация показателей гемостаза происходит постепенно, начиная с первых суток от начала лечения, и различия с контролем становятся минимальными после 5–7 суток. Через 3 суток интенсивной терапии состояние больных 2-й группы характеризовалось определенной стабильностью. У всех пациентов в значительной степени был купирован болевой синдром, полностью восстановлен диурез, прекратилась рвота. Гематокрит в этой группе составил 0,34 ± 0,04 отн.ед., количество тромбоцитов в крови — 138,8 ± 25,6 • 109/л. Исходный показатель Ar НПТЭГ, характеризующий физико-химические свойства крови, в начале процесса свертывания был близок к величине этого показателя у здоровых лиц и в определенной степени свидетельствовал о нормализации реологических свойств крови. Умеренная хронометрическая гипокоагуляция регистрировалась всеми показателями НПТЭГ и коагулограммы, что объясняется продолжающейся гепаринотерапией.
Отмечено увеличение частоты легочных осложнений в 1-й группе больных по сравнению со 2-й группой — 71,9 против 42,6 % соответственно. Койко-день в отделении АРИТ в 1-й группе составил 11,29 ± 0,67, во 2-й группе — 9,56 ± 1,64, в стационаре соответственно 32,97 ± 3,11 и 25,42 ± 4,18.
Летальность в 1-й группе составила 6 (18,75 %), во 2-й группе — 7 (12,96 %) больных.
В плане прогноза необходимо учитывать, что летальность уменьшалась в тех случаях, когда под влиянием специфической коррекции происходила, начиная с 3 суток, нормализация следующих показателей: времени начала образования сгустка (r), константы тромбина (k), интенсивности тромбообразования (Kk), плотности сгустка (АМ) и фибринолитической активности (F).
Выводы
1. Изменения в параметрах гемостаза при остром деструктивном панкреатите носят разнонаправленный характер: наблюдается разбалансировка системы от значительной гиперкоагуляции до отчетливого гипокоагуляционного состояния уже в первые часы заболевания, что объясняется тяжестью и скоростью развития ДВС-синдрома. Направленность этих сдвигов существенно различается в зависимости от тяжести течения заболевания. Формирование нарушений объясняется самим патогенезом панкреатического шока.
2. Использование метода низкочастотной пьезоэлектрической тромбоэластографии (анализатор АРП-01) позволяет своевременно достаточно адекватно оценить нарушения гемостаза в остром периоде деструктивного панкреатита, с минимальными материальными затратами в короткие сроки, непосредственно у постели больного. Перспективным является использование лабораторных показателей в ранней диагностике панкреонекроза и оценке тяжести состояния больных.
3. Терапия ДВС-синдрома у больных острым деструктивным панкреатитом должна осуществляться под постоянным мониторингом гемостазиологических параметров дифференцированно, в зависимости от имеющихся расстройств коагуляции.
4. Сопоставление полученных результатов исследования, клинические наблюдения и анализ литературных данных позволяют сделать вывод о том, что многокомпонентный, полиионный, коллоидно-гиперосмолярный раствор Гекотон показан в качестве базового инфузионного раствора в интенсивной терапии гиповолемических расстройств у пациентов с острым деструктивным панкреатитом.
5. Специфическая коррекция нарушений гемостаза при деструктивном панкреатите с учетом выраженности клинико-патофизиологических проявлений, посредством воздействия на ключевые патогенетические факторы с помощью Гекотона, целевого назначения гепарина, Латрена, трасилола, свежезамороженной плазмы и лечебного плазмафереза позволяет уменьшить частоту легочных осложнений в 1,7 раза, сокращает время пребывания в стационаре на 23 %, а также снижает летальность на 30,9 % при тяжелом течении заболевания.
1. Гельфанд Б.Р., Филимонов М.И., Бурневич С.З. и др. Оценка эффективности различных режимов профилактики и терапии при панкреонекрозе // Consilium medicum. Приложение. — 2001. — 12–14.
2. Молчанов И.В., Буланов А.Ю., Шулутко Е.М. Некоторые аспекты безопасности инфузионной терапии // Клиническая анестезиология и реаниматология. — 2004. — Т. 1, № 3. — С. 19–24.
3. Савельев В.С., Гельфанд Б.Р., Филимонов М.И., Бурневич С.З., Цыдержанов Е.Ц., Орлов Б.Б. Комплексное лечение панкреонекроза // Анналы хирургической гепатологии. — 2000. — Т. 5, № 2. — С. 61–66.
4. Тарабрін О.О. Комплексна корекція тромбонебезпечності на етапах хірургічного лікування // Вісник морської медицини. — 1998. — № 2. — С. 64–65.
5. Тарабрин О.А., Лобенко А.А., Запорожченко Б.С., Гоженко А.И., Кирилюк А.А. Способ интегральной оценки функционального состояния системы гемостаза // Клінічна хірургія. — 1998. — № 7. — С. 30–32.
6. Черний В.И., Кабанько Т.П., Кузнецова И.В. Нарушения в системе гемостаза при критических состояниях. — Київ: Здоров’я, 2000. — 206 с.
7. Boldt J. Fluid management of patients undergoing abdominal surgery — more questions than answers // European Journal of Anaesthesiology. — 2006.
8. Cheng D. et al. Colloids for perioperative plasma volume expansion: systematic review with meta–analysis of controlled trials // Transfusion Alternatives in Transfusion Medicine. — 2007. — Vol. 9 (Suppl. 1). — S3.
9. De Jоnge E., Levi M. Effects of different plasma substitutes on blood coagulation: a comparative review // Crit. Care Med. — 2001. — V. 29, № 6. — P. 1261–1267.
10. Hoffmann J.N. et al. HES — 130/0.4 but not crystalloid volume support improve microcirculation duaring normotesive endotexemia // Anaesthesioligy. — 2002. — 57. — 463–470.
11. Nathens A.B., Curtis J., Beal R. et al. Management of critically ill patient with severe acute pancreatitis // Crit. Care Med. — 2004. — 32. — 2524–2536.
12. UK guidelines for management of acute pancreatitis // Gut. — 2005. — 54. — 1–9.

/41/41.jpg)
/43/43.jpg)