Журнал «Медицина неотложных состояний» 2 (57) 2014
Вернуться к номеру
Современные аспекты терапии заболеваний головного мозга в клинике неотложных состояний
Авторы: Галина Бут
Рубрики: Медицина неотложных состояний
Разделы: Медицинские форумы
Версия для печати
Статья опубликована на с. 25-30
1–2 апреля 2014 года в Киеве на базе НМАПО им. П.Л. Шупика состоялся научный симпозиум с международным участием «Актуальные вопросы медицины неотложных состояний и медицины катастроф».
Актуальные вопросы лечения острого ишемического инсульта были рассмотрены в докладе заведующего кафедрой медицины неотложных состояний НМАПО им. П.Л. Шупика, доктора медицинских наук, профессора И.С. Зозули. Среди всех сосудистых заболеваний головного мозга наиболее тяжелой формой по клиническому течению и последствиям является мозговой инсульт (МИ). Согласно данным официальной статистики, ежегодно в Украине впервые переносят инсульт 100–120 тыс. человек. Показатель заболеваемости МИ в нашей стране составляет 200–290 тыс. на 100 тыс. населения. Средний показатель заболеваемости МИ в экономически развитых странах Европы составляет 200 тыс. случаев на 100 тыс. населения. За последние 10 лет заболеваемость МИ в Украине возросла на 5 % в основном за счет лиц трудоспособного возраста. Вследствие МИ в Украине ежегодно умирает 40–45 тыс. человек, что составляет 86,6 случая на 100 тыс. населения. В Европе этот показатель составляет 37–47 тыс. на 100 тыс. населения. Сегодня инсульт остается основной причиной инвалидизации в Украине. Около 20 тыс. больных ежегодно становятся инвалидами вследствие МИ. Только 10–20 % перенесших инсульт возвращаются к своей трудовой деятельности. Инсульт накладывает особые обязательства на членов семьи больного и является тяжелым социально-экономическим бременем для общества.
На долю ишемических нарушений мозгового кровообращения приходится около 80 % всех видов инсульта. В основе ишемического инсульта лежит ишемия, которая характеризуется критическим снижением церебральной гемоперфузии, что вызывает запуск патологического биохимического каскада, приводящего к гибели нейронов. Критическое снижение мозговой перфузии кратковременно, так как в течение нескольких часов в пораженном бассейне возобновляется кровоток, но формирование очага повреждения продолжается значительно дольше./25/25.jpg) Поэтому терапевтические усилия, позволяющие снизить энергозатраты нейронов и повысить их устойчивость к гипоксии, помогут сохранить структуру нейронов.
Поэтому терапевтические усилия, позволяющие снизить энергозатраты нейронов и повысить их устойчивость к гипоксии, помогут сохранить структуру нейронов.
Клиническое течение острого ишемического инсульта характеризуется наличием общемозговой и очаговой симптоматики. Чаще в клинике преобладают проявления неврологического дефицита, что зависит от варианта ишемического повреждения. В зависимости от причин выделяют несколько патогенетических форм ишемического инсульта: кардиоэмболический (вследствие аритмии, инфаркта миокарда или клапанного порока сердца), лакунарный (при окклюзии мелких артерий), атеротромботический (развивается на фоне атеросклероза крупных артерий), гемодинамический, по типу гемореологической микроокклюзии. Наиболее распространенными вариантами острого ишемического инсульта являются кардиоэмболический и атеротромботический.
Диагностика ишемического инсульта включает проведение компьютерной томографии (КТ) и магнитно–резонансной томографии (МРТ). Магнитно–резонансная ангиография позволяет получать изображения сосудов мозга, также применяют ультразвуковые методы диагностики — допплерографию и дуплексное сканирование сонных артерий.
Лечение МИ преследует несколько целей: восстановление и поддержание оптимальной церебральной гемоперфузии, обеспечение проходимости дыхательных путей, коррекцию респираторных и дисциркуляторных нарушений, водно-электролитного баланса. Среди важных этапов терапии острого ишемического инсульта отмечают применение нейропротекторных препаратов. Это связано с тем, что в многочисленных клинических исследованиях показано, что адекватное применение нейротрофических и нейропротекторных препаратов позволяет снизить темпы формирования ишемических повреждений и повышает устойчивость нервной ткани к гипоксическому воздействию. На сегодняшний день наиболее перспективным нейромедиаторным препаратом является холина альфосцерат (Глиатилин). Глиатилин обладает высокой метаболической и нейропротекторной активностью. Он проникает через гематоэнцефалический барьер, содержит 40,5 % метаболически защищенного холина и служит донором для биосинтеза нейротрансмиттера ацетилхолина в пресинаптических мембранах холинергических нейронов, активируя холинергическую трансмиссию. Также Глиатилин является источником фосфатидилхолина, который обеспечивает биосинтетические процессы мембранных фосфолипидов, улучшая пластичность и плотность нейронов.
При лечении Глиатилином у пациентов с острыми нарушениями мозгового кровообращения отмечено раннее восстановление сознания и выход из коматозного состояния. Применение Глиатилина в остром периоде ишемического инсульта предотвращает потенциально возможное значительное расширение конечных размеров морфологического дефекта мозговой ткани к концу острого периода инсульта. Введение Глиатилина в первые 24 часа после дебюта инсульта способствует уменьшению неврологического дефицита и увеличению способности пациентов к самообслуживанию. Клинически это проявляется лучшим восстановлением речи, памяти и движения. В итальянском мультицентровом клиническом исследовании доказана высокая эффективность Глиатилина в плане влияния на когнитивную, двигательную функцию и улучшение самообслуживания при лечении острого ишемического инсульта. Достоверные результаты получены уже через 28 дней инъекционного лечения, и положительная динамика продолжала нарастать все 6 месяцев последующей восстановительной терапии./26/26.jpg) При этом на протяжении 6 месяцев у более чем 2000 пациентов не было выявлено отрицательных гемодинамических эффектов, в частности на сердечный ритм и уровень артериального давления (рис. 1).
При этом на протяжении 6 месяцев у более чем 2000 пациентов не было выявлено отрицательных гемодинамических эффектов, в частности на сердечный ритм и уровень артериального давления (рис. 1).
В докладе заведующего отделением анестезиологии и интенсивной терапии КМУ «Клиническая Рудничная больница» (ОАИТ КРБ), доцента Донецкого национального медицинского университета им. М. Горького, кандидата медицинских наук А.Н. Колесникова было продолжено обсуждение холинергической терапии при острых поражениях ЦНС различного генеза.
Участие холинореактивных систем в регуляторных процессах ЦНС было описано П.П. Денисенко в 1980 году. Как правило, следствием церебральной недостаточности является возникновение когнитивных нарушений, в основе которых лежит холинергическая недостаточность, обусловленная снижением выработки ацетилхолина и потерей холинергических нейронов.
В настоящее время в клинической практике применяется два класса медикаментозных средств, направленных на преодоление холинергической недостаточности: ингибиторы ацетилхолинэстеразы (прозерин, галантамин и нейромидин) и предшественники холина (центральный холинергический препарат холина (Глиатилин) и цитидин-5-дифосфохолин натрия (цитиколин)).
Глиатилин — это комплексный нейрометаболический препарат. При попадании в организм холина альфосцерат расщепляется под действием ферментов на холин и глицерофосфат. Холин участвует в биосинтезе ацетилхолина. Глицерофосфат является предшественником фосфатидилхолина — ключевого компонента мембраны нейрона.
/26/26_2.jpg)
Указанные особенности обусловливают основные фармакологические эффекты препарата, которые заключаются в улучшении передачи нервных импульсов в холинергических нейронах, положительном влиянии на пластичность нейрональных мембран и функцию рецепторов, а также улучшении церебрального кровотока, стимуляции метаболических процессов в головном мозге, активации ретикулярной формации головного мозга и восстановлении сознания при травмах головного мозга. Исходя из этого, основными перспективными направлениями применения Глиатилина, которые в настоящее время разрабатываются в условиях ОАИТ КРБ, являются терапия острого ишемического инсульта в остром периоде и в период восстановления, лечение ЧМТ, терапия острого ишемического инсульта (в остром периоде и в периоде восстановления), лечение ЧМТ, комбинация терапии Глиатилином и гипербарической оксигенации при острых отравлениях, экстракорпоральное фармакологическое лечение.
Проведено исследование с целью оценки качества коррекции холинергической недостаточности препаратом Глиатилин у пациентов с полиэтиологическим поражением ЦНС: острым нарушением мозгового кровообращения по ишемическому типу, тяжелой черепно–мозговой травмой, токсическим поражением ЦНС. В первую клиническую группу вошли 75 пациентов (38 женщин и 37 мужчин) в возрасте от 58 до 74 лет (средний возраст 65,9 ± 4,1 года), которые находились в ОАИТ КРБ с диагнозом острого нарушения мозгового кровообращения по ишемическому типу. Вторую клиническую группу составил 51 пациент (30 мужчин и 21 женщина) в возрасте от 37 до 54 лет (средний возраст 42,0 ± 5,7 года), которые госпитализированы в ОАИТ КРБ с диагнозом тяжелой черепно-мозговой травмы. Третью клиническую группу составили 66 пациентов (22 женщины и 44 мужчины) в возрасте от 21 до 58 лет (средний возраст 40,2 ± 6,8 года), которые находились в ОАИТ КРБ с диагнозом острого бытового отравления неустановленным веществом (алкоголь, суррогаты алкоголя). В каждой группе была проведена рандомизация слепым методом по виду терапии на подгруппы: в подгруппе А (1, 2 и 3-й клинических групп) проводилось протокольное лечение согласно приказам МЗ, в подгруппе В (1, 2 и 3-й клинических групп) к стандартной терапии добавлен холина альфосцерат в дозе 1000 мг 2 раза в сутки.
Верификация диагноза проводилась по данным нейровизуализации на компьютерном томографе Siemens Somatom Spirit, по данным транскраниальной допплерографии (аппарат EZdop). Всем больным выполнялась электрокардиография в динамике, мониторировались АД, ЧД, пульс, температура тела, диурез, показатели гликемии, сатурация капиллярной крови кислородом. Объективизация уровня сознания, помимо клинических улучшений, регистрировалась также при помощи монитора BIS Vista.
Контроль результатов терапии производился ежедневно при помощи шкалы комы Глазго (ШКГ, The Glasgow Coma Scale, GCS), шкалы оценки неврологического состояния NIHSS, а также с помощью аппарата транскраниальной допплерографии (ТКДГ) EZdop.
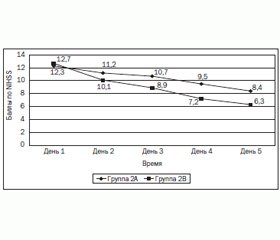
В ходе терапии у больных с ишемическим инсультом, в группе больных с тяжелой ЧМТ, у больных с отравлением алкоголем, суррогатами алкоголя оценивались такие показатели: скорость восстановления сознания (рис. 2), скорость регресса неврологической симптоматики (NIHSS) (рис. 3), скорость восстановления линейной скорости кровотока (рис. 4) и скорость восстановления показателей ВIS-мониторинга.
/30/30.jpg)
Полученные в приведенном исследовании данные свидетельствуют о том, что введение в комплексную терапию ишемического инсульта холина альфосцерата улучшает динамику регресса неврологической симптоматики, увеличивает скорость мозгового кровотока. Применение холина альфосцерата в комплексной терапии тяжелой черепно-мозговой травмы способствует лучшему течению восстановительного периода (5–6-е сутки).
/29/29.jpg) Восстановление линейной скорости мозгового кровотока происходило значительно раньше в группах с применением холинергической терапии. Проведение холинергической терапии больным с токсическим поражением ЦНС (воздействие алкоголя и его суррогатов) способствует более быстрому выходу больных из комы. Включение холина альфосцерата в комплексную терапию полиэтиологического поражения ЦНС является эффективным и перспективным и требует дальнейшего изучения.
Восстановление линейной скорости мозгового кровотока происходило значительно раньше в группах с применением холинергической терапии. Проведение холинергической терапии больным с токсическим поражением ЦНС (воздействие алкоголя и его суррогатов) способствует более быстрому выходу больных из комы. Включение холина альфосцерата в комплексную терапию полиэтиологического поражения ЦНС является эффективным и перспективным и требует дальнейшего изучения.
Заведующий кафедрой медицины неотложных состояний, медицины катастроф и военной медицины ХМАПО, доктор медицинских наук, профессор В.В. Никонов представил доклад «Острая сердечная недостаточность (инфаркт миокарда) и инсульт». Как показывает практика, ухудшение мозгового кровообращения возникает не только на фоне инфаркта миокарда, но и при различных видах шока, нестабильной стенокардии, сердечной недостаточности III–IV стадии, нарушениях сердечного ритма, пороках сердца (пролапс митрального клапана с регургитацией), артериальной гипертензии, ТЭЛА и др. В последние годы особую значимость приобрели ятрогенные причины нарушения кровообращения мозга и других органов и систем человеческого организма. При формировании очага некроза в головном мозге не только возникают церебральные нарушения, но и страдает регуляция функций всех жизненно важных органов и систем организма.
На фоне инфаркта миокарда острые церебральные симптомы возникают в среднем в 20–30 % случаев. В то же время риск развития цереброваскулярных событийпри развитии инфаркта миокарда сохраняется в течение 6–9 месяцев. Это связано в основном с нарушением сердечной функции, срывом механизмов сосудистой ауторегуляции, гипоксией/ишемией, особенно в сосудистых зонах, пораженных атеросклеротическим процессом. Клинические проявления нарушения мозгового кровообращения могут быть достаточно разнообразными — от потери сознания до нарушения памяти, внимания, двигательных расстройств, ухудшения зрения. В целом выраженность и стойкость возникших неврологических нарушений зависит от степени тяжести и распространенности расстройств метаболизма мозговой ткани.
В основе развития такой сочетанной патологии лежит гипоксия клеток с развитием митохондриальной дисфункции, связанной с расстройством церебральной гемодинамики, повышением коагуляцион–ного потенциала крови, микроциркуляторными нарушениями, синдромом «капиллярной утечки».
Основные принципы лечения пациентов с острыми кардиальными состояниями и ишемией мозга заключаются в комплексной оценке состояния пациента, степени нарушения сознания и проведении адекватной терапии основного заболевания. Восстановление и поддержание системной гемоциркуляции с коррекцией микроциркуляторных нарушений является одной из важных составляющих терапевтической стратегии. Также важны проведение нейрометаболической терапии, борьба с гипоксией/ишемией, проведение противоотечной терапии. Перспективным нейромедиаторным препаратом является Глиатилин, который обладает не только мембраностабилизирующими и противоотечными свойствами, но и пробуждающим эффектом у пациентов с угнетенным уровнем сознания. Проведение такого комплексного лечения пациентов с кардио–церебральным синдромом позволит оптимизировать результаты лечения, улучшить их прогноз и социальную адаптацию.

/29/29_2.jpg)