Журнал «Медико-социальные проблемы семьи» 1 (том 19) 2014
Вернуться к номеру
Роль ацинетобактерий в возникновении проблемных инфекций
Авторы: Гриценко Л.З., Колоколова Е.В., Колесникова А.Г., Мишин В.В., Ананьева М.Н. - Донецкий национальный медицинский университет им. М. Горького, кафедра микробиологии, вирусологии и иммунологии
Рубрики: Акушерство и гинекология
Разделы: Справочник специалиста
Версия для печати
Ацинетобактер является типичным примером так называемых проблемных инфекций ввиду высокого уровня приобретенной резистентности к антибиотикам. Acinetobacter spp. — род
грамотрицательных бактерий, относящийся к семейству Moraxellaceae. Обычно очень короткие и округлые грамотрицательные бактерии, размеры их в логарифмической фазе роста составляют
1,0–1,5 × 1,5–2,5 мкм. Эти микроорганизмы плеоморфны, и их легко спутать с микроорганизмами рода Neisseria. Они хорошо растут на простых питательных средах, образуя белые, выпуклые, гладкие колонии. Ацинетобактер синтезирует липополисахарид и капсульный полисахарид, которые ответственны за высокую токсичность. Это свободно живущие сапрофиты, которые распространены повсеместно. Естественной средой их обитания являются вода и почва. Они могут выживать на влажных и сухих поверхностях, в том числе в условиях больничных учреждений. У 25 % здоровых людей Acinetobacter spp. колонизируется на коже. У ослабленных лиц некоторые представители Acinetobacter spp. могут вызвать опасные для жизни инфекции. Клинически наиболее значимыми микроорганизмами рода Acinetobacter spp. считаются виды A.baumannii, гораздо реже являются возбудителями заболеваний A.lwoffii. У тяжелых больных (палаты интенсивной терапии, реанимация) A.baumannii может вызывать пневмонии, трахеобронхиты, инфекции кровяного русла, мочевого тракта, катетер-ассоциированные и раневые инфекции. Смертность при ацинетобактерной инфекции обычно очень высокая и составляет 20–60 %. Частота возникновения ацинетобактерной инфекции возрастает. Предлагается схема идентификации Acinetobacter spp. для практического врача-бактериолога.
Ацинетобактер є типовим прикладом так званих проблемних інфекцій з огляду на високий рівень набутої резистентності до антибіотиків. Acinetobacter spp. — рід грамнегативних бактерій, що належать до сімейства Moraxellaceae. Зазвичай це дуже короткі й округлі грамнегативні бактерії, розміри їх в логарифмічній фазі росту становлять 1,0–1,5 × 1,5–2,5 мкм. Ці мікроорганізми плеоморфні, і їх легко сплутати з мікроорганізмами роду Neisseriа. Вони добре ростуть на простих поживних середовищах, утворюючи білі, випуклі, гладкі колонії. Ацинетобактер синтезує ліпополісахарид і капсульний полісахарид, що відповідальні за його високу токсичність. Це сапрофіти, що вільно живуть і поширені повсюди. Природним середовищем їх проживання є вода та ґрунт. Вони можуть виживати на вологих і сухих поверхнях, у тому числі в умовах лікарняних установ. У 25 % здорових людей Acinetobacter spp. колонізується на шкірі. У ослаблених осіб деякі представники Acinetobacter spp. можуть викликати небезпечні для життя інфекції. Клінічно найбільш значущими мікроорганізмами роду Acinetobacter spp. вважається вид A.baumannii, набагато рідше збудником захворювань є A.lwoffii. У тяжких хворих (палати інтенсивної терапії, реанімація) A.baumannii може викликати пневмонії, трахеобронхіти, інфекції кров’яного русла, сечового тракту, катетер-асоційовані та ранові інфекції. Смертність при ацинетобактерній інфекції зазвичай дуже висока та становить 20–60 %. Частота виникнення ацинетобактерної інфекції зростає. Пропонується схема ідентифікації Acinetobacter spp. для практичного лікаря-бактеріолога.
Acinetobacter is a typical example of so-called problematic infections due to the high level of acquired resistance to antibiotics. Acinetobacter spp. — genus of Gram-negative bacteria belonging to the family Moraxellaceae. Usually a very short and rounded Gram-negative bacteria, their sizes in the logarithmic growth phase are 1.0–1.5 × 1.5–2.5 micron. These microorganisms are pleomorphic and are easily confused with the microorganisms of the genus Neisseria. They grow well on ordinary nutrient media, forming a white, convex, smooth colonies. Acinetobacter synthesizes lipopolysaccharide and capsular polysaccharide which are responsible for high toxicity. This is free-living saprophytes, which are ubiquitous. Their habitats are water and soil. They can survive on dry and wet surfaces, including in hospital establishments. In 25 % of healthy people Acinetobacter spp. colonises the skin. In immunocompromised individuals, some representatives of Acinetobacter spp. can cause life-threatening infections. Clinically, the most important microorganisms of the genus Acinetobacter spp. considered A.baumannii, and much rarer pathogens are A.lwoffii. In critically ill patients (intensive care, resuscitation units) A.baumannii can cause pneumonia, tracheobronchitis, bloodstream, urinary tract infections, catheter-associated and wound infections. Mortality in Acinetobacter infection is usually very high, and is 20–60 %. The incidence of Acinetobacter increases. A scheme for the identification of Acinetobacter spp. for practitioner-bacteriologist is offered.
ацинетобактер, резистентность, клиника, диагностика.
ацинетобактер, резистентність, клініка, діагностика.
Acinetobacter, resistance, clinical picture, diagnosis.
Статья опубликована на с. 122-127
Актуальность
Имеется ряд микроорганизмов (МО), которые ввиду высокого уровня приобретенной резистентности к антибиотикам принято называть проблемными. К таковым среди возбудителей заболеваний органов дыхания относятся метициллинрезистентные золотистые стафилококки (MRSA) и некоторые представители грамотрицательной флоры — синегнойная палочка (P.aeruginosa), бактерии рода ацинетобактер (Acinetobacter spp.) и в ряде случаев отдельные МО семейства Enterobacteriaceae (E.coli, K.pneumoniae) [1]. В данной работе будут рассмотрены представители рода Acinetobacter spp.
Acinetobacter (ah-see-netto-BAK-ter) является сложным словом, которое произошло от научного греческого [α + κίνητο + βακτηρ (ία)], что означает «неподвижные стержни».
Представители этого рода являются свободно живущими сапрофитами, распространены повсеместно. Естественной средой их обитания являются вода и почва. Они часто выделяются из сточных вод, являются важными почвенными организмами, где они способствуют минерализации (например, ароматических соединений). Они могут выживать на влажных и сухих поверхностях, в том числе в условиях больничных учреждений. Некоторые штаммы были изолированы из продуктов питания, питьевой воды. Эти МО входят в состав микрофлоры кожи здоровых лиц и чаще колонизируют участки между пальцами ног и в паховой области (особенно у проживающих в жарком и влажном климате), могут находиться в желудочно-кишечном и урогенитальном трактах и относятся к малопатогенным микроорганизмам. Однако наличие определенных свойств способствует повышению вирулентности Acinetobacter spp. [2, 3]. У здоровых людей Acinetobacter spp. вегетируют на коже и коррелируют с низким уровнем заболеваемости аллергией [4].
Acinetobacter spp. являются ключевым источником инфекции у ослабленных пациентов в больнице. Клинически наиболее значимыми МО рода Acinetobacter spp. считаются виды A.baumannii, гораздо реже являются возбудителями заболеваний A.lwoffii. Поэтому при упоминании ацинетобактерной инфекции в первую очередь подразумевается A.baumannii. У ослабленных лиц некоторые представители Acinetobacter spp. могут вызвать опасные для жизни инфекции. Такие виды также обладают относительно широким спектром устойчивости к антибиотикам.
Acinetobacter spp. часто выделяют при внутрибольничных инфекциях, и особенно характерно их распространение в отделении интенсивной терапии, где возможно возникновение спорадических случаев, а также эпидемическое распространение является обыденным явлением. У тяжелых больных (палаты интенсивной терапии, реанимация) A.baumannii может вызывать пневмонии, трахеобронхиты, инфекции кровяного русла, мочевого тракта, катетер-ассоциированные и раневые инфекции. В отделениях интенсивной терапии (ОИТ) США в 2003 г. Acinetobacter spp. стал причиной 6,9 % всего количества пневмоний, 2,4 % инфекций кровяного русла, 2,1 % инфекций области хирургического вмешательства и 1,6 % инфекций мочевыделительной системы. В условиях тропического климата Acinetobacter spp. может обусловливать тяжелые внебольничные пневмонии. Кроме того, ацинетобактерии способны вызывать вспышки заболеваний во время стихийных бедствий [5].
К тяжелым инфекциям, вызванных Acinetobacter spp., относятся менингиты, подострые и острые бактериальные эндокардиты, пневмонии, инфекции мочевых путей и бактериемия. Обычно клинические проявления и симптомы этой инфекции не отличаются от таковых при аналогичных заболеваниях, вызванных другими возбудителями. Иногда Acinetobacter spp. может обусловливать молниеносную бактериемию с выраженной лихорадкой, сосудистым коллапсом, петехиями, массивными подкожными кровоизлияниями, которые неотличимы от менингококцемии. Гораздо чаще, однако, бактериемия ассоциируется с очевидным внедрением инфекции через венозную систему, в частности через венозные катетеры, хирургические раны или ожоговые поверхности. Она может также развиваться после инструментальных вмешательств на мочеиспускательном канале или в других областях. В клинических проявлениях таких заболеваний доминирует эндотоксемия, и прогноз их неблагоприятный.
Смертность при ацинетобактерной инфекции обычно очень высокая и составляет 20–60 %, атрибутивная летальность — около 10–20 % [6].
Морфология
Род Acinetobacter включает 27 названных и 11 неназванных (геномных) видов. Однако, поскольку процедура идентификации в клинической микробиологической лаборатории пока невозможна, они разделены и сгруппированы в три основных комплекса:
1. Acinetobacter calcoaceticus-baumanii комплекс: глюкозоокислительные, негемолитические (A.baumannii могут быть идентифицированы по OXA-51-типированию).
2. Acinetobacter lwoffii: глюкозоотрицательные, негемолитические.
3. Acinetobacter haemolyticus: гемолитические.
Насчитывается 38 видов Acinetobacter spp., из которых значение в клинической диагностике имеют 17 видов: Acinetobacter baumannii, Acinetobacter baylyi, Acinetobacter bouvetii, Acinetobacter calcoaceticus, Acinetobacter gerneri, Acinetobacter grimontii, Acinetobacter haemolyticus, Acinetobacter johnsonii, Acinetobacter junii, Acinetobacter lwoffii, Acinetobacter parvus, Acinetobacter radioresistens, Acinetobacter schindleri, Acinetobacter tandoii, Acinetobacter tjernbergiae, Acinetobacter towneri, Acinetobacter ursingii.
Acinetobacter spp. — род грамотрицательных бактерий, относящийся к семейству Moraxellaceae. Обычно очень короткие и округлые грамотрицательные бактерии, размеры их в логарифмической фазе роста составляют 1,0–1,5 × 1,5–2,5 мкм.
В стационарной фазе роста они приобретают преимущественно форму кокков, располагающихся парами или в виде коротких цепочек. Большие непостоянной формы клетки и нити обнаруживаются в небольшом количестве во всех культурах, а иногда и преобладают. Спор не образуют, жгутиков не имеют, однако некоторые штаммы на плотной питательной поверхности демонстрируют «дергающуюся» подвижность. Капсулы и фимбрии могут быть, но могут и отсутствовать.
Культивирование
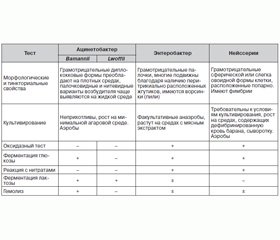
Бактерии рода Acinetobacter spp. являются хемоорганотрофами с окислительным метаболизмом. Способность использовать органические соединения в качестве источников энергии и углерода непостоянна. Оксидазы не образуют, каталазопозитивны. Ацетона, индола и сероводорода не образуют. Строгие аэробы, оптимальная температура для роста 30–32 °С, pH около 7,0.
Эти микроорганизмы плеоморфны, и их легко спутать с микроорганизмами рода Neisseria. Они хорошо растут на простых питательных средах, образуя белые, выпуклые, гладкие колонии. Среди микробов, выросших на плотных средах, преобладают диплококковые формы; палочковидные и нитевидные варианты возбудителя чаще выявляются на жидкой среде. Видовая идентификация от энтеробактерий основывается на их отрицательной реакции с нитратами, а от представителей рода Neisseria, которых они могут напоминать по морфологии, отличают по их неприхотливости к питательным средам, по палочковидной форме на жидких средах и по свойственной им отрицательной оксидазной реакции.
Большинство штаммов Acinetobacter spp., за исключением некоторых штаммов А.lwoffii, хорошо растут на бессолевом агаре. Официально классифицируются как ферментирующие лактозу. Бактерии рода Acinetobacter spp., как известно, образуют внутриклеточные полигидроксиалкалоидные включения при определенных условиях окружающей среды (например, отсутствие таких элементов, как фосфор, азот или кислород, в сочетании с избыточным предложением источников углерода) [7, 8].
Резистентность
Acinetobacter spp. могут выживать на влажных и сухих поверхностях до 20 дней. A.baumannii сохраняется на коже человека или сухих поверхностях в течение нескольких недель.
В настоящее время наибольшее беспокойство вызывает рост полирезистентности данных микроорганизмов, встречаются штаммы, резистентные ко всем основным антимикробным препаратам. Из-за этого МО образно окрестили «грамотрицательные MRSA».
Это бактерии, способные к трансформации [9, 10]. Бактериальная трансформация предполагает передачу ДНК от бактерии-донора к бактерии-реципиенту через промежуточную жидкую среду и может быть использована для восстановления повреждений ДНК или как средство для обмена генетической информацией. Маркеры устойчивости к антибиотикам часто плазмидного происхождения, и плазмиды, присутствующие в штаммах Acinetobacter spp,. могут быть переданы другим патогенным бактериям через горизонтальный перенос генов. Способность видов Acinetobacter spp. прилипать к поверхностям, чтобы сформировать биопленки, устойчивость к антибиотикам (перенос гена), стимулируют исследование факторов, ответственных за их распространение [11].
Факторы патогенности и вирулентности
В прошлом представители рода Acinetobacter spp. считались микроорганизмами с низкой вирулентностью или авирулентными. Возникновение молниеносной внебольничной пневмонии, вызванной Acinetobacter spp., указывает на то, что эти бактерии могут иногда быть высоковирулентными и вызвать тяжелые заболевания. Исследования по факторам вирулентности Acinetobacter spp. все еще находятся на начальной стадии. Неспецифические факторы, такие как фимбрии, были описаны у Acinetobacter spp., и известно, что в условиях дефицита железа бактериальный рост может сопровождаться производством рецепторов катехин сидерофоров, которые, в свою очередь, способствуют росту бактерий и экспрессируют факторы вирулентности. Acinetobacter spp. имеет липополисахарид, как и другие грамотрицательные бактерии, который ответственен за высокую токсичность для мышей, приводящей к смерти, и положительный лизат-тест (обнаружение эндотоксина) при ацинетобактерной септицемии. Липополисахариды действуют синхронно с капсульным экзополисахаридом. Капсульный полисахарид, как известно, дополнительно блокирует доступ к микробной клеточной стенке и предотвращает срабатывание альтернативного пути активации комплемента. Экзополисахарид, продуцируемый бактериями, является основным фактором вирулентности и, как полагают, защищает бактерии от протективных антител организма. Экзополисахарид цитотоксичен для фагоцитов и приводит к летальности мышей. Примерно 30 % штаммов Acinetobacter spp. производят экзополисахарид. Этот процесс был изучен для штамма Acinetobacter spp. BD4, который в толстой капсуле имеет экзополисахарид, состоящий из рамнозы, маннозы, глюкозы и глюкуроновой кислоты. В экспериментальных исследованиях была доказана более высокая вирулентность экзополисахарид-продуцирующих штаммов Acinetobacter spp., чем у неэкзополисахарид-продуцирующих штаммов, особенно при полимикробной инфекции. С учетом того, что Acinetobacter spp. часто мультирезистентны к антибиотикам, выявление факторов, влияющих на вирулентность, может решить проблему разделения выделенных штаммов на потенциально высоко- и низковирулентные. Антибактериальной терапии можно было бы избежать для штаммов с потенциально низкой вирулентностью, тогда как выявление высоковирулентных штаммов, колонизирующих дыхательные пути, должно привести к усилению профилактических мер и раннего лечения антибиотиками для пациентов с высоким риском. Всегда поощряется тщательное мытье рук с мылом и водой, использование гелей на спиртовой основе [6].
Эпидемиология и патогенез
Микроорганизмы рода Acinetobacter spp. распространены повсеместно. Они являются нормальными обитателями кожных покровов у 25 % здоровых людей. В случае возможного участия Acinetobacter spp. при бактериемии, которая развивается во время использования у больного внутривенных катетеров, основными входными воротами инфекции считаются кожные покровы. Возросшая частота вызванной Acinetobacter spp. пневмонии, как первичной, так и развившейся в результате суперинфекции, также свидетельствует в пользу того, что дыхательные пути могут служить важными воротами инфекции. По всей вероятности, эти микроорганизмы являются обычными комменсалами, обладающими относительно низкой вирулентностью, которая гораздо чаще обусловливает бактерионосительство, чем вызывает развитие инфекции. Создается впечатление, что болезни, вызываемые Acinetobacter spp., развиваются у лиц, неожиданно встречающихся с внутрибольничной грамотрицательной инфекцией. Частота возникновения ацинетобактерной инфекции возрастает. В Великобритании количество бактериемий, обусловленных Acinetobacter spp., с 2002 по 2003 г. увеличилось на 6 % и составило 1087 случаев. Серьезной проблемой для этой страны является значительное повышение частоты бактериемий, вызванных мультирезистентными штаммами Acinetobacter spp., — более чем на 300 % с 2002 по 2003 г. (7 и 22 случая соответственно). В ОИТ США уровень Acinetobacter-пневмоний повысился с 4 % в 1986 г. до 7 % в 2003 г. [12].
Эпидемиологические данные свидетельствуют, что биопленки Acinetobacter spp. на слизистых оболочках играют определенную роль в таких инфекционных заболеваниях, как пародонтит, инфекции кровотока и инфекции мочевыводящих путей, из-за способности бактерий колонизировать постоянное медицинское оборудование (например, катетеры).
В некоторых регионах проблема нозокомиальной ацинетобактерной инфекции выходит на основные позиции. Так, в Израиле, по данным сайта antibiotic.ru, в последнее десятилетие Acinetobacter spp. стал ведущей причиной вентилятор-ассоциированной пневмонии и бактериемии. Распространение данного возбудителя происходило быстрыми темпами. Еще 7–8 лет назад в Израиле не было случаев инфекций, вызванных Acinetobacter spp., а сегодня только в Тель-Авиве ежегодно регистрируют около 500 случаев, 50 из которых заканчиваются летальным исходом. В результате ретроспективного когортного исследования, включавшего 236 пациентов, установлено, что инфекции, вызванные полирезистентными штаммами А.baumannii, сопровождались менее благоприятным исходом. В группе пациентов, у которых выделялись полирезистентные штаммы, летальность составляла 36 %, тогда как при инфицировании неполирезистентным штаммом — 21 %. Ацинетобактерии очень трудно поддаются идентификации. В то время как меры по эрадикации MRSA и Clostridium difficile в медицинских учреждениях Тель-Авива были успешными, справиться с Acinetobacter spp. не удалось. С начала войны в Ираке более 700 американских солдат были инфицированы А.baumannii. Четыре гражданских лица, проходящих лечение в медицинском центре армии в Вашингтоне, округ Колумбия, инфицировались A.baumannii и умерли. В другом региональном медицинском центре, военном госпитале США в Германии, 63-летняя немка, работающая по контракту, заразилась тем же штаммом А.baumannii на военном объекте и также умерла. На основании генотипирования А.baumannii, культивируемых от пациентов до начала войны в Ираке, можно предположить, что, скорее всего, эти солдаты заразились во время госпитализации и лечении в Европе. Э. Харрис (США) в своем докладе заявил, что сегодня крайне необходимо вести поиск мер профилактики и новых препаратов для лечения. Необходимы новые антибиотики, активные в отношении грамотрицательных возбудителей, хотя в настоящее время подобные препараты не разрабатываются [13].
Диагностика
Диагностика инфекции, вызванной Acinetobacter, может быть затруднена тем, что персонал лабораторий клинической бактериологии мало осведомлен об этих микроорганизмах, что приводит к неправильной интерпретации результатов исследования. Путаница, наблюдающаяся при таксономической классификации этих микроорганизмов, также не облегчает задачу. В практической медицине выделение представителей Acinetobacter spp. из крови, спинномозговой жидкости, мокроты, мочи или гноя должно расцениваться как имеющее клиническое значение, если нет доказательств одновременного наличия какого-либо другого возбудителя. Обязательной является дифференциация Acinetobacter и Neisseria, так как первые устойчивы к пенициллину, а вторые — чувствительны.
Различные виды бактерий в этом роду могут быть идентифицированы с помощью флуоресценции денитрификации лактозы-ФДЛ (Fluorescence-Lactose-Denitrification — FLN) по количеству образующейся кислоты при метаболизме глюкозы. Другой надежный идентификационный тест на уровне рода является хромосомный ДНК-преобразующий анализ (chromosomal DNA transformation assay — CTA). В этом анализе природный триптофан, ауксотрофномодифицированная часть Acinetobacter Lyi (BD4 trpE27), преобразуется с общей ДНК предполагаемого изолированного штамма ацинетобактерии, и преобразованная смесь помещается в агар с добавлением экстракта сердца, мозговой ткани (brain heart infusion agar — BHI). Растет в течение 24 ч при 30 ° С, затем после инкубации культуру собирают и переносят для выращивания на минимальный агар для Acinetobacter (Acinetobacter minimal agar — АММ) и инкубируют при 30 °С в течение 108 ч. Рост на минимальной агаризованной среде указывает на положительный анализ трансформации и подтверждает изолят в качестве члена рода Acinetobacter. Кишечную палочку E.coli HB101 и A.calcoaceticus MTCC1921T можно использовать в качестве отрицательного и положительного контролей соответственно.
Мы предлагаем краткую схему идентификации представителей рода Acinetobacter spp. для практических бактериологов, работающих в больничных учреждениях (табл. 1).
Выводы
1. В клинической практике все большее значение приобретают представители рода Acinetobacter spp., такие как A.baumannii и A.lwoffii.
2. Чаще инфицируются люди, находящиеся на длительном лечении в хирургических стационарах, отделениях реанимации и интенсивной терапии, ожоговых отделениях; представители этого рода способны вызывать вспышки заболеваний во время стихийных бедствий.
3. Заболевание чаще развивается у лиц с ослабленным иммунитетом, снижением резистентности организма.
4. Предлагается схема идентификации Acinetobacter spp. для практического врача-бактериолога, которая поможет установить наличие этих бактерий в клиническом материале.
1. Перцева Т.А. Клинически значимые возбудители инфекций дыхательных путей. Конспект врача–клинициста и микробиолога. Часть 4 «Проблемные» грамнегативные микроорганизмы: синегнойная палочка и ацинетобактер / Т.А. Перцева, Р.А. Бонцевич // Клиническая иммунология. Аллергология. Инфектология. — 2007. — № 7. — С. 32–35.
2. Коротяев А.И. Энтеробактерии // Медицинская микробиология, иммунология и вирусология / А.И. Коротяев, С.А. Бабичев. — СПб.: Специальная литература, 2008. — С. 347–348.
3. Environmental biodiversity, human microbiota, and allergy are interrelated / I. Hanski., L. von Hertzen, N. Fyhrquist [et al.] // Proc. Natl Acad. Sci. USA. — 2012. — Vol. 109. — № 21. — P. 8334–8339.
4. The allergy–protective properties of Acinetobacter lwoffii F78 are imparted by its lipopolysaccharide / J. Debarry, A. Hanuszkiewicz, K. Stein [et al.] // Allergy. — 2010. — Vol. 65, № 6. — P. 690–697.
5. Visca P. Acinetobacter infection — an emerging threat to human health / P. Visca, H. Seifert, K.J. Towner // IUBMB Life. — 2011. — Vol. 63, № 12. — P. 1048–1054.
6. Joly-Guillou M.L. Clinical impact and pathogenicity of Acinetobacter / M.L. Joly-Guillou // Clin. Microbiol. Infect. — 2005. — Vol. 11, № 11. — P. 868–873.
7. Characterization of plant growth promoting traits of Acinetobacter species isolated from rhizosphere of Pennisetum glaucum / F. Rokhbakhsh-Zamin, D. Sachdev, N. Kazemi–Pour [et al.] // J. Microbiol. Biotechnol. — 2011. — Vol. 21, № 6. — P. 556–566.
8. Gene-Silencing Antisense Oligomers Inhibit Acinetobacter Growth In Vitro and In Vivo / B.L. Geller, K. Marshall-Batty, F.J. Schnell [et al.] // J. Infect. Dis. — 2013. — Vol. 208, № 10. — P. 1553–1560.
9. Physiological characterization of natural transformation in Acinetobacter calcoaceticus / R. Palmen, B. Vosman, P. Buijsman [et al.] // J. Gen. Microbiol. — 1993. — Vol. 139, № 2. — P. 295–305.
10. Michod R.E. Adaptive value of sex in microbial pathogens / R.E. Michod, H. Bernstein, A.M. Nedelcu // Infect. Genet. Evol. — 2008. — Vol. 8, № 3. — P. 267–285.
11. Rahal J. Novel antibiotic combinations against infections with almost completely resistant Pseudomonas aeruginosa and Acinetobacter species / J. Rahal // Clin. Infect. Dis. — 2006. — Vol. 43, Suppl. 2. — P. 95–99.
12. Deciphering the Multifactorial Nature of Acinetobacter baumannii Pathogenicity / L.C. Antunes, F. Imperi, A. Carattoli, P. Visca // PLoS One. — 2011. — Vol. 6, № 8. — e22674.
13. Acinetobacter baumannii infections among patients at military medical facilities treating injured U.S. service members, 2002–2004 / Centers for Disease Control and Prevention (CDC) // MMWR Morb. Mortal. Wkly Rep. — Vol. 53, № 45. — P. 1063–1066.

/125/125.jpg)