Журнал «Здоровье ребенка» 1 (52) 2014
Вернуться к номеру
Імунологічні основи вакцинації
Авторы: Чернишова Л.І., Волоха А.П., Лапій Ф.І. - НМАПО імені П.Л. Шупіка, м. Київ
Рубрики: Педиатрия/Неонатология
Разделы: Медицинское образование
Версия для печати
Статья опубликована на с. 188-192
Актуальність теми. Імунопрофілактика є одним із найважливіших методів профілактики захворювань. Знання механізмів формування імунної відповіді на вакцинацію є фундаментом для розуміння сучасних підходів до проведення як пасивної, так і активної імунопрофілактики.
Загальна мета: розуміти механізми формування імунної відповіді на вакцинацію.
Конкретні цілі: знати поняття щодо видів імунітету, етапність формування імунної відповіді, особливості формування імунної відповіді залежно від видів вакцин.
Зміст навчання
Теоретичні питання
1. Поняття про активну імунізацію.
2. Формування імунного захисту при вакцинації:
A. Початок імунної відповіді — роль вродженого імунітету.
Б. Продукція антиген-специфічних антитіл при вакцинації.
3. Генерація адаптивної імунної відповіді на різні типи вакцин.
Вступ
Ще в XV столітті китайці й турки намагалися стимулювати імунітет до віспи, використовуючи струпи від виразок хворих на віспу, вдихаючи подрібнені кірки або вставляючи їх у невеликі розрізи. Ці початкові спроби імунізації привели до подальших експериментів з імунізацією Едварда Дженнера в 1798 році. Експерименти Едварда Дженнера з коров’ячою віспою щодо стимуляції імунітету проти віспи відомі краще, ніж ранні спроби імунізації. Д-р Дженнер відкрив один із фундаментальних принципів імунізації. Він застосовував відносно нешкідливу сторонню субстанцію для активації імунної відповіді, що захищала людину від інфекційного захворювання. Ці ранні зусилля привели до створення багатьох вакцин, що доступні сьогодні. Хоча ці спроби були успішними у формуванні імунітету, основні механізми створення післявакцинального імунітету залишались невідомими.
Поняття про активну імунізацію
Активна імунізація — процес генерації адаптивної імунної відповіді в неімунного індивіда при контакті з антигеном. Імунна відповідь формується у строк від кількох днів до кількох тижнів. На відміну від пасивної імунізації активна імунізація зазвичай створює довготривалий імунітет за рахунок стимуляції імунної системи людини. Активна імунізація може відбутися природним шляхом або штучно. Природний активний імунітет формується після перенесення інфекції як довгостроковий або довічний захист проти інфекційного збудника. До появи вакцин несприйнятливість до хвороби можна було виробити єдиним способом — перехворіти цією хворобою і, якщо пощастить, залишитися в живих. Це називається набутим природним імунітетом.
Штучна активна імунізація включає різні типи вакцинації. Щеплення не призводять до розвитку інфекційного захворювання, але стимулюють імунну відповідь, необхідну для формування імунітету проти інфекційного збудника або його токсинів. Вакцини, завдяки яким виробляється штучний імунітет, — це більш простий і менш ризикований спосіб стати несприйнятливим до хвороб.
Формування імунного захисту при вакцинації
Контроль за інфекційними захворюваннями та їх елімінація вимагають створення захисного імунітету в достатньої частини населення. Це досягається шляхом впровадження програм імунізації, здатних індукувати довготривалий захист проти інфекційних збудників. Довгостроковий імунітет забезпечується підтриманням захисного рівня антиген-специфічних антитіл та формуванням імунних клітин пам’яті, здатних до швидкої реактивації й продукції антитіл у разі проникнення мікроорганізмів. Антитіла, здатні зв’язувати токсини або патогени, є основними імунними ефекторами при вакцин-індукованій відповіді. До інших потенційних ефекторів належать цитотоксичні CD8+ Т-лімфоцити, що можуть обмежити або припинити поширення інфекційних збудників (наприклад, вірусів) шляхом руйнування інфікованих ними клітин організму. У формуванні й підтриманні імунної відповіді В-лімфоцитів і CD8+ Т-лімфоцитів беруть участь CD4+ Т-хелпери, що продукують відповідні сигнали й цитокіни. Імунні ефектори (антитіла та CD8+ Т-лімфоцити) перебувають під контролем регуляторних CD4+ Т-клітин (Treg), що беруть участь у підтримці імунної толерантності.
Ефекторні механізми імунної відповіді (С.-А. Siegrist):
1. Антитіла запобігають інфекції або зменшують її активність:
— взаємодіють з активним центром токсинів і перешкоджають їх поширенню;
— нейтралізують віруси та запобігають їх проникненню в клітини;
— сприяють опсонофагоцитозу бактерій макрофагами і нейтрофілами;
— активують систему комплементу та збільшують продукцію опсонінів.
2. CD8+ Т-лімфоцити здійснюють контроль і знищення внутрішньоклітинних збудників:
— безпосередньо знищують інфіковані клітини (вивільнення цитотоксичних компонентів — перфорину, гранзимів тощо);
— опосередковано руйнують інфіковані клітини вивільненням цитокінів.
3. CD4+ Т-лімфоцити беруть участь у механізмах контролю та елімінації різних збудників:
— продукують IFN-g, TNF-a/-b, IL-2 і IL-3 і підтримують активацію і диференціювання В-клітин, CD8+ Т-клітин і макрофагів (Th1-клітини);
— продукують IL-4, IL-5, IL-13, IL-6 і IL-10 і підтримують активацію й диференціювання В-лімфоцитів (Th2-клітини).
Початок імунної відповіді — роль вродженого імунітету
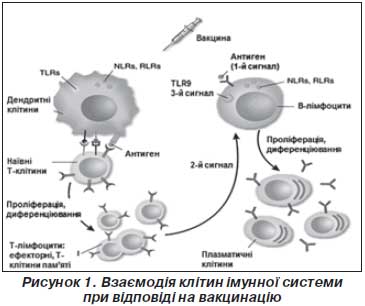
При проникненні в організм антигенів збудників або вакцинальних антигенів відбувається їх розпізнавання клітинами імунної системи як чужорідних агентів. Це початкове виявлення антигенів здійснюють клітини вродженої ланки імунної системи (дендритні клітини, макрофаги, нейтрофіли) за допомогою рецепторів розпізнавання неспецифічних структур мікроорганізмів. До таких рецепторів належать Toll-подібні рецептори, що розпізнають певні стабільні молекулярні структури інфекційних збудників (РАМР), такі як компоненти бактеріальної стінки (ліпополісахарид, пептидоглікан, ліпопептиди), флагелін бактерій, бактеріальну та вірусну ДНК, вірусну РНК тощо. При взаємодії Toll-подібних рецепторів із молекулами збудників або певними вакцинальними антигенами відбувається розпізнавання їх як патогенів, активація й дозрівання дендритних клітин. Важливою умовою активації дендритних клітин є запальна реакція, опосередкована клітинами вродженої імунної системи. Продукція прозапальних цитокінів та хемокінів, залучення у вогнище проникнення патогену нейтрофілів, моноцитів, природних кілерів сприяє активації дендритних клітин, необхідній для подальшої індукції адаптивної імунної відповіді (відповіді Т- і В-лімфоцитів). При розпізнаванні чужорідних агентів без супутньої запальної реакції дендритні клітини залишаються незрілими, при контакті їх із наївними Т-клітинами останні диференціюються в регуляторні CD4+ Т-клітини, що підтримують імунологічну толерантність.
Активовані дендритні клітини та макрофаги захоплюють чужорідні агенти, мігрують у реґіонарні лімфатичні вузли, де стимулюють антиген-специфічну відповідь Т- і В-лімфоцитів. Дендритні клітини переробляють антиген і представляють його Т- і В-лімфоцитам у комплексі з молекулами головного комплексу гістосумісності ІІ класу (МНС ІІ). У процесі презентації антигену зрілі дендритні клітини активують наївні CD4+ Т-лімфоцити (Т-хелпери). CD4+ Т-хелпери диференціюються в ефекторні імунні клітини, стимулюють продукцію антигенспецифічних антитіл В-лімфоцитами й утворення специфічних щодо антигену цитотоксичних CD8+ Т-лімфоцитів.
Живі вірусні вакцини ефективно запускають активацію імунної системи, оскільки імунна відповідь на них подібна до відповіді на природну інфекцію. Після введення живої вірусної вакцини та її дисемінації в організмі відбувається активація великої кількості дендритних клітин, що мігрують у відповідні лімфатичні вузли та запускають активацію Т- і В-клітинної відповіді. Це пояснює більш високу імуногенність живих вакцин порівняно з інактивованими вакцинами. Щоб перемогти вірус, В-клітини перетворюються на фабрики з виробництва плазматичних клітин, що виробляють антитіла. Цитотоксичні Т-клітини знищують клітини, заражені вірусом; Т-хелпери направляють дію за допомогою хімічних сигналів.
Живі бактеріальні вакцини (БЦЖ) розмножуються в місці інокуляції та в регіонарних лімфатичних вузлах, де відбувається генерація імунної відповіді.
До складу інактивованих (неживих) вакцин, що містять протеїни, полісахариди, кон’югати полісахаридів з протеїнами та інактивовані мікроорганізми, також входять молекулярні структури, які можуть розпізнаватися Toll-подібними рецепторами та ініціювати відповідь вродженого імунітету. За відсутності мікробної реплікації вакцин-індукована активація залишається обмеженою. Інактивовані вакцини стимулюють імунну відповідь у місці ін’єкції, тому місце і шлях введення вакцини є важливими передумовами формування ефективної імунної відповіді. Найкращим способом введення вакцини вважають внутрішньом’язові ін’єкції, оскільки у добре васкуляризованих м’язах «патрулює» велика кількість дендритних клітин. Жирова тканина містить меншу кількість дендритних клітин. Активовані дендритні клітини мігрують у регіонарні лімфатичні вузли: в аксилярні — при введенні в дельтоподібний м’яз і пахові — при введенні в м’язи стегна. Первинна імунна відповідь при введенні інактивованих вакцин формується локально, що дає змогу вводити одночасно декілька вакцин в різні місця в організмі. Більшість інактивованих вакцин включають ад’ювант, який сприяє достатній активації вродженої системи імунітету. Ад’юванти розподіляють на дві групи: 1) компоненти, які створюють депо в місці введення антигену, що сприяє залученню більшої кількості дендритних клітин; 2) компоненти, що забезпечують додаткову стимуляцію дендритних клітин та моноцитів. Жоден з ад’ювантів на сьогодні не здатний активувати вроджену імунну відповідь так, як живі вакцини.
Продукція антиген-специфічних антитіл при вакцинації
Активація В-лімфоцитів і продукція антитіл відбуваються в лімфатичних вузлах, у які проникають вакцинальні антигени в поєднанні з мігруючими дендритними клітинами або вільні антигени. Білкові антигени активують В- і Т-лімфоцити, що приводить до індукції високоефективної відповіді В-клітин, яка полягає у проліферації й диференціюванні В-лімфоцитів у плазматичні клітини, які продукують антитіла, та В-клітини пам’яті. Полісахаридні антигени, що не активують Т-лімфоцити, викликають слабшу й короткотривалу продукцію антитіл і не формують імунну пам’ять.
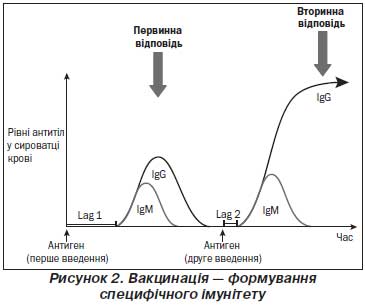
Т-залежна відповідь на білкові антигени. Наївні В-лімфоцити утворюються в кістковому мозку та циркулюють в організмі до зустрічі з антигеном, специфічним щодо їх поверхневого IgM-рецептора. Розпізнавання антигену білкової природи поверхневим рецептором приводить до активації В-лімфоцита й міграції його в напрямку Т-клітинної зони вторинних лімфоїдних органів. В-лімфоцити, специфічні до вакцинального антигену, взаємодіють з активованими відповідним антигеном дендритними клітинами та Т-лімфоцитами й отримують від них додаткові стимулюючі сигнали. Після активації антиген-специфічними Т-хелперами В-лімфоцити розмножуються в гермінативних центрах і диференціюються в плазматичні клітини. Утворення гермінативних центрів відбувається за допомогою фолікулярних дендритних клітин та фолікулярних Т-хелперів, від яких активовані антиген-специфічні В-лімфоцити отримують додаткову стимуляцію. Масивна клональна проліферація В-лімфоцитів приводить до формування гермінативних центрів — кожний гермінативний центр походить від однієї антиген-специфічної В-клітини. Інтенсивна проліферація В-лімфоцитів асоціюється з двома основними подіями: переключенням синтезу імуноглобулінів з IgM на IgG, IgA, IgE і дозріванням афінності В-лімфоцитів до специфічного для них антигену. Це сприяє збільшенню продукції антитіл із більшою «здібністю» до зв’язування антигену. Міжклітинна взаємодія В-лімфоцитів із дендритними клітинами та Т-хелперами сприяє проліферації найбільш специфічних щодо антигену В-лімфоцитів та формуванню В-клітин пам’яті.
Розвиток ефективної відповіді гермінативних центрів відбувається за 10–14 днів після введення вакцинальних антигенів білкової природи. Через 3–6 тижнів активна продукція антитіл обмежується. Продукція специфічних до вакцини IgG досягає піку через 4–6 тижнів після первинної імунізації, після чого активна продукція антитіл плазматичними клітинами в гермінативних центрах поступово знижується.
Т-незалежна відповідь на полісахаридні антигени. Вакцинальні полісахаридні антигени бактерій S.pneumoniae, N.meningitidis після ін’єкційного введення в організм потрапляють в кров і досягають селезінки та лімфатичних вузлів. Полісахариди зв’язуються з В-лімфоцитами маргінальної зони селезінки, їх активація й проліферація реалізуються в продукції специфічних антитіл класів IgM та IgG вже через тиждень після введення антигенів. Полісахаридні вакцини генерують імунну відповідь без допомоги Т-лімфоцитів (Т-незалежну), що характеризується продукцією помірної кількості низькоафінних антитіл і відсутністю імунологічної пам’яті. Повторне введення полісахаридних вакцин приводить до формування імунної відповіді, подібної до первинної відповіді на цей антиген.
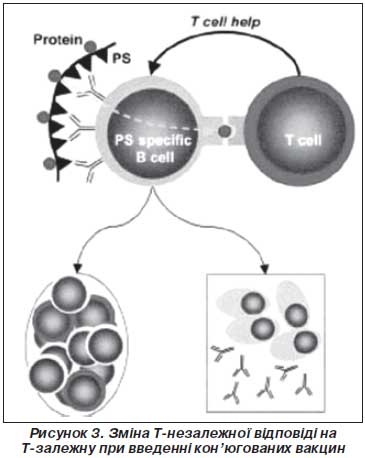
Т-залежна відповідь на полісахаридні антигени, кон’юговані з білками. Для отримання Т-залежної відповіді на полісахарид його почали зв’язувати (кон’югувати) з білком, на який може виникати Т-залежна відповідь. Кон’юговані білкова й полісахаридна молекули фагоцитуються дендритними клітинами, переробляються й презентуються в комплексі з МНС ІІ CD4+ Т-лімфоцитам. Активація Т-хелперів і додаткова стимуляція ними В-лімфоцитів змінює Т-незалежну імунну відповідь на Т-залежну з формуванням великої кількості високо афінних антитіл та В-клітин пам’яті.
Генерація адаптивної імунної відповіді на різні типи вакцин
Анатоксини (правцевий, дифтерійний, кашлюковий) за своїми фізико-хімічними властивостями подібні до токсинів, але не виявляють токсичної дії і індукують продукцію антитіл, що перехресно реагують із токсином. Після внутрішньом’язового введення вакцини проти правця молекули анатоксину захоплюються незрілими дендритними клітинами в місці ін’єкції, переробляються в ендосомах і з’єднуються з молекулами головного комплексу гістосумісності ІІ типу (МНС ІІ типу). Комплекс «МНС ІІ — анатоксин» мігрує на поверхню клітини, після чого активована зріла дендритна клітина рухається в напрямку регіонарного лімфатичного вузла. У лімфатичному вузлі комплекс «МНС ІІ — анатоксин» дендритних клітин взаємодіє з відповідним йому унікальним Т-клітинним рецептором наївних CD4+ Т-лімфоцитів, що приводить до активації й проліферації Т-хелперів 2-го типу (Th2). Вільні молекули правцевого анатоксину по лімфатичних судинах досягають регіонарного лімфатичного вузла й контактують із специфічними імуноглобуліновими рецепторами В-лімфоцитів, що розпізнають анатоксин. Молекула анатоксину захоплюється В-клітиною, переробляється в ендосомах і мігрує на поверхню В-лімфоциту в комплексі з молекулою МНС ІІ класу подібно до відповідного процесу в дендритних клітинах. В-клітини з комплексом «МНС ІІ — анатоксин» взаємодіють з активованими CD4+ Т-лімфоцитами, рецептори якого специфічні до правцевого анатоксину. Продукція клітинами Th2 інтерлейкінів IL-2, IL-4, IL-5, IL-6 активує В-клітини, відбувається їх диференціювання у плазматичні клітини, що продукують антитіла, та В-клітини пам’яті. Таким чином формується адаптивна імунна відповідь на білкові молекули всіх анатоксинів — Т-залежна імунна відповідь.
Вбиті/інактивовані вакцини. Термін «інактивовані вакцини» застосовується щодо вірусних вакцин (інактивована вакцина проти поліомієліту, вакцина проти гепатиту А), «убиті» вакцини включають бактеріальних збудників (вакцина проти черевного тифу, цільноклітинна кашлюкова вакцина).
Адаптивна імунна відповідь на інактивовані вакцини подібна до відповіді на анатоксини за винятком генерації синтезу антитіл до більшої кількості антигенів. Інактивовані збудники захоплюються дендритними клітинами, різні антигени мікроорганізму презентуються відповідним Th2-клітинам.
Субодиничні вакцини. До складу субодиничних вакцин входять окремі антигени збудників, що стимулюють продукцію антитіл В-лімфоцитами і таким чином запобігають інфікуванню організму патогенними збудниками. Вакцини проти гепатиту В та грипу належать до субодиничних вакцин, вакцина проти гепатиту В містить один антиген — поверхневий білок вірусу HBsAg, вакцина проти грипу — два антигени: гемаглютинін та нейрамінідазу. Імунна відповідь на білкові антигени Т-залежна, формується подібно до імунної відповіді на анатоксини.
До субодиничних вакцин належить також полісахаридна вакцина проти пневмококу, що містить капсулярні полісахариди 23 штамів пневмококу. Полісахаридна пневмококова вакцина генерує Т-незалежну адаптивну імунну відповідь. Процес кон’югації полісахаридних молекул пневмокока з білковими молекулами-носіями (дифтерійний анатоксин, поверхневий білок H.іnfluenzae) перетворює Т-незалежну імунну відповідь на більш тривалу і ефективну Т-залежну.
Живі атенуйовані вакцини містять живі ослаблені віруси (вакцина проти кору, епідемічного паротиту, краснухи, вітряної віспи, поліомієліту, жовтої лихоманки) або бактерії (вакцина БЦЖ). Живі атенуйовані вакцини успішно індукують ефекторну відповідь як клітинного (CD4+ і CD8+ Т-лімфоцити), так і антитіло-опосередкованого (В-лімфоцити) імунітету, а також формують імунологічну пам’ять.
При введенні вакцини віруси захоплюються дендритними клітинами, відбувається їх деградація всередині клітини, і окремі протеїни вірусу в комплексі з молекулами МНС І типу презентуються цитотоксичним Т-лімфоцитам. Т-лімфоцити із високоспецифічними щодо вірусних антигенів рецепторами розпізнають клітину-мішень, вивільнюють цитокіни (перфорин, гранзими) та руйнують клітину шляхом апоптозу.
Таким чином, вакцини використовують природну здатність імунітету навчатися тому, як знищувати будь-які (майже всі) хвороботворні мікроорганізми, що його атакують. Більш того, організм «запам’ятовує», як можна захиститися від мікробів, з якими він уже стикався раніше.
Якщо критичне число (95 %) людей в суспільстві пройшли вакцинацію проти конкретної інфекції, знижується ймовірність зараження цією інфекцією у всьому суспільстві. Такий захист називається колективним імунітетом, або популяційним імунітетом.

1. Дитяча імунологія / Під ред. проф. Л.І. Чернишової та А.П. Волохи. — К.: ВСВ «Медицина», 2013. — 720 с.
2. Baxter D. Active and passive immunity, vaccine types, excipients and licensing // Occupational Medicine. — 2007. — Vol. 57. — P. 552-556.
3. Beverley P.C.L. Immunology of vaccination // British Medical Bulletin. — 2002. — 62. — 15-28.
4. Kindt J., Goldsby R.A., Osborne B.A. Kuby Immunology. — 6th ed. — New York: W.H. Freeman and Company, 2007.
5. Marcus C., Gitika Dhillon G., Anolik J.H. B Cell immunology for the clinician // The Pediatric Infectious Disease Journal. — Vol. 30, № 2.
6. Oberdan Leo, Cunningham A., Stern P.L. Vaccine immunology // Understanding Modern Vaccines: Perspectives in Vaccinology. — Ch. 2. — 2011. — Vol. 1, Issue 1. — P. 25-59.
7. Siegrist C.A. Vaccine immunology // Plotkin S.A., Orenstein W.A., Offit P.A. (eds). Vaccines. — 5th ed. — New York: Saunders Elsevier, 2008. — P. 17-36.
8. Vinuesa C.G., C. de Lucas, Cook M.C. Clinical implications of the specialised B cell response to polysaccharide encapsulated pathogens// Postgrad. Med. J. — 2001. — Vol. 77. — P. 562-569.
9. Ammanna I.J., Nichole E., Carlson N.E., Slifka M.K. Duration of humoral immunity to common viral and vaccine antigens // N. Engl. J. Med. — 2007. — Vol. 357. — P. 1903-15.