Журнал «Медицина неотложных состояний» 2 (49) 2013
Вернуться к номеру
Хирургическая профилактика рецидива тромбоэмболии легочной артерии. Показания к использованию кава-фильтров и их возможности
Авторы: Осадчий А.И., Государственное научное учреждение «Научно-практический центр профилактической и клинической медицины» Государственного управления делами, г. Киев
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний, Кардиология, Хирургия
Разделы: Клинические исследования
Версия для печати
Тромбоз в системе нижней полой вены является наиболее частой причиной тромбоэмболических осложнений малого круга кровообращения на сегодняшний день. Ведущим патогенетическим звеном его развития является венозная тромботическая болезнь (ВТБ), включающая в себя тромбоз глубоких вен (ТГВ) нижних конечностей, тромбофлебит и тромбоз вен таза и нижней полой вены (НПВ). Наиболее грозным осложнением ВТБ является тромбоэмболия легочной артерии (ТЭЛА), попрежнему сопровождающаяся высокой летальностью — 28–30 %. Ее развитие выявляется у 40 % [10] больных ТГВ. Более чем в половине этих случаев наблюдается его бессимптомное течение [1, 2]. Острота вопроса усугубляется высокой частотой развития ТГВ среди госпитализированных. Так, ТГВ наблюдают у 10–13 % госпитализированных в терапевтические стационары, у 29–33 % пациентов палат интенсивной терапии, 20–26 % пациентов торакальных отделений, у 27–33 % пациентов с острым инфарктом миокарда (ОИМ) и 48 % пациентов после забора вен для аортокоронарного шунтирования (АКШ) [4]. Таким образом, очевидна роль методов профилактики для снижения риска развития ТГВ и осложнений. Высокая эффективность кавафильтров в предотвращении легочной эмболии и снижении госпитальной летальности [3], вопреки серьезным осложнениям их применения [5, 6], делает процедуру весьма востребованной [8, 9]. В ситуациях же, когда антикоагулянтная или тромболитическая терапия невозможна, процедура является методом выбора лечения [7].
Целью работы стал анализ использования кавафильтров с целью предупреждения рецидива ТЭЛА в долгосрочной перспективе у пациентов высокого риска тромботических осложнений.
Материалы и методы
Проведен ретроспективный анализ результатов клинического обследования 31 пациента в возрасте 43–81 года, которым в период 2002–2005 гг. имплантирован кавафильтр с целью профилактики рецидива ТЭЛА (табл. 1). Длительность наблюдения составила 3,4 ± 1,2 года. Женщин было 5 (22,2 %). Средний возраст пациентов составил 60,7 ± 10,5 года. Контрольную группу составили пациенты с ТГВ, получавшие консервативное лечение и сопоставимые с исследуемой группой. Диагноз предполагал анализ клинических данных и лабораторных исследований: общего анализа крови, мочи, биохимических показателей крови, включая определение уровня Ddim. Инструментальные исследования предполагали запись ЭКГ, ЭхоКГ, рентгенографию органов грудной клетки, компьютерную томографию и ангиопульмонографию. Объем лечебных мероприятий определялся с учетом клинической картины, длительности заболевания, расстройства центральной гемодинамики и дисфункции ПЖ по данным ЭхоКГ. Для имплантации использовали отечественный фильтр «Осот» — 17 (54,8 %) случаев, «TrapEase» — 11 (35,5 %) и в 3 (9,7 %) случаях фильтры иных моделей. Фильтры установлены в инфраренальную позицию доступом через яремную (n = 25) и бедренную (n = 6) вены. Имплантация фильтра производилась в среднем через 8,5 ± 1,2 суток от момента госпитализации либо установления клинического диагноза ВТБ (от 1 до 37 дней). И в 67,7 % случаев его имплантация была обусловлена рецидивом ВТБ или высоким риском развития легочной эмболии (ЛЭ) и низкой эффективностью проводимой антикоагулянтной терапии. Более чем у трети пациентов — 14 (45,2 %) наблюдался рецидив ТЭЛА, у 7 (22,6 %) — ТГВ с признаками флотирующих тромбов, у 5 (16,2 %) — сочетание ТЭЛА и рецидива ТГВ, а у остальных 5 (16,2 %) — злокачественные новообразования, осложненные ТГВ. Показаниями для установки фильтра были неадекватная антикоагулянтная терапия (61,4 %), осложнения антикоагулянтного лечения (5,6 %), низкая эффективность антикоагулянтной терапии (5,2 %) и соображения профилактики (27,8 %).
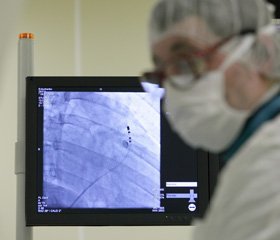
При обследовании проводилась оценка кавафильтра для подтверждения или исключения осложнений, связанных с его использованием (рис.1). С целью диагностики рецидива ЛЭ и ТГВ либо осложнений, связанных с фильтром, проводили дуплексное ультразвуковое сканирование (рис. 3–4), ангиопульмонографию в зависимости от клинической ситуации на госпитальном этапе и в период наблюдения.
/123/123.jpg)
Троим пациентам выполнена тромбэктомия из легочной артерии в связи с рецидивом ТЭЛА после установки кавафильтра. Отдаленные результаты лечения прослежены в среднем в сроки от 6 месяцев до 7 лет (30,12 ± 4,66 мес., ДИ 95% 20,59–39,71). Общее число осложнений составило 48,4 %, среди которых осложнений первого типа было 12,9 % и второго типа — 35,5 %. Осложнения первого типа имели преходящий характер и существенно не влияли на процесс лечения в отличие от осложнений второго типа. Более чем в половине случаев (63,6 %) их развитие произошло в первый год наблюдения, и они существенно влияли на качество жизни в отдаленном периоде. У больных с имплантированным кавафильтром рецидив ТЭЛА в течение госпитального периода не наблюдался, однако частота рецидивирования ТГВ в последующие 3 года была почти в 2 раза выше в сравнении с группой консервативного лечения (табл. 2).
Результаты и их обсуждение
Предотвращение легочной эмболии — неотъемлемый компонент лечения больных с ВТБ. В большинстве случаев ее профилактика осуществляется с помощью антикоагулянтных препаратов. Однако у больных с противопоказаниями к их приему, высоким риском кровотечений, частыми рецидивами ВТБ на фоне оптимального режима гипокоагуляции доказана высокая эффективность кавафильтров, имплантированных в нижнюю полую вену [4, 11]. Одним из показаний является обнаружение протяженных флотирующих тромбов, в ряде случаев хирургического вмешательства с целью предотвращения миграции тромбоэмболов имплантация кавафильтра рассматривается как надежная процедура [21, 22]. Высокая их эффективность вопреки значительному числу нежелательных осложнений, около 35 % [12, 13], делает процедуру широко применяемой. Только в США ежегодно проводят более 10 000 операций [2, 9]. Успешно применив фильтр у 96,7 % больных, мы также склонны подтвердить вышесказанное. Мы не наблюдали развития тромбоэмболии у пациентов, которым имплантирован кавафильтр на госпитальном этапе. Среди пациентов из группы получавших консервативное лечение она наблюдалась у 6,8 % (р = 0,04) пациентов — табл. 2. Высокоэффективной процедура может быть у пациентов с непрерывно рецидивирующим течением венозной тромботической болезни вопреки приему антикоагулянтов. Кроме риска ЛЭ они имеют высокую вероятность обнаружения злокачественных новообразований в течение ближайшего периода наблюдения [16]. Облигатная форма рака выяляется у 7–12 % из пациентов, имеющих идиопатическую форму ВТБ [12, 13]. В нашем наблюдении таких пациентов было 5 (16,2 %). Их характеристика представлена в табл. 1. Средний срок наблюдения до момента верификации онкопатологии составил 8 ± 3,4 месяца. Обнаруженные новообразования были локализованы преимущественно в брюшной полости и выявлены спонтанно при тщательном ультразвуковом обследовании. Именно этот момент может быть ключевым в целенаправленном поиске новообразований [15, 16]. Гиперкоагуляционный синдром, обусловленный малигнизацией, впервые описанный Trousseau, в 10–15 % случаев осложняется развитием венозных тромбозов. Зачастую это может быть первичной манифестацией онкопроцесса. Связывают это с повышением уровня факторов II, V, VIII, IX, X и снижением уровня АТIII, что понижает эффективность антикоагулянтов и повышает резистентность к ним [17, 19]. Рекомендации ASCO по лечению тромбозов вен и тромбоэмболий у онкологических больных требуют применения антикоагулянтов на протяжении первых 3–6 мес. вне зависимости от того, курабельно злокачественное заболевание или нет. И только в случае малой эффективности антикоагулянтной терапии или частых рецидивов ТБ, как в нашем наблюдении, показана имплантация кавафильтра [20] — процедура с низким риском осложнений, безопасная и эффективная для предотвращения легочной эмболии у пациентов с онкопатологией, которые имеют венозный тромбоз, позволяющая выполнить специфическое лечение без риска ТЭЛА [14, 18]. Имплантация была проведена четверым из наших пациентов.
/124/124.jpg)
Будучи высокоэффективными устройствами в предотвращении тромбоэмболических осложнений, кавафильтры таят угрозу развития значительного числа осложнений на всех этапах лечения, что предполагает их применение по строгим показаниям [7, 21, 22]. Среди осложнений описаны: миграция кавафильтра в полость правого желудочка, перфорация НПВ с кровотечением в забрюшинное пространство, перфорация ножками устройства стенки брюшной аорты, тромбоз фильтра, тромбоз НПВ [12–15]. Более чем у половины наших пациентов (67,7 % наблюдений), мы использовали кавафильтр в связи с рецидивом ВТБ или высоким риском развития ЛЭ, вопреки проводимой антикоагулянтной терапии, и в 27,8 % случаев с целью вторичной профилактики. В 92,7 % случаев его имплантация была успешной. В одном наблюдении (3,2 %) отмечена миграция устройства в правую общую подвздошную вену, что потребовало оперативного вмешательства и повторной имплантации устройства; в 6 (18,7 %) — его тромбоз в разные сроки наблюдения — от 6 месяцев до 5 лет. Тромбоз фильтра у 4 больных (66,6 %) развился в ранние сроки наблюдения, в среднем через 3 ± 0,8 месяца после имплантации, и был связан с прогрессированием онкопроцесса. Установлена умеренной силы прямая корреляционная зависимость тромбоза от прогрессирования основного заболевания (коэффициент ранговой корреляции Спирмена: 0,41; р < 0,05). На наш взгляд, тактика у этой категории пациентов была оправданна, поскольку дала возможность проводить адекватную терапию основного заболевания без риска развития тромбоэмболии. На рис. 2 представлен макропрепарат с задержанными тромбами в фильтре через 8 месяцев от начала лечения (первичный рак печени, посмертный препарат). В случае развития приобретенной тромбофилии на фоне кровоточащей фибромиомы имплантация кавафильтра дала возможность провести удаление миомы, предупредить рецидив ТЭЛА (рис. 3, 4 — задержанные тромботические массы) и выполнить хирургическую эмболэктомию из легочной артерии.
Мы полагаем, что строгое соблюдение показаний к имплантации кавафильтра, соответствующий опыт хирурга позволили нам свести к минимуму риск серьезных осложнений.
Выводы
1. Имплантация кавафильтра у 96,7 % больных оказалась эффективным методом профилактики тромбоэмболических осложнений на фоне рецидивирующего течения тромботической болезни и низкой эффективности антикоагулянтной терапии.
2. Тромбоз фильтра в ранние сроки наблюдения после имплантации обусловлен прогрессированием онкопроцесса на фоне тромбофилии с установленной умеренной силы прямой корреляционной зависимостью тромбоза от прогрессирования основного заболевания ( r = 0,41; р < 0,05).
3. У больных с имплантированным кавафильтром рецидив ТЭЛА в течение госпитального периода практически отсутствовал, однако частота рецидивирования ТГВ в последующие 3 года была в 2 раза выше.
4. Имплантация кавафильтра может рассматриваться как эффективная мера профилактики рецидива ТЭЛА у пациентов, имеющих противопоказания к использованию антикоагулянтов.
1. The House of Commons. The prevention of venous thromboembolism in hospitalised patients. HC99. — London: The Stationery Office Limited, 2005.
2. Arya R., ed. Venous thromboembolism prevention: a patient safety priority. — London: Department of Health, 2009.
3. PREPIC Study Group. Eightyear followup of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave) randomized study // Circulation. — 2005. — 112. — 41622.
4. Feied C., Handler J.A. Pulmonary embolism // Medicine J. — 2002. — Vol. 3, 1.
5. Mewissen M.W., Erickson S.J., Foley W.D., Lipchik E.O., Olson D.L., McCann K.M., Schreiber E.R. Thrombosis at venous insertion sites after inferior vena caval filter placement // Radiology. — 1989. — 173. — 155157.
6. Chandra P.A., Nwokolo C., Chuprun D., Chandra A.B. Cardiac tamponade caused by fracture and migration of inferior vena cava filter // South. Med. J. — 2008. — 101. — 11631164.
7. Management of Massive and Submassive Pulmonary Embolism, Iliofemoral Deep Vein Thrombosis, and Chronic Thromboembolic Pulmonary Hypertension: A Scientific Statement From the American Heart Association // Circulation. — 2011. — 123. — 17881830: originally published online March 21, 2011.
8. Stein P.D., Kayali F., Olson R.E. Twentyoneyear trends in the use of inferior vena cava filters // Arch. Intern. Med. — 2004. — 164. — 15411545.
9. Jaff M.R., Goldhaber S.Z., Tapson V.F. High utilization rate of vena cava filters in deep vein thrombosis // Thromb. Haemost. — 2005. — 93. — 11171119.
10. Stein P.D., Henry J.W. Prevalence of acute pulmonary embolism among patients in a general hospital and at autopsy // Chest. — 1995. — 108. — 97881.
11. Mismetti P., RivronGuillot K., Quenet S. et al. A Prospective Longterm Study of 220 Patients With a Retrievable Vena Cava Filter for Secondary Prevention of Venous Thromboembolism // Chest. — 2007. — 223229
12. Dinglasan L.A., Oh J.C., Schmitt J.E., Trerotola S.O., ShlanskyGoldberg R.D., Stavropoulos S.W. Complicated Inferior Vena Cava Filter Retrievals: Associated Factors Identified at Preretrieval CT // Radiology. — 2012, Oct 9.
13. Assifi M.M., Bagameri G., Dimuzio P.J., Eisenberg J.A. Management of infected caval filter with simultaneous aortic pseudoaneurysm and retroperitoneal perforation: a case report and literature review // Vascular. — 2012. — 20 (4). — 2258.
14. J. Clin. Oncol. — 25. — 54905505. © 2007 by American Society of Clinical Oncology.
15. Khorana A.A., Francis C.W., Culakova E. Thromboembolism is a leading cause of death in cancer patients receiving outpatient chemotherapy // J. Thromb. Haemost. — 2007. — 5. — 632634.
16. Sorensen H.T., Mellemkjaer L., Olsen J.H. et al. Prognosis of cancers associated with venous thromboembolism // N. Engl. J. Med. — 2000. — 343. — 18461850.
17. Caine G.J., Stonelake P.S., Lip G.Y. et al. The hypercoagulable state of malignancy: Pathogenesis and current debate // Neoplasia. — 2002. — 4. — 465473.
18. Prandoni P., Lensing A.W., Buller H.R., Cogo A., Prins M.H., Cattelan A.M. et al. Deepvein thrombosis and the incidence of subsequent symptomatic cancer // N. Engl. J. Med. — 1992. — 327. — 112833.
19. Piccioli A., Prandoni P. Screening for occult cancer in patients with idiopathic venous thromboembolism: yes // J. Thromb. Haemost. — 2003. — 1. — 22712.
20. Zerati A.E., Wolosker N., Yazbek G., Langer M., Nishinari K. Vena cava filters in cancer patients: experience with 50 patients // Postgraduate Medical Journal. — 2004. — 80. — 309319.
21. Hartung O., Alimi Y.S., Juhan C. Role of surgery and endovascular therapies in lover limb deep thrombosis / Eds. N. Labropoulos, G. Stansby // Venous Lymphatic Dis. — 2006. — 205222.
22. Кириенко А.И. Проблема послеоперационных венозных тромбоэмболических осложнений в хирургической практике // Ангиол. и сосуд. хир. — 2003. — 1. — 6265.

/123/123_2.jpg)
/124/124_2.jpg)
/125/125_2.jpg)
/125/125.jpg)