Международный эндокринологический журнал 8 (48) 2012
Вернуться к номеру
Рак щитоподібної залози
Авторы: Паньків В.І., Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ
Рубрики: Эндокринология
Разделы: Медицинское образование
Версия для печати
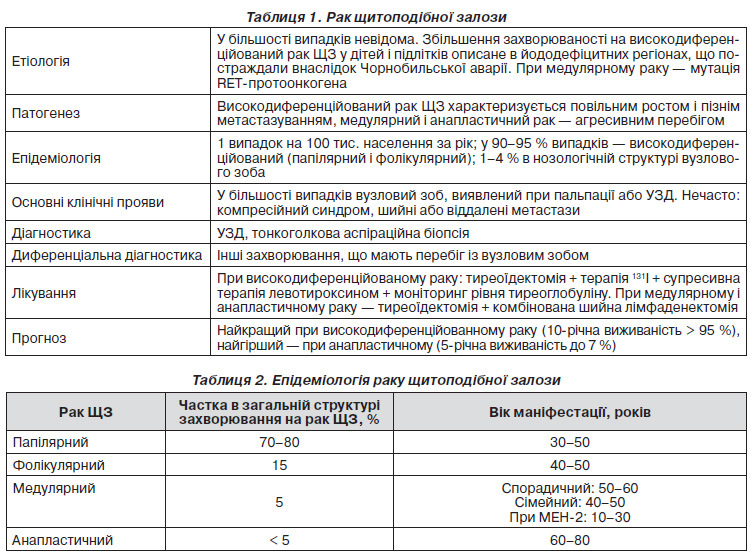
Рак щитоподібної залози (ЩЗ) — це збірна група злоякісних новоутворень людини, що складається з чотирьох основних типів пухлин, які відрізняються за походженням, морфологічними характеристиками, клінічним перебігом, ступенем біологічної агресивності й відповідно різними діагностичнолікувальними підходами. Рак — злоякісна пухлина з клітин тиреоїдного епітелію (фолікулярних, парафолікулярних). У переважній більшості випадків мова йде про високодиференційований рак ЩЗ, комплексне лікування якого навіть на відносно пізніх стадіях забезпечує високу виживаність і належну якість життя.
Виділяють папілярний і фолікулярний рак, що розвивається з фолікулярних клітин ЩЗ. Вони належать до диференційованих пухлин і мають сприятливий прогноз. Проміжне місце за прогнозом займає медулярний рак із парафолікулярних Склітин. Найбільш злоякісною й агресивною формою є недиференційований анапластичний рак із фолікулярних клітин.
Співвідношення основних форм раку ЩЗ приблизно таке: папілярний — 60–80 %, фолікулярний — 15–30 %, медулярний — 7–10 %, анапластичний — 2–5 %.
Етіологія раку щитоподібної залози
Етіологія раку в більшості випадків невідома, однак встановлено низку чинників, що провокують його розвиток. До таких факторів належать спадкова схильність до медулярного раку, вплив іонізуючої радіації, рентгенопромінення голови, шиї, грудної клітки з приводу різних захворювань, особливо у дітей, що може сприяти виникненню раку ЩЗ через 10–40 років після опромінення.
Найбільшу радіочутливість мають щитоподібні залози новонароджених і дітей, що пов’язують з високою проліферативною активністю тиреоцитів, формуванням нейрогормональної системи регуляції.
Доза зовнішнього опромінення, що індукує розвиток раку ЩЗ, вірогідно невідома. Доказові дані про те, що діагностичні й терапевтичні дози 131І можуть індукувати рак ЩЗ, відсутні. Найбільш імовірно, що зовнішнє опромінення також може сприяти індукції раку ЩЗ (зазвичай папілярного), переважно у дітей і осіб, молодших за 20 років. Після аварії на Чорнобильській атомній електростанції (ЧАЕС) захворюваність на рак ЩЗ у дітей за період від 1985 до 1993 року зросла в 34 рази. Проте в сусідніх регіонах Польщі, де була налагоджена масова йодна профілактика, цього не сталося. У зв’язку з цим викид радіоактивного йоду, очевидно, здатний проявляти канцерогенну дію переважно на тлі йодного дефіциту за рахунок активного поглинання ізотопу збіднілою на йод ЩЗ.
Йодний дефіцит або надмірне споживання йоду не призводять до збільшення абсолютної захворюваності на рак ЩЗ, проте в регіонах із нормальним споживанням йоду дещо менше трапляється відносно агресивніший фолікулярний рак ЩЗ.
Причиною медулярного раку ЩЗ у рамках синдрому множинних ендокринних неоплазій 2го типу — МЕН2 (поєднання медулярного раку ЩЗ з феохромоцитомою) є мутація в RETпротоонкогені на довгому плечі хромосоми 10. Аналогічні мутації виявляються в багатьох випадках папілярного раку ЩЗ (5–30 %), особливо радіаційноіндукованого. Крім того, при високодиференційованому раку ЩЗ виявлені мутації супресора пухлин р53, гіперекспресія rasонкогенів та інші генетичні зміни. Медулярний рак ЩЗ (МРЩЗ) трапляється в трьох основних формах: спорадичний (75 %), ізольований сімейний (5 %), сімейний в рамках МЕН2 (20 %).
Певну роль відіграє і тривала стимуляція щитоподібної залози ТТГ, що призводить до її гіперплазії з можливою малігнізацією вузлів за умов зобної ендемії.
Патогенез
Клітини високодиференційованого раку ЩЗ (папілярний і фолікулярний), як і нормальні тиреоцити, характеризуються здатністю захоплювати йод. Для нього характерні повільний ріст і досить пізнє метастазування. На віддаленому етапі пухлинного прогресування клітини метастазів можуть втрачати диференціювання і здатність захоплювати йод. Медулярний рак ЩЗ формується з Склітин, що продукують кальцитонін; цей рак характеризується раннім метастазуванням і несприятливим прогнозом. Найгірший прогноз спостерігається при недиференційованому анапластичному раку ЩЗ, що трапляється в поодиноких випадках (табл. 1).
Згідно з даними досліджень останніх років, механізм розвитку раку ЩЗ розглядають як наслідок порушень активності та взаємодії онкогенів і пухлинних супресорних генів, деяких ростових факторів. Онкогени, що є частиною геному, в нормальному стані перебувають у «репресованому», «неактивному» стані. Активація їх відбувається під впливом мутації, делеції чи хромосомної транслокації з подальшою трансформацією клітин тиреоїдного епітелію до стану «неконтрольованого росту».
Епідеміологія
На рак ЩЗ припадає до 1 % раку всіх локалізацій і менше 0,5 % випадків смерті від раку. Рак ЩЗ — найчастіший рак серед усіх ендокринних органів (90 %); солідний рак людини, що зазнає найбільш динамічного росту в частоті (5 % приросту захворюваності за рік). Частота нових випадків раку ЩЗ становить 0,5–10 випадків на 100 тис. населення за рік. У США щороку діагностується 18 000 випадків раку ЩЗ, від якого щороку помирає 1200 осіб. У більшості випадків рак ЩЗ діагностується при обстеженні пацієнтів з вузловим зобом (в етіологічній структурі вузлового зоба на рак ЩЗ припадає 1–4 % випадків). Поширеність папілярних мікрокарцином (діаметр < 1 см), що є випадковими знахідками при плановому гістологічному дослідженні тканини ЩЗ, видаленої з приводу інших захворювань, досягає 10–20 % випадків, при цьому клінічне значення таких пухлин зазвичай обмежене. Рак ЩЗ, як правило, виявляється у віці 40–50 років, у жінок трапляється частіше (2 : 1–3 : 1), але в людей похилого віку відносна частка чоловіків дещо вища (табл. 2). На сьогодні спостерігається збільшення кількості хворих серед молодих дорослих осіб, що були дітьми і підлітками під час аварії на ЧАЕС.
Поширеність раку ЩЗ в Україні у 2011 році становила 74,8 на 100 тис. населення (для порівняння — 38,2 на 100 тис. населення у 2001 р.), показник захворюваності — 6,5 на 100 тис. населення (4,5 на 100 тис. населення — у 2001 р.) (дані МОЗ України, 2012).
Клінічні прояви
Більшість випадків раку ЩЗ діагностується при тонкоголковій аспіраційній біопсії (ТАПБ) у рамках обстеження хворих на вузловий зоб, що виявляється при пальпації або УЗД ЩЗ. Особливості окремих гістологічних варіантів раку ЩЗ наведені в табл. 3.
Рак ЩЗ найчастіше виявляється пальпаторно або під час сонографічного дослідження у вигляді солітарного вогнищевого утворення в одній з її частин, інколи утворень буває декілька. Вузол у залозі характеризується підвищеною щільністю, обмеженою рухомістю. Нерідко спостерігається регіонарна лімфаденопатія. При великих розмірах пухлини виникає компресійний синдром з боку трахеї, стравоходу, шийних судин (утруднення дихання, ковтання, розширення шийних вен). Хриплість голосу може бути наслідком паралічу голосової зв’язки. Біль виникає у разі компресії чи проростання нервових стовбурів. Загальний стан хворих порушується відносно рідко (зниження маси тіла, підвищення температури тіла), вони перебувають в еутиреоїдному стані. Дуже рідко спостерігається гіпотиреоз. Поєднання тиреотоксикозу і раку спостерігається частіше при дифузному зобі у вигляді вогнищ мікрокарциноми, що виявляють при остаточному патогістологічному дослідженні видалених залоз. При клінічному обстеженні слід брати до уваги анамнестичні дані, що можуть свідчити на користь малігнізації (чинник радіаційного впливу, онкологічні захворювання та рак ЩЗ у родичів, наявність вузла у залозі, що почав збільшуватися, став болючим, жіноча стать, вік до 14 і понад 65 років).
При вивченні анамнезу і клінічної картини пацієнтів, які проходять обстеження з приводу вузлового зоба, слід звертати увагу на ознаки, які підвищують імовірність того, що виявлений вузол ЩЗ є раком:
— опромінення голови і шиї в анамнезі;
— медулярний рак або МЕН2 у родичів;
— вік до 20 або понад 70 років;
— швидкий ріст вузлового утворення;
— щільна або тверда консистенція вузла;
— шийна лімфаденопатія;
— незміщуваність вузлового утворення;
— постійна охриплість, дисфонія, дисфагія або задишка.
Іноді рак ЩЗ, особливо високодиференційований, маніфестує віддаленими метастазами; в деяких випадках спочатку виявляється шийна лімфаденопатія, після чого при УЗД виявляють рак ЩЗ.
Для визначення поширеності патологічного процесу застосовують міжнародну клінічну класифікацію TNM, де T — це характеристика первинної пухлини, N — регіонарних метастазів, M — віддалених метастазів. Схема дає можливість визначити стан хворого, обрати оптимальні схеми лікування, оцінити їх результати.
Класифікація поширеності раку ЩЗ за системою TNM
Первинна пухлина (Т):
Tx — недостатньо даних для оцінки;
T0 — доказів щодо наявності первинного вогнища немає;
T1 — пухлина до 1,0 см, у межах тканини залози;
T2 — пухлина до 4,0 см, у межах тканини залози;
T3 — пухлина завбільшки 4,0 см, у межах тканини залози;
T4 — пухлина будьякого розміру, поширюється за межі капсули залози.
Регіонарні лімфатичні вузли (N):
Nх — даних для оцінки регіонарних лімфатичних вузлів недостатньо;
N0 — ознак ураження регіонарних лімфатичних вузлів немає;
N1 — є ураження лімфатичних вузлів з боку пухлини;
N2 — є двобічне ураження регіонарних лімфатичних вузлів.
Віддалені метастази (М):
М0 — немає віддалених метастазів;
М1 — наявні віддалені метастази.
Діагностика раку ЩЗ базується на даних клінічного і лабораторноінструментального дослідження. Клінічні ознаки, за якими припускається наявність малігнізації, викладені вище. Основним методом виявлення вогнищевої патології ЩЗ є УЗД. Наявність певних ознак може свідчити про злоякісний характер новоутворення (гіпоехогенність, нерівні контури, переривчаста капсула тощо), але вони не є абсолютними. Супутня лімфоаденопатія — серйозний симптом щодо розвитку раку. Найефективнішим методом діагностики є тонкоголкова аспіраційна пункційна біопсія ЩЗ із подальшим цитологічним дослідженням отриманих зразків. Її точність досягає 90–95 %. Пункція виконується під контролем УЗД або без нього при великих розмірах пухлин. Варіанти цитологічних висновків можуть бути такими: доброякісне утворення (вузловий зоб, тиреоїдит, аденома та ін.), рак (папілярний, медулярний, анапластичний), підозра на рак, невизначені результати. У деяких випадках проводять додаткове цитохімічне дослідження для ідентифікації пухлинних маркерів.
За наявності доброякісного утворення питання про подальше лікування вирішують індивідуально. Висновок «рак», «підозра на рак» — абсолютні показання для операції. Якщо результати невизначені, ТАПБ повторюють.
У разі наявності висновку ТАПБ «підозра на рак» проводять обов’язкове інтраопераційне експресгістологічне дослідження видаленої пухлини. Якщо діагноз підтверджується (це може бути папілярний, медулярний чи анапластичний рак), виконують операцію відповідного обсягу.
Діагностика фолікулярного раку
За цитологічними даними пункційної біопсії зробити це практично неможливо. У таких випадках висновок має такий вигляд — фолікулярна неоплазія, наявність мікрофолікулярних структур, мікрофолікулярна аденома. У 15–17 % таких хворих при остаточному патогістологічному дослідженні виявляють фолікулярний рак. Відтак усі хворі з вищезазначеними висновками підлягають оперативному лікуванню. Це ж саме стосується випадків діагностованих аденом з bклітин (Ашкеназі — Гюртле).
Радіоізотопне сканування ЩЗ за допомогою препаратів йоду дає змогу виявити «гарячі» («теплі») та «холодні» вузли. Останні часто виявляються злоякісними, проте й «гарячі» вузли так само можуть мати пухлинну природу. Тому це дослідження не має великого значення. КТ, тиреолімфо, пневмотирео, термо, ангіо та рентгенографія не мають вирішального значення для діагностики раку ЩЗ. Вони можуть використовуватися під час визначення поширеності процесу.
Для визначення функціонального стану ЩЗ проводять дослідження ТТГ, вільного тироксину, трийодтироніну. У частини хворих на диференційований рак ЩЗ спостерігається багаторазове підвищення тиреоглобуліну. При медулярному раку значно зростає рівень кальцитоніну в крові, що є маркером цього виду пухлин.
Диференціальна діагностика раку ЩЗ проводиться з вузловим колоїдним зобом, аденомою, хронічним тиреоїдитом, кістою, метастазом пухлини позатиреоїдної локалізації, рідкісними паразитарними й інфекційними захворюваннями ЩЗ (туберкульоз, ехінококоз та ін.), захворюваннями органів і структур шиї (стравохід, судини, м’язи). Диференціальна діагностика ґрунтується на клінічних ознаках, результатах інструментального обстеження (УЗД, КТ, МРТ, радіоізотопне сканування, ТАПБ, визначення пухлинних маркерів).
Лікування раку ЩЗ має бути комбінованим. Воно включає хірургічне втручання, застосування променевих методів (радіойодотерапія, дистанційна променева терапія), супресивну терапію препаратами тиреоїдних гормонів, хіміотерапію. Вибір і комбінація методів лікування залежать від типу раку, ступеня поширеності процесу, загального стану хворого. Незалежно від форми раку операцією вибору є екстрафасціальна тиреоїдектомія. За наявності клінічно та морфологічно верифікованих регіональних метастазів виконують центральну і латеральну одно чи двобічну модифіковану дисекцію лімфовузлів шиї. У виняткових випадках, за наявності у хворих віком 20–60 років диференційованої карциноми до 15 мм без метастазів, ознак інвазії в оточуючі тканини, припустимо робити майже тотальну тиреоїдектомію. Хворим після тиреоїдектомії з приводу папілярного та фолікулярного раку через 6 тижнів призначається лікування радіоактивним йодом задля знищення залишкової тканини залози (абляція) і мікрометастазів, якщо вони є. До отримання радіоактивного йоду хворі не приймають препарати тиреоїдних гормонів. У подальшому з інтервалом у 6 місяців упродовж 3 років проводять діагностичне сканування з 131І, а за наявності осередків нагромадження ізотопу (залишкова тканина, метастази) призначають лікувальну дозу радіоактивного йоду. Якщо після трьох років є ознаки наявності тиреоїдної тканини в організмі хворого, питання стосовно подальшого лікування вирішують індивідуально.
Дистанційна променева терапія призначається після тиреоїдектомії з приводу медулярного й анапластичного раку і в разі нерадикальних операцій із приводу диференційованих типів пухлин.
Хіміотерапія цитостатичними препаратами загального профілю пропонується після нерадикальних операцій, в іноперабельних випадках. Ефективність її зазвичай низька.
Хворі, які оперовані з приводу диференційованих форм раку ЩЗ, отримують постійну супресивну терапію препаратами тиреоїдних гормонів під контролем рівня ТТГ у крові (бажано не вище 0–0,3 мкОД/мл). Після операцій з приводу медулярного й анапластичного раку прийом препаратів тиреоїдних гормонів проводять в обсязі замісної терапії.
Своєчасне й адекватне оперативне втручання в комбінації з лікуванням препаратами тиреоїдних гормонів і радіоізотопною чи променевою терапією за показаннями забезпечує 5 і 10річне виживання 98–92 % хворих із папілярним та фолікулярним раком, 68–50 % — з медулярним. Результати лікування анапластичного раку незадовільні. Майже всі хворі помирають упродовж року з часу встановлення діагнозу. Індивідуальні результати лікування залежать від віку, статі хворих, ступеня локального поширення пухлини, наявності регіонарних і віддалених метастазів. Якщо є рецидив пухлини або регіонарних метастазів, можливе оперативне лікування разом із застосуванням інших методів за програмою для первинних пухлин.
Рекомендована збалансована дієта з використанням білків, жирів, вуглеводів, мікроелементів, вітамінів, обмеження продуктів із вмістом струмогенів. Хворі, оперовані з приводу раку ЩЗ, мають дотримуватися певного режиму праці. Не рекомендується робота в гарячих цехах, з радіоактивними ізотопами, рентгенівським опроміненням, електромагнітною апаратурою. Слід обмежувати час перебування на сонці.
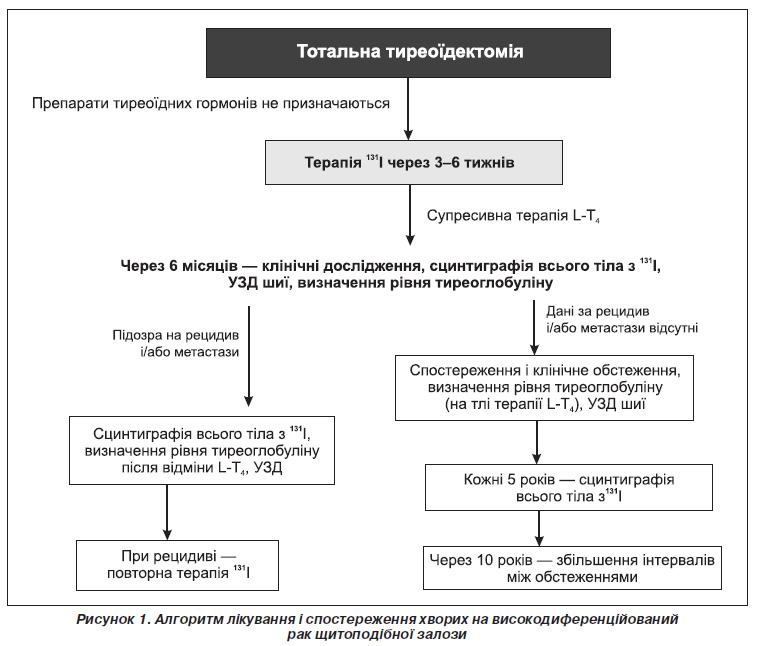
Лікування високодиференційованого раку ЩЗ ґрунтується на чотирьох основних принципах (рис. 1):
1. Тиреоїдектомія з видаленням, залежно від поширення процесу, того чи іншого об’єму шийної клітковини з лімфатичними вузлами.
2. Після тиреоїдектомії — терапія радіоактивним 131І, направлена на ліквідацію всіх клітин ЩЗ (нормальних, пухлинних) і потенційно можливих метастазів.
3. Супресивна терапія левотироксином, скерована на підтримання зниженого рівня ТТГ, що є стимулятором росту і проліферації тиреоцитів (нормальних і пухлинних).
4. Динамічна оцінка основного маркера рецидиву високодиференційованого раку ЩЗ — тиреоглобуліну, що продукується як нормальними, так і пухлинними клітинами. Поряд із оцінкою рівня тиреоглобуліну періодично проводиться сцинтиграфія всього тіла з 123І або 131І, яка дозволяє візуалізувати йодонагромаджуючу тканину (метастази); дослідження проводиться після попередньої відміни левотироксину на тлі підвищеного рівня ТТГ, що стимулює захоплення йоду клітинами пухлини. Про рецидив пухлини свідчать підвищення рівня тиреоглобуліну і поява даних за місцевий рецидив або віддалені метастази за результатами сцинтиграфії.
При МРЩЗ показане проведення екстирпації ЩЗ із проведенням комбінованої шийної лімфаденектомії. При виявленні у членів сім’ї хворого родинної форми медулярного раку ЩЗ або МЕН2 розглядається питання про профілактичну тиреоїдектомію навіть за відсутності даних за медулярний рак ЩЗ. При виявленні анапластичного раку показана операція аналогічного обсягу.
Папілярний рак. Це найчастіший вид злоякісної пухлини ЩЗ, який здебільшого виявляється як поодинокий щільний вузол на тлі нормальної чи дифузно збільшеної ЩЗ. При багатовузловому зобі раковий вузол виділяється значною щільністю і розмірами. Регіонарні шийні лімфатичні вузли часто збільшені й ущільнені. У 10 % дітей при малих розмірах пухлини збільшення лімфатичних залоз шиї може бути єдиною ознакою папілярного раку.
Папілярний рак характеризується найбільш доброякісним перебігом порівняно з іншими видами раку ЩЗ через повільний його розвиток і значно меншу частоту метастазування в інші органи. Метастазування зазвичай відбувається лімфатичними шляхами у капсулу і регіонарні лімфатичні вузли. Метастази частіше виявляють у легенях і рідше — у кістках.
Макроскопічно папілярний рак являє собою невеликі округлої форми щільні вогнища тканин білого чи сірого кольорів без капсули. У деяких випадках пухлина може поширюватися на всю залозу. Іноді розміри пухлини такі малі, що її виявляють лише при мікроскопічних дослідженнях.
Мікроскопічно пухлина складається з окремих чи багатьох шарів стовпчастого епітелію, що утворює характерні папілярні (сосочкові) структури, і кістозних порожнин, заповнених колоїдом чи кров’ю. Мітози у клітинах трапляються рідко.
Поряд із ознаками папілярного раку у пухлинах нерідко виявляють ділянки фолікулярного раку. Папілярний рак не має гормональної активності.
Фолікулярний рак (фолікулярна карцинома). Вогнища фолікулярного раку мають м’яку консистенцію. За кольором вони не відрізняються від тканини ЩЗ і являють собою вузли різних розмірів, обмежені капсулою, їх важко відрізнити від доброякісної аденоми. Іноді у тканині ЩЗ виникають множинні вогнища раку на тлі ДТЗ (особливо після впливу променевої радіації).
Тканина пухлини — це фолікулярні й трабекулярні структури. Фолікули можуть бути як дрібними, так і нормальними, що містять колоїд. Ступінь злоякісності визначається проростанням капсули й інвазією в кровоносні судини. Фолікулярний рак розвивається повільно. При повністю інкапсульованій пухлині або з мінімальною інвазією у капсулу тривалість життя досягає 10 років у 85 % пацієнтів, а при частково інкапсульованій пухлині зі значним її проростанням у навколишні тканини ЩЗ — у 50 % хворих.
Фолікулярний рак може поширюватися лімфатичними шляхами у регіонарні шийні вузли і гематогенно. В останньому випадку метастази виявляють частіше в легенях, кістках, печінці.
Фолікулярний рак характеризується більш злоякісним перебігом порівняно з папілярним і на відміну від нього має гормональну активність. Пухлинні вузли здатні нагромаджувати радіоактивний йод і при скануванні мають вигляд «теплих» або «гарячих». При виявленні метастазів застосовується лікування радіоактивним йодом.
Варіантом фолікулярного раку є карцинома, що складається з клітин Гюртля.
Медулярний рак (медулярна карцинома). Медулярний рак розвивається з Склітин, які у здорових людей секретують гормон кальцитонін. Тому ракова пухлина є гормонально активною і продукує кальцитонін, рівень якого в крові підвищується. У деяких випадках пухлина здатна секретувати й інші пептидні гормони (простагландини, гістамін, серотонін, АКТГ тощо). Така пухлина, що продукує не властиві їй гормони, відома під назвою апудома.
Участь спадкового фактора у розвитку медулярного раку призводить до необхідності обстеження найближчих родичів на вміст у крові кальцитоніну, підвищення якого може бути маркером початку гіперплазії Склітин і злоякісного процесу.
Мікроскопічно пухлина рідко інкапсульована, білуватосірого кольору, її важко відрізнити від папілярного раку. Клітини дрібні, округлі чи веретеноподібні. У пухлині визначається амілоїд, що містить ланцюжки кальцитоніну.
Пухлина часто проникає у тканину ЩЗ, інфільтрує її капсулу, проростає у стінки судин, що оточують тканини (м’язи, трахею). Характерне як лімфогенне, так і гематогенне метастазування (шийні лімфатичні вузли, легені, кістки, внутрішні органи).
Недиференційований (анапластичний) рак. Пухлина дуже агресивна, відрізняється швидким ростом, захоплюючи всю ЩЗ, і проростає в оточуючі її тканини (м’язи, нерви, шкіру, гортань, стравохід). При ковтанні зазвичай ЩЗ не зміщується. Пухлина не має гормональної активності. Мікроскопічно виявляють клітини з частими мітозами (ознака високої злоякісності). Це можуть бути багатоядерні гігантські клітини, веретеноподібні чи дрібні. Характерне гематогенне метастазування у легені, кістки і внутрішні органи.
Швидкий ріст пухлини може призвести до дисфагії, парезу голосових зв’язок, стравохіднотрахейних нориць, кровотеч.
Інші злоякісні пухлини щитоподібної залози. До таких пухлин належать: лімфома, фібросаркома, епідермоїдна карцинома, злоякісна гемангіоендотеліома і метастази раку з інших органів. У ЩЗ частіше виявляють метастази раку грудної залози, нирок, бронхогенного раку і меланоми. Встановити характер первинного чи метастатичного раку ЩЗ можливо лише за допомогою пункційної біопсії або хірургічного втручання.
Діагностика можливих рецидивів раку. Діагностика рецидивів диференційованого раку ґрунтується на здатності клітин пухлини папілярного, фолікулярного і змішаного раку (незалежно від його локалізації) продукувати білок тиреоглобулін, а тканина фолікулярного раку здатна, крім цього, захоплювати і нагромаджувати радіоактивний йод (як у ЩЗ, так і у метастазах). Є клінічні спостереження, що метастази папілярного раку після тиреоїдектомії набувають здатності захоплювати 131I, що дозволяє використовувати радіоактивний йод для лікування.
Після радикальної операції на ЩЗ хворі отримують препарати тиреоїдних гормонів у дозах, що сприяють пригніченню продукції ТТГ. Рекомендується Lтироксин (0,15–0,25 мг на добу) у вигляді монотерапії або у комбінації з трийодтироніном (0,05–0,075 мг/добу). Оскільки для виявлення рецидивної тканини при фолікулярному раку необхідна участь ТТГ для стимуляції захоплення 131I клітинами пухлини, прийом препаратів тиреоїдних гормонів слід припинити. Якщо пацієнт приймав Lтироксин, то з огляду на період його напіврозпаду вживання таблеток необхідно припинити за 1–1,5 місяця до обстеження. Після припинення прийому трийодтироніну цей термін скорочується до 2 тижнів. Основним критерієм діагностики рецидиву при медулярному раку є здатність Склітин пухлини секретувати гормон кальцитонін.
Прогноз залежить від форми раку, стадії процесу, при якій виставлений діагноз, і можливості радикальної терапії. При високодиференційованому раку ЩЗ — сприятливий. Навіть у разі наявності віддалених метастазів, що накопичують 131І, проведення систематичного лікування (тиреоїдектомія + терапія 131І + супресивна терапія левотироксином) забезпечує більш ніж 95% 10річну виживаність. Найгірший прогноз при анапластичному раку: середня тривалість життя з моменту діагностики — 6 місяців, 5річна виживаність — 7 %.
Залежно від поширеності ракової пухлини виділяють декілька стадій захворювання:
I стадія: невелика інкапсульована пухлина в одній із часток щитоподібної залози.
II стадія: а) пухлина займає половину залози, проростає її капсулу, рухома; б) пухлина таких самих чи менших розмірів із рухомими регіонарними метастазами на шиї з однієї сторони.
III стадія: а) пухлина займає понад половину залози, спаяна із сусідніми органами, обмежено рухома; б) пухлина з двобічними метастазами у шийні лімфатичні вузли.
IV стадія: а) пухлина проростає у навколишні тканини й органи, нерухома; б) пухлина будьяких розмірів, але з віддаленими метастазами.
Для виявлення віддалених метастазів використовують рентгенографію, КТ, сканування з радіоактивним йодом та ін.

1. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Фундаментальная и клиническая тиреоидология: Руководство. — М.: Медицина, 2007. — 816 с.
2. Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология: Учебник. — 2е изд. — М.: Медиа, 2009. — 432 с.
3. Ендокринологія: Підручник / За ред. А.С. Єфімова. — К.: Вища школа, 2004. — 494 с.
4. Ендокринологія: Підручник / За ред. П.М. Боднара. — Вінниця: Нова Книга, 2007. — 344 с.
5. Ларін О.С., Черенько С.М., Кініченко В.Г. Діагностика та лікування високодиференційованого раку щитоподібної залози. — К., 2011.
6. Паньків В.І. Практична тиреоїдологія. — Донецьк: Видавець Заславський О.Ю., 2011. — 224 с.
7. Румянцев П.О., Ильин А.А., Румянцева У.В., Саенко В.А. Рак щитовидной железы. Современные подходы к диагностике и лечению. М.: ГЭОТАРМедиа, 2009. — 476 с.
8. Рыбаков С.И. Рак щитовидной железы: клинические лекции. — Полтава: АСМИ, 2012. — 571 с.
9. Тонковид О.А., Коваленко А.Є. Медулярний рак щитоподібної залози: клініка, діагностика, лікування, прогноз // Ендокринологія. — 2007. — Т. 12, № 1. — С. 136150.
10. Черенько С.М., Ларин А.С. Особенности мониторинга пациентов, оперированных на щитовидной железе. — К.: Украинский научнопрактический центр эндокринной хирургии, трансплантации эндокринных органов и тканей МЗ Украины, 2012.
11. Clinical Management of Thyroid Disease // Ed. by F.E. Wondisford, S. Radovick. — John Hopkins University School of Medicine. — Baltimore, Maryland, 2009. — 860 p.
12. Cooper D.S., Doherty G.M., Haugen B.R. et al. Revised American Thyroid Association Management Guidelines for Patients with Thyroid Nodules and Differentiated Thyroid Cancer The American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer // Thyroid. — 2009. — Vol. 19, № 11.
13. De Lelis R., Lloyd R., Heitz Ph. Pathology and genetics of tumours of endocrine organs. WHO classification of tumours. — Lyon: IARC Press, 2004. — 320 p.
14. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and followup. F. Pacini, M.G. Castagna, L. Brilli, G. Pentheroudakis on behalf of the ESMO Guidelines Working Group // Annals of Oncology. — 2010. — Vol. 21. — P. 214219.