Журнал «Медицина неотложных состояний» 6 (45) 2012
Вернуться к номеру
Трансфузиологические вопросы современной реаниматологии Часть III. Методы сбережения и реинфузии крови
Авторы: Усенко Л.В., Царев А.В., Петров В.В., Панченко Г.В., Дубина В.Н., Кузьмова Е.А., Кобеляцкий Ю.Ю.
Кафедра анестезиологии и интенсивной терапии, ГУ «Днепропетровская медицинская академия» МЗ Украины, КУ «Днепропетровская областная клиническая больница им. И.И. Мечникова»
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Разделы: Медицинские форумы
Версия для печати
В статье освещаются вопросы кровесбережения, реинфузии крови, фармакологической, анестезиологической и хирургической стратегии снижения кровопотери.
У статті висвітлюються питання кровозбереження, реінфузії крові, фармакологічної, анестезіологічної і хірургічної стратегії зниження крововтрати.
The article highlights the issues on blood saving, blood reinfusion, pharmacological, anesthesiological and surgical strategy for blood loss reduction.
кровопотеря, реинфузия крови, гемотрансфузия, интенсивная терапия.
крововтрата, реінфузія крові, гемотрансфузія, інтенсивна терапія.
blood loss, blood reinfusion, hemotransfusion, intensive care.
Современные тенденции развития хирургии, реаниматологии и анестезиологии связаны с переоценкой взглядов на показания для трансфузии продуктов крови, расширением использования аутокрови и методов аппаратной реинфузии, усовершенствованием хирургических вмешательств с целью уменьшения интраоперационной кровопотери, а также широкого использования целого ряда фармакологических препаратов, способствующих уменьшению потребности в проведении гемотрансфузии.
Прежде чем перейти к рассмотрению существующих методов кровесбережения, необходимо остановиться на обосновании возможных ограничений использования данных методов. Так, при нормоволемической анемии компенсаторное увеличение сердечного выброса связано с перераспределением крови к областям с повышенной потребностью (сердце и мозг). При этом коронарный и церебральный кровотоки увеличиваются непропорционально сердечному выбросу, что объясняется локальным расширением кровеносных сосудов указанных органов. Усиление коронарного кровотока даже важнее, чем повышение церебрального, поскольку в условиях нормоволемической анемии увеличивается потребность миокарда в кислороде. Вазодилатация коронарных артерий достигает максимума при снижении уровня гематокрита (Ht) до 0,10–0,12 л/л. Более низкий уровень гематокрита не может обеспечить повышенную энергетическую потребность миокарда, что приводит к развитию гипоксии и снижению сердечного выброса на фоне уменьшения системного потребления кислорода, которое развивается при снижении гематокрита до 0,10 л/л [1].
Эффективность механизмов, поддерживающих адекватную доставку кислорода к тканям в условиях сниженного содержания кислорода в крови, зависит в первую очередь от сохранения нормоволемии и сократительной способности сердца. Гиповолемия уменьшает компенсаторный эффект пониженной вязкости крови на венозный возврат и угнетенную функцию миокарда, препятствует увеличению систолического объема, связанного с повышением венозного возврата [1]. Важен системный подход, позволяющий уменьшить интраоперационную потерю крови, — избегать гиповолемии, поскольку в условиях гиповолемии нарушается функция тромбоцитов, что приводит к увеличению кровопотери [2].
Важнейшим фактором, влияющим на интраоперационную кровопотерю, является гипотермия, которая вызывает развитие гипокоагуляции, поэтому даже незначительная гипотермия может существенно увеличить кровопотерю. Крайне важно использовать методы, направленные на снижение теплопотерь у пациентов: обеспечение температуры воздуха в операционной настолько высокой, насколько это комфортно для операционной бригады; применение электрических согревающих одеял или одеял, обеспечивающих конвекцию теплого воздуха; обязательное согревание инфузионных растворов до 37 °С [3].
В настоящее время создана концепция трансфузионного сопровождения (Patient Blood Management — РВМ), которая базируется на трех аспектах (постулатах):
— оптимизация гемопоэза;
— минимизация кровопотери;
— оптимизация физиологической толерантности к анемии [2].
Концепция трансфузионного сопровождения ставит своей целью оптимизацию подготовки и разумное использование компонентов крови, объединяя стратегии уменьшения или полного отказа от гемотрансфузии за счет использования превентивных мер, обеспечивающих, в конечном итоге, улучшение исходов и уменьшение затрат. Постулируется, что препараты и компоненты крови следует использовать только при возникновении признаков повышения физиологических потребностей, а не путем бездумного следования таким триггерам гемотрансфузии, как уровень гемоглобина (Hb) или гематокрита, поскольку цель терапии — излечение больного, а не нормализация показателя уровня гемоглобина [4].
Необходимо подчеркнуть, что в большинстве случаев проведение гемотрансфузии не показано при уровне Hb > 100 г/л, в то время как при снижении его уровня ниже 70–60 г/л (у кардиологических пациентов ниже 80 г/л) является показанием к ее проведению.
Трансфузионное сопровождение требует мультидисциплинарного подхода в контексте разработанного протокола внутри каждой клиники. По отношению к каждому больному план ведения должен основываться на специфике его состояния и особенностях планируемой операции. Модальность трансфузионного сопровождения охватывает каждый шаг терапии пациента и включает различные фармакологические, анестезиологические и хирургические методы. Трансфузионное сопровождение не прекращается с окончанием операции, а продолжается далее. Так, аппарат для реинфузии крови Cell Saver используют и в послеоперационном периоде, когда дренажная кровь может быть собрана, отфильтрована и реинфузирована пациенту [2].
Выделяют следующие методы периоперативного кровесбережения:
1. Фармакологические:
— антифибринолитические препараты (апротинин, транексамовая кислота, eаминокапроновая кислота);
— десмопрессина ацетат;
— эритропоэтин (erythropoietin — EPO);
— местные гемостатические агенты;
— плазмозаменители.
2. Аутологичные методы гемотрансфузии:
— предоперационная заготовка аутокрови;
— острая нормоволемическая гемодилюция;
— интра или постоперационный сбор и реинфузия крови.
3. Анестезиологическая стратегия:
— управляемая гипотония;
— спинальная или эпидуральная анестезия;
— регуляция центрального венозного давления.
4. Хирургическая стратегия:
— использование диатермических коагуляторов, лазеров, ультразвуковых скальпелей;
— минимально инвазивная хирургия;
— использование в клинической практике трансфузионных протоколов, рекомендаций и проведение клинического аудита [5].
Фармакологические методы. Гемостатические препараты используются с целью профилактики при хирургических вмешательствах с высоким риском кровотечений либо для лечения массивных рефрактерных кровотечений.
1. Антифибринолитики. К ним относятся: апротинин, который является прямым ингибитором плазмина, а также препараты на основе аналогов лизина — транексамовая и eаминокапроновая кислоты. Последние, соединяясь с плазминогеном, ингибируют его связывание с фибрином, блокируя таким образом фибринолиз.
В целом ряде клинических исследований было показано, что все три указанных препарата эффективны в обеспечении снижения частоты аллогенных гемотрансфузий по сравнению с плацебо [6, 7]. Однако в исследовании, опубликованном в 2006 г. [8], было продемонстрировано, что применение апротинина в кардиохирургической практике вдвое увеличивало риск развития острой почечной недостаточности и ассоциировалось с 55% повышением риска развития острого инфаркта миокарда и со 181% увеличением риска развития инсульта либо энцефалопатии, чего не наблюдалось при использовании транексамовой или eаминокапроновой кислоты. Причем начатые мультицентровые клинические испытания апротинина и аналогов лизина в кардиохирургии у пациентов с высоким риском кровотечений были прекращены в связи с повышением летальности в группе с применением апротинина по сравнению с аналогами лизина [9], поэтому фирмы Bayer и Nordic Pharma приостановили глобальный маркетинг апротинина [5].
Использование аналогов лизина в данном исследовании достоверно снизило количество гемотрансфузий и показало такую же эффективность в контроле над кровотечениями, как и при использовании апротинина. При этом было отмечено, что транексамовая кислота — более сильнодействующий препарат по сравнению с eаминокапроновой кислотой. Однако в связи с большим разбросом доз препаратов аналогов лизина, которые были использованы в проведенных клинических исследованиях, в настоящее время не представляется возможным оценить взаимосвязь между дозами транексамовой и eаминокапроновой кислот и их эффективностью, а соответственно, невозможно определить их наиболее оптимальные дозы для применения в клинической практике при кровотечениях [5]. В целом рекомендуемая доза транексамовой кислоты составляет 10 мг/кг массы тела внутривенно, кратностью от 3 до 6 раз в сутки до остановки кровотечения.
2. Десмопрессин. Являясь синтетическим аналогом антидиуретического гормона, данный препарат изначально позиционировался для лечения кровотечений, связанных с гемофилией А и болезнью Виллебранда. Его действие реализуется за счет стимуляции высвобождения предшественника фактора Виллебранда и фактора VIII. Показания для назначения десмопрессина: дисфункция тромбоцитов при уремии, циррозе печени, проведение лечения нестероидными противовоспалительными препаратами, болезнь Виллебранда I типа. Препарат неэффективен при отсутствии нарушений в системе гемостаза. Максимум действия наступает через 30–60 мин после внутривенной инфузии.
3. Рекомбинантный фактор свертывания VIIа (rVIIа). Препарат оказывает локальный гемостатический эффект в зоне повреждения сосудистой стенки, при этом в клинической практике используются дозы, намного превосходящие физиологические (90–120 мг и более). rVIIа характеризуется высоким темпом снижения активности, что определяет интервалы между повторными введениями (2–3 часа). Максимальный эффект от введения rVIIа может быть достигнут только после предварительной коррекции уровня фибриногена (> 1 г/л — трансфузией свежезамороженной плазмы и криопреципитата), тромбоцитов (> 50 · 109) и ликвидации ацидоза (рН > 7,1).
4. Местные рассасывающиеся гемостатики. Препараты данной группы получают на основе человеческого фибриногена, человеческого или крупного рогатого скота тромбина, человеческого фактора VIIIа, а также бычьего апротинина. Для закрытия кровоточащих костных поверхностей или тканей используют препараты на основе целлюлозы (surgicel), желатина (gelfoam, spongostan) или коллагена (aviten, lyostypt). Местные гемостатики нашли широкое применение в кардиохирургии, сосудистой хирургии, нейрохирургии, хирургии печени и при травмах. Согласно результатам исследований, применение данных препаратов достоверно снижает уровень периоперативных аллогенных гемотрансфузий [5].
Используя компоненты плазмы, можно ex tempori приготовить фибриновый клей. Так, его применение для покрытия губчатой поверхности кости в сочетании с внутрисуставным введением транексамовой кислоты может уменьшить кровопотерю при полной артропластике коленного сустава до минимума [3].
5. Эритропоэтин. Применение рекомбинантного человеческого эритропоэтина улучшает ретикулоцитоз и повышает гематокрит, способствует уменьшению уровня аллогенных гемотрансфузий (уровень 1). Согласно данным клинического испытания ЕРО1 у пациентов в критических состояниях, введение эритропоэтина в дозе 300 МЕ/кг массы тела с 3го дня нахождения в ОРИТ курсом 5 дней позволило достоверно уменьшить суммарную дозу эритроцитарной массы по сравнению с группой плацебо (166 ед. эритромассы в сравнении с 305 ед. соответственно). Аналогичная динамика была отмечена по уровню гематокрита: 35,1 ± 5,6 в сравнении с 31,6 ± 4,1 соответственно. При этом отсутствовали достоверные различия между группами по уровню летальности и осложнениям [10].
В другом исследовании ЕРО2 оценивали эффективность назначения эритропоэтина у критических пациентов в течение недели. Исследование проводили у 650 пациентов с применением ЕРО и у 652 пациентов контрольной группы. Назначали ЕРО в дозе 40 000 МЕ подкожно с 3го дня с момента поступления в ОРИТ курсом 7 дней, суммарно 3 дозы. На 21е сутки получали четвертую дозу ЕРО. В результате было отмечено снижение объема аллогенных гемотрансфузий (50,5 %) по сравнению с контрольной группой (60,4 %). В целом наблюдалось 19% снижение доз переливаемой эритромассы (1590 ед. в сравнении с 1963 единицами) и увеличение уровня гемоглобина. Также не было различий между группами по уровню летальности и осложнений [10].
В случае развития тяжелой послеоперационной анемии, кроме либо вместо эритропоэтина, необходимо введение комбинации витамина В12 (1 мг/сут внутримышечно), фолиевой кислоты (5 мг 2 раза/сут перорально) и препаратов железа (1,5 мг/кг/сут внутримышечно) — лучшей формой в плане биодоступности считается сахарат железа [3]. Установлено, что применение ЕРО без назначения препаратов железа приводит к неэффективности лечения в 15–30 % случаев [11]. Это связано с тем, что эритропоэтин быстро истощает запасы железа и его введение без адекватной заместительной терапии препаратами железа малоэффективно, что особенно актуально у пациентов, недавно перенесших кровопотерю и исчерпавших запасы железа. Так, в исследовании [12] была показана высокая эффективность применения ЕРО в дозе 40 000 МЕ внутривенно (через день), в комплексе с препаратами железа и витаминами, с целью предоперационной стимуляции эритропоэза и коррекции анемии перед нейрохирургическими вмешательствами (курс ЕРО в среднем составил 14 суток).
Аутологичные методы гемотрансфузии
1. Предоперационная заготовка аутокрови
Проводится у пациентов в течение нескольких недель до момента проведения оперативного вмешательства. Эксфузированную кровь используют во время оперативного вмешательства. Возможна также заготовка свежезамороженной аутоплазмы.
При использовании аутогемотрансфузии в отличие от трансфузии гомологичной крови и ее компонентов отмечаются более высокий антианемичный заместительный эффект, отсутствие посттрансфузионного иммунодепрессивного действия, а также экономический эффект, позволяющий сохранить запасы гомологичной крови. Положительным эффектом аутодонорства является также стимуляция гемопоэза (число ретикулоцитов максимально увеличивается на 7–9е стуки), увеличение продолжительности циркуляции эритроцитов в крови реципиента [13]. Увеличение количества эритроцитов после эксфузии и заготовки аутокрови зависит от усиления эритропоэза. Основным пусковым механизмом его стимуляции является низкий уровень гемоглобина. Поэтому выработка эндогенного эритропоэтина находится в линейной зависимости от уровня гемоглобина, начиная с уровня 110 г/л и ниже. Эритропоэз можно также усилить введением препаратов ЕРО.
Предоперационная заготовка крови показана при оперативных вмешательствах, которые требуют трансфузии более 2 доз эритроцитарной массы (либо планируемая кровопотеря не менее 1 л). Эксфузию аутокрови для заготовки производят 1 раз в неделю на протяжении периода, не превышающего срока хранения получаемого компонента крови. В целом повтор взятия крови, объем и промежутки между эксфузиями аутокрови определяются совместно трансфузиологом и анестезиологом индивидуально для каждого больного, исходя из уровня планируемой интраоперационной кровопотери, адекватного уровня гемоглобина и гематокрита, а также способности больного переносить временную кровопотерю. Функциональные сдвиги, развивающиеся в организме пациента после эксфузии крови, компенсируются в течение 3–4 суток.
Заготовка аутокрови проводится при наличии следующего уровня лабораторных показателей: гемоглобин > 114 г/л, гематокрит > 0,34 л/л, общий белок > 60 г/л, лейкоциты менее 10 · 109/л, тромбоциты более 100 · 109/л, АЧТВ 35–50 с [13].
Противопоказания для предоперационной заготовки аутокрови: гемоглобин < 110 г/л, гематокрит < 0,30–0,34 л/л, гипопротеинемия (общий белок < 60 г/л) и гипоальбуминемия (< 35 г/л), лейкопения (лейкоциты менее 4 · 109/л), тромбоцитопения. К противопоказаниям также относятся: гипотензия (АД менее 100/60 мм рт.ст.), выраженная сердечная недостаточность, нестабильная стенокардия, недавно перенесенный острый инфаркт миокарда, атриовентрикулярная блокада, желудочковая аритмия, сепсис, вирусные заболевания, тяжелая форма бронхиальной астмы, наследственные заболевания крови, гемофилия, менструация и первые 5 дней после нее, возраст более 75 лет, выраженная почечная или печеночная дисфункция, терапия антикоагулянтами, тромбозы, тромбофлебитическая болезнь, метастазирующий рак, выраженное проявление или осложнение основного заболевания в день кроводачи.
Компенсированные заболевания (сердечнососудистые, дыхательные, эндокринные и пр.), а также физиологические состояния (беременность) не исключают возможность аутодонорства.
Технологически эксфузию крови для заготовки проводят 1 раз в неделю. Стандартная доза одной эксфузии крови составляет 400–500 мл (5–7 мл/кг) [13]. Время между двумя заготовками можно сокращать до 4 дней, а хирургическое вмешательство производить уже через 72 часа после последней процедуры, что позволяет больному восстановить белки плазмы.
Забор крови производят в стандартные контейнеры, содержащие антикоагулянт, и разделяют на компоненты (эритроциты и плазму). Это дает важное преимущество аутокрови — сохранение своих свойств факторами свертывания.
2. Нормоволемическая гемодилюция
2.1. Интраоперационная гемодилюция — частичное удаление и резервирование крови пациента до достижения заранее установленного допустимого уровня гематокрита, с последующим адекватным замещением ее коллоидными и/или кристаллоидными растворами. Данный метод позволяет снизить потребность в гомологичной крови на 18–100 %, поскольку в ходе операции теряется уже разведенная кровь, и, следовательно, пациент потеряет меньшее количество клеток крови. Нормоволемическая гемодилюция является высокоэффективной, так как позволяет минимизировать гиповолемию и оптимизировать доставку кислорода за счет снижения вязкости крови и улучшения микроциркуляции.
Для расчета объема эксфузируемой крови на основании исходного гематокрита, минимально допустимого гематокрита и ОЦК используют формулу:
V (объем эксфузии) = ОЦК ´ ´ (исходный Ht – конечный Ht) / средний Ht.
ОЦК рассчитывают как процент массы тела: 7 % — у мужчин и 6,5 % — у женщин, либо по формуле: масса тела (кг) ´ 70, или по номограмме.
Например, ОЦК у мужчины массой тела 70 кг составляет около 5 л, Ht исходный — 0,45 л/л, Ht конечный — 0,30 л/л. Расчетный объем эксфузии крови составит: V = 5000 мл ´ (0,45 – 0,30) / 0,38 = = 1,979 мл.
Реинфузию аутокрови осуществляют после завершения хирургического гемостаза или в течение 6 часов после нее.
При проведении острой нормоволемической гемодилюции доставка кислорода увеличивается, достигая максимума при уровне Ht 0,30 л/л, и снижается при Ht менее 0,20 л/л. В целом транспорт кислорода при проведении гемодилюции сохраняется на достаточном уровне при условии поддержания нормоволемии. При этом потребление кислорода миокардом не изменяется. За счет уменьшения вязкости крови улучшается микроциркуляция и доставка кислорода тканям, снижается общее периферическое сопротивление сосудов.
Абсолютных противопоказаний к использованию острой нормоволемической гемодилюции нет, но при ИБС (нестабильная стенокардия, острый инфаркт миокарда), анемии с уровнем гемоглобина ниже 70 г/л, патологии системы гемостаза и почечной недостаточности данный метод должен использоваться с осторожностью.
2.2. Предоперационная гемодилюция. При использовании данной методики часть ОЦК замещают плазмозаменителями, оперативное вмешательство начинают при минимальном уровне гематокрита, а собранную аутокровь используют для компенсации интраоперационной кровопотери. Используется в случае, когда для заблаговременной заготовки аутокрови нет времени, у пациента производят эксфузию части крови, с последующим замещением ее плазмозаменителями с целью поддержания нормоволемии, снижая уровень гематокрита до 0,30–0,20 л/л. Эксфузию крови производят непосредственно перед или вскоре после индукции вводной анестезии.
3. Интра или постоперационный сбор и реинфузия крови
3.1. Сбор и реинфузия крови. В случае реинфузии излившейся крови без отмывания следует помнить, что она содержит ряд вредных факторов: свободный гемоглобин, продукты деградации фибрина и Dдимеры, активированные факторы свертывания, вазоактивные вещества, микроагрегаты, креатинкиназу и лактатдегидрогеназу. В недавнем исследовании [14] был проанализирован состав аутокрови, излившейся из плевральной полости вследствие травматического гемоторакса в сравнении с венозной кровью тех же пациентов, в результате которого было показано существенное снижение факторов свертывания. Так, МНО было > 9 в сравнении с 1,1 в венозной крови, АЧТВ > 180 с в сравнении с 28,5 с, уровень фибриногена — менее 0,5 г/л в сравнении с 2,88 г/л. Средний уровень гемоглобина, гематокрита и тромбоцитов также был ниже в крови, полученной из плевральной полости, по сравнению с венозной кровью: Hb составил 93 г/л в сравнении со 118 г/л соответственно, Ht — 0,26 л/л в сравнении с 0,33 л/л соответственно, тромбоциты — 53 К/мкл в сравнении со 174 К/мкл соответственно. Таким образом, кровь гемоторакса содержит достоверно меньше факторов свертывания и имеет более низкий гемоглобин по сравнению с венозной кровью.
В настоящее время существуют два метода реинфузии крови:
а) реинфузия крови через фильтры — в худшем случае это дедовская технология использования банки с 8 слоями марли. Лучшим методом является очистка крови пациента, собранной либо в стандартные промышленно выпускающиеся контейнеры, содержащие антикоагулянт, либо во флаконы с добавлением нефракционированного гепарина (из расчета 2,5 тысячи единиц на 1 л собранной крови), через микропористые фильтры, например производящиеся фирмой PALL, обеспечивающие хорошую очистку и быстрый возврат излившейся крови, что демонстрирует наш опыт их использования у пациентов с политравмой, имевших массивный гемоторакс. Обязательным условием перед реинфузией собранной крови является проверка ее пригодности путем проведения пробы Бакстера на наличие гемолиза. Образец крови из собранного объема излившейся крови центрифугируют и оценивают надосадочный слой. В случае пригодности крови для реинфузии надосадочный слой плазмы будет прозрачным с обычным желтым оттенком. Если в собранной крови уже наступил гемолиз, надосадочный слой будет коричневого цвета, свидетельствующего о высоком содержании свободного гемоглобина и непригодности собранной крови для реинфузии;
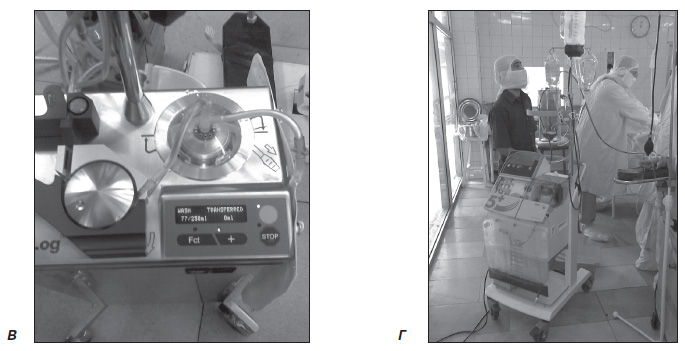
б) аппаратная реинфузия крови — использование аппаратов для реинфузии крови типа Cell Saver, представляет собой наиболее оптимальный вариант сбора и очистки излившейся крови. Кровь, излившаяся в операционную рану, отсасывается и смешивается с антикоагулянтом, фильтруется через микропористый фильтр и поступает в резервуар накопления (рис. 1А), после чего происходит ее центрифугирование (рис. 1Б) и пятикратное отмывание физиологическим раствором (рис. 1В), в результате получают отмытые эритроциты с гематокритом не менее 0,60 л/л. После чего производится возврат в сосудистое русло (рис. 1Г). Содержание 2,3ДФГ в реинфузируемой собранной Cell Saver крови значительно выше, чем в консервированной гомологичной крови, и соответственно ее кислородная емкость больше.
Абсолютные противопоказания для аппаратной реинфузии крови:
— гемолиз эритроцитов, не устраняемый отмыванием;
— гнойносептические заболевания;
— ранение полого органа;
— загрязнение препаратами, не разрешенными к парентеральному применению;
— загрязнение бетадином, перекисью водорода, дистиллированной водой, спиртом, гемостатическими препаратами на основе коллагена.
Относительные противопоказания: операции по поводу злокачественных опухолей, кровотечение в связи с разрывом матки, хроническая болезнь почек.
3.2. Послеоперационная аутотрансфузия дренажной крови. Часто послеоперационная кровопотеря может быть такой же или даже больше, как и во время операции (например, при реконструктивных операциях в травматологии). В собираемой по дренажам крови, в которой сниженный уровень фибриногена и одновременно высокая фибринолитическая и тромболитическая активность, также отмечаются повышенный уровень свободного гемоглобина, дисфункция тромбоцитов, существует опасность бактериального загрязнения [13].
Дренажная кровь должна быть перелита в течение не более 6 часов с момента установки дренажей. При этом кровь, подвергшаяся секвестрации и гемолизу, не пригодна для переливания. Лучшим вариантом, позволяющим минимизировать указанные неблагоприятные изменения в дренажной крови, является ее отмывание при помощи аппарата Cell Saver.
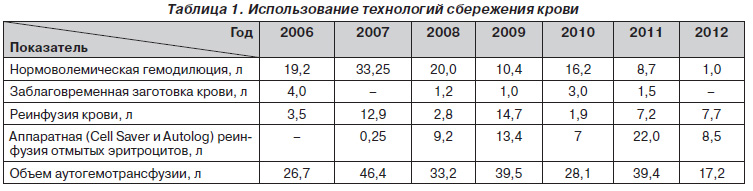
Наш опыт использования методов сбережения крови свидетельствует о высокой эффективности вышеизложенных технологий, которые в ряде случаев, в частности при политравме с массивной кровопотерей, играют ключевую роль в спасении жизни таким пациентам в критическом состоянии. Это относится к имеющимся в нашем распоряжении двум аппаратам для реинфузии крови — Cell Sаver 5+ (Haemonetics) и Autolog (Medtronik). За время использования в нашей клинике технологий кровесбережения объем аутогемотрансфузии составил 230,5 л (табл. 1).
Таким образом, использование технологий сбережения крови позволяет значительно сократить объемы трансфузируемой аллогенной крови, избежать постгемотрансфузионных осложнений и обеспечить немедленный возврат полученных из излившейся крови отмытых эритроцитов, играя ключевую роль в исходе геморрагического шока при массивной кровопотере.
1. Ван дер Линден Ф. Теоретические аспекты периоперационной анемии // Анестезиология и реаниматология. Приложение «Альтернативы переливанию крови». Материалы симпозиума. — 1999. — С. 4452.
2. Шандер Э. Трансфузионная терапия: мультидисциплинарная стратегия для снижения количества аллогенных трансфузий // Актуальные проблемы анестезиологии и реаниматологии. Освежающий курс лекций. — Вып. 17. — Архангельск, 2011. — С. 235242.
3. Хэгг О. Как хирург может ограничить периоперационную кровопотерю // Анестезиология и реаниматология. Приложение «Альтернативы переливанию крови». Материалы симпозиума. — 1999. — С. 5367.
4. Shander A., Moskowitz D.M., Javidroozi M. Blood conservation in practice: on overview // Br. J. of Hospital Medicine. — V. 70. — P. 1621.
5. Cardone D., Klein A.A. Perioperative blood conservation // European Journal of Anaesthesiology. — 2009. — V. 26. — P. 722729.
6. Fergusson D., Glass K.C., Hutton B., Shapiro S. Randomized controlled trials of aprotinin in cardiac surgery: could clinical equipoise have stopped the bleeding? // Clin. Trials. — 2005. — V. 2. — P. 218219.
7. Henry D.A., Careless P.A., Moxey A.J. et al. Antifibrinolytic use for minimizing perioperative allogenic blood transfusion // Cochrane Database Syst. Rev. — 2007. — CD 0011886.
8. Mangano D.T., Tudor I.C., Dietzel C. The risk associated with aprotinin in cardiac surgery // N. Engl. J. Med. — 2006. — V. 354. — Р. 353365.
9. Fergusson D., Hebert P.C., Mazer D. et al. A comparison of aprotinin and lysine analogues in highrisk cardiac surgery // N. Engl. J. Med. — 2008. — V. 358. — Р. 23192331.
10. Napolitano L.M., Kurek S., Luchette F.A et al. Clinical practice guidelines: Red blood cell transfusion in adult trauma and critical care // Critical Care Medicine. — 2009. — V. 37. — P. 31243157.
11. Шандер А. Анестезиологическая тактика и фармакологические средства для ограничения периоперационной кровопотери // Анестезиология и реаниматология. Приложение «Альтернативы переливанию крови». Материалы симпозиума. — 1999. — С. 5367.
12. Громова В.В., Имаев А.А., Лубнин А.Ю. Применение препаратов человеческого рекомбинантного эритропоэтина как метод кровесбережения в нейрохирургии // Анестезиология и реаниматология. — 2010. — № 4. — С. 1923.
13. Марутян З.Г., Никифоров Ю.В., Казанцев А.Б., ТерГригорян А.А. Современные кровесберегающие технологии при реконструкции таза // Общая реаниматология. — 2010. — № 4. — С. 6669.
14. Salhanick M., Corneille M., Higgins R. et al. Autotransfusion of hemothorax blood in trauma patients: is it the same as fresh whole blood? // Am. J. Surgery. — 2011. — V. 202. — P. 817822.