Международный неврологический журнал 4(4) 2005
Вернуться к номеру
Актовегин в лечении больных с дисциркуляторной энцефалопатией
Авторы: Е.И. Чуканова, Кафедра неврологии и нейрохирургии лечебного факультета РГМУ с циклом ФУВ, Москва
Рубрики: Неврология
Версия для печати
Проведено комплексное клинико-инструментальное обследование 59 пациентов с дисциркуляторной энцефалопатией (ДЭ), получавших парентерально Актовегин по 160 мг (4 мл) в сутки в течение 25 дней (2 курса в год). Применение Актовегина в сочетании с гипотензивными и антитромботическими препаратами оказывало выраженное положительное влияние на неврологическую симптоматику, вызывая ее регресс. При лечении Актовегином отмечен эффект нарастания эффективности после окончания курса лечения, что способствует стабильному улучшению состояния больных с разными стадиями ДЭ. Комплексное лечение пациентов с ДЭ с использованием Актовегина приводило к значительному снижению риска прогрессирования заболевания, а также к уменьшению риска развития ТИА и инсультов по сравнению с контрольной группой, получавшей только базовую терапию.
Введение
Сосудистые заболевания головного мозга — одна из ведущих причин не только заболеваемости, но и, в первую очередь, смертности и инвалидизации как в Российской Федерации, так и во всем мире. Сердечно-сосудистые заболевания являются ведущей причиной смерти в промышленно развитых странах мира. Например, в США на них приходится 42% всех случаев смерти, ежегодно от них умирает до миллиона человек [20, 24, 27, 28]. Россия выделяется среди промышленно развитых стран мира высокой частотой развития инсульта и высокими показателями смертности от этого заболевания. Она занимает второе место в мире по смертности от церебрального инсульта, которая в 3-8 раз выше, чем, к примеру, в США, Франции и Швейцарии. Более того, в отличие от Японии, США, Австралии и многих стран Западной Европы в России смертность от инсульта не снижается [13, 14, 27, 29]. По данным аналитических исследований, проведенных ВОЗ, проблема цереброваскулярной патологии и инсульта является чрезвычайной важной, и ее влияние на уровень здоровья и жизни населения всего мира будет последовательно возрастать [28].
Инвалидизация после перенесенного инсульта достигает 3,2 на 10 тыс. населения, занимая первое место среди всех причин первичной инвалидности. Из выживших пациентов до 80% остаются инвалидами разной степени тяжести, 30% больных, перенесших инсульт, полностью не восстанавливаются, а еще 20% нуждаются в постороннем уходе. Безусловно, решение данной проблемы возможно лишь при проведении первичной и вторичной профилактики, совершенствовании системы квалифицированной медицинской помощи больным с цереброваскулярной недостаточностью [13, 27].
К настоящему времени в целом сформировано представление о многофакторном механизме развития сосудистой мозговой недостаточности [4, 5, 15, 20, 22]. Однако ни один из факторов риска не может целиком объяснить ни выраженность неврологических нарушений, ни характер течения заболевания, что подтверждает сложность механизмов возникновения и прогрессирования острой и хронической сосудистой мозговой недостаточности [7-9, 28, 31].
Дисциркуляторная энцефалопатия (ДЭ) является следствием патофизиологических процессов при хронической церебральной гипоперфузии.
В последнее время многочисленные нейробиологические исследования, посвященные механизмам смерти клетки, в т.ч. при недостаточности мозгового кровообращения, значительно расширили понимание основных закономерностей некроза и апоптоза. Было установлено, что оба фундаментальных механизма смерти клеток сопряжены с нарушениями энергетического метаболизма, дисфункцией митохондрий, оксидантным повреждением [3, 6, 11, 16].
При ишемии мозга, как острой, так и хронической, возникает каскад биохимических процессов, включающих нарушения мембранной целостности и ионного транспорта, прогрессирующий протеолиз, расстройства функционального взаимодействия нейромедиаторов, индукцию апоптоза, ведущих в конечном счете к гибели популяций нервных клеток [13,14-19, 22].
Лечение пациентов с хронической церебральной сосудистой недостаточностью представляется сложной медико-социальной проблемой. Разработка универсального метода терапии и профилактики ДЭ проблематична, так как эта патология характеризуется высокой степенью патогенетической гетерогенности. В настоящее время большое внимание уделяется изучению места нейропротекторов в лечении больных с острыми и хроническими формами цереброваскулярной патологии. Протекция мозга при хронической недостаточности мозгового кровообращения может быть одним из наиболее эффективных методов лечения пациентов с данной патологией. Назначение нейропротекторов способствует предотвращению развития нарушений церебрального метаболизма у больных с повышенным риском ишемии мозга, т.е. в случаях, когда резервы церебральной гемодинамики и метаболизма ограничены. Это может предотвратить тяжелое и необратимое повреждение нейронов [3, 10, 13, 17, 23, 27-30].
Однако в изученной литературе, посвященной лечению нейропротекторами больных с хронической недостаточностью мозгового кровообращения, мы не нашли однозначного ответа на целесообразность их применения, поскольку:
— недостаточно изучены вопросы влияния нейропротекторов на прогрессирование ДЭ и развитие осложнений данного заболевания;
— нет сведений об их использовании в комплексе с препаратами, применяющимися для устранения основных факторов риска цереброваскулярных заболеваний — артериальной гипертензии и атеротромбоза.
Одним из лекарственных средств, обладающих выраженным нейропротективным действием, является препарат Актовегин, содержащий исключительно физиологические компоненты (органические низкомолекулярные соединения: аминокислоты, олигопептиды, нуклеозиды; промежуточные продукты углеводного и жирового обмена; электролиты и ряд важных микроэлементов), характеризующиеся высокой активностью. Физиологические субстанции, входящие в состав Актовегина, составляют основу плазмы крови.
Актовегин, являясь антигипоксантом, активно влияет на уровень циклических нуклеотидов, поддерживающих окислительно-восстановительные процессы, адекватный церебральный метаболизм. Основой фармакологического действия Актовегина является его влияние на процессы внутриклеточного метаболизма. С помощью этого препарата улучшаются транспорт глюкозы и поглощение кислорода в тканях, что приводит к активации процессов аэробного окисления, увеличивающей энергетический потенциал клетки.
Актовегин улучшает микроциркуляцию и трофику тканей организма. В клетках под его влиянием:
— повышается обмен высокоэнергетических фосфатов (АТФ);
— активируются ферменты окислительного фосфорилирования (пируват- и сукцинатдегидрогеназы, цитохром-c-оксидаза);
— повышается активность кислой фосфатазы и липосомальная активность;
— возрастает активность щелочной фосфатазы, ускоряется синтез углеводов и белков;
— увеличивается приток ионов калия, происходит активация калийзависимых ферментов: каталаз, сахараз, гликозидаз;
— ускоряется распад продуктов анаэробного гликолиза — лактата и β-гидроксибутирата.
Эффекты Актовегина наиболее выражены при гипоксическом характере повреждения тканей, при этом препарат оказывает системное действие на организм, увеличивая кислородный энергообмен в клетках всех органов, находящихся в состоянии метаболической недостаточности.
Опыт применения Актовегина в неврологической практике у больных, страдающих сосудистыми и атрофическими заболеваниями головного мозга, показывает, что под его влиянием повышается устойчивость мозговой ткани к гипоксии. Улучшая доставку кислорода и уменьшая выраженность ишемических повреждений тканей, Актовегин, кроме того, опосредованно усиливает белоксинтезирующую функцию клеток и оказывает иммуномодулирующее действие [1-3, 6, 17-19, 23].
В настоящем исследовании нами была предпринята попытка изучить эффективность Актовегина в плане его влияния на прогрессирование ДЭ и развитие обострений в ходе заболевания, а также на динамику отдельных неврологических синдромов в зависимости от вариантов течения ДЭ.
Материал и методы
На кафедре неврологии и нейрохирургии лечебного факультета РГМУ с циклом ФУВ было проведено комплексное обследование пациентов с хронической недостаточностью мозгового кровообращения, включающее клинико-инструментальные и лабораторные исследования. Всего обследовано 427 больных с ДЭ I, II и III стадий, находившихся на амбулаторном лечении. Пациенты наблюдались в течение года. Больные были обследованы до начала приема препаратов, затем в конце 1, 3, 6, 7 и 12-го месяцев.
Исследуемую группу составили 59 пациентов с ДЭ I, II и III стадий, получавших Актовегин в дозе 160 мг (4,0 мл) внутримышечно. Курс лечения составил 25 дней. В течение года больные получали 2 курса — на 1-й и 6-й месяцы лечения.
В 1 группу контроля вошли 118 пациентов с ДЭ, клинически сопоставимых с больными исследуемой группы.
Больные 1 контрольной и исследуемой групп получали базовую терапию, которая была максимально унифицирована и включала прием ацетилсалициловой кислоты (100 мг/сут), дипиридамола (150 мг/сут), глицина (900 мг/сут) и эналаприла. Последний назначался в индивидуальной дозе, в зависимости от стадии артериальной гипертензии и исходного уровня артериального давления (АД). В результате коррекции АД достигало уровня 120/70 — 150/80-85 мм рт.ст. в зависимости от длительности течения артериальной гипертензии, степени выраженности перфузионных нарушений головного мозга и исходного уровня АД в начале исследования. При недостаточности гипотензивного эффекта эналаприл комбинировали с индапамидом в дозе 2,5 мг/сут.
При наборе пациентов использовался метод рандомизации. Исследование проводилось открытым методом.
Вторую контрольную группу составили 250 пациентов, данные которых были проанализированы ретроспективно на основании амбулаторных карт поликлиник ЦАО г. Москвы.
Диагноз ДЭ ставился на основании результатов комплексного клинико-инструментального обследования в соответствии с существующей классификацией сосудистых заболеваний головного мозга [26].
Пациенты, имевшие выраженные двигательные и речевые нарушения, не включались в исследование из-за возникновения сложностей при их транспортировке на обследования и невозможности проведения адекватного тестирования. Больные, перенесшие инсульт, имели балльную оценку по шкале Рэнкин 3 балла и ниже.
При обследовании больных большое внимание уделялось сбору анамнеза, фиксировались особенности течения цереброваскулярной недостаточности. Учитывалась предшествующая терапия (нейропротекторная, гипотензивная, антитромботическая, применение контрацептивных препаратов и т.п.).
Оценка эффективности Актовегина у больных с разными стадиями ДЭ проводилась в следующих направлениях:
— влияние препарата на выраженность тех или иных неврологических синдромов;
— влияние препарата на риски прогрессирования заболевания, возникновение транзиторных ишемических атак (ТИА) и инсультов.
С целью детальной оценки неврологического статуса и возможности последующей обработки данных применялись следующие шкалы: MFI-20, MCA:FMA (Motor Club Assessment: Functional Movement Activities), шкала Тиннетти (Functional Mobility Assessment in Eldery Patients), шкала тревоги Спилбергера (State-Trait Anxiety Inventory), шкала Гамильтона (Hamilton Depression Rating Scale), скрининг-оценка умственного состояния (Mini Mental State Examination MMSE), опросник «Восстановление Локуса Контроля» (Recovery Locus of Control), модифицированная шкала Рэнкин, предназначенная для оценки функциональных последствий инсульта [25].
Ввиду разномасштабности и разнонаправленности используемых шкал, для удобства изложения и восприятия материала мы сочли удобным описывать динамику упомянутых показателей в терминах относительных изменений, говоря о проценте улучшения (либо ухудшения) соответствующего показателя по отношению к его исходному состоянию.
Помимо клинического обследования, всем больным проводились лабораторные, инструментальные и нейровизуализационные исследования.
Результаты исследования
Сравнительный анализ контрольных групп пациентов и группы больных, получавших Актовегин, свидетельствовал об их сопоставимости по полу, возрасту, этиологии, тяжести течения и преимущественной локализации патологического процесса.
Перед рассмотрением действия Актовегина необходимо остановиться на результатах лечения больных, входивших в 1 контрольную группу, получавших антигипертензивную и антитромботическую терапию.
Лечение пациентов с ДЭ препаратами, адекватно снижающими уровень АД, в сочетании с антитромботической терапией (1 контрольная группа) обеспечивало регресс неврологических синдромов, что было особенно выраженным у пациентов с I и II стадиями ДЭ. Базовая терапия снижала риск прогрессирования ДЭ (59,7 против 70,6% во 2 контрольной группе), а также риск развития ТИА и инсульта за период наблюдения по сравнению со 2 контрольной группой (группа «типичной практики»: 11,7 и 9,3% против 21,5 и 17,3% соответственно, табл. 1).
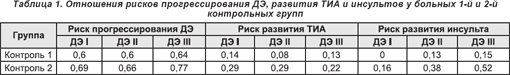
В течение 12-месячного наблюдения базовая терапия, назначаемая больным 1 контрольной группы, способствовала регрессу астенического синдрома, активно влияла на показатели нейропсихологических характеристик. У больных с ДЭ I стадии статистически достоверное влияние лечения на балльную оценку в соответствии с используемыми шкалами прослеживалось начиная с 7 месяца терапии. При анализе результатов лечения больных с ДЭ II стадии статистически достоверной была динамика астенического синдрома, показателей тревоги и мотивации, а также оценки по шкале MMSE. Положительное влияние базовой терапии на вестибулярную и лобную атаксию было в пределах достоверности р > 0,05. У больных с ДЭ III стадии статистически достоверное влияние такого лечения было отмечено лишь в отношении выраженности астенического синдрома и балльной оценки по шкале тревоги Спилберга к 7 месяцу наблюдения (табл. 2-4).
Сравнение результатов лечения у больных ДЭ I стадии в исследуемой и 1 контрольной группах свидетельствует о положительном влиянии Актовегина на неврологические показатели: усиление регресса астенического синдрома, вестибулярной атаксии, улучшение балльной оценки по шкалам мотивации и тревоги (табл. 2).
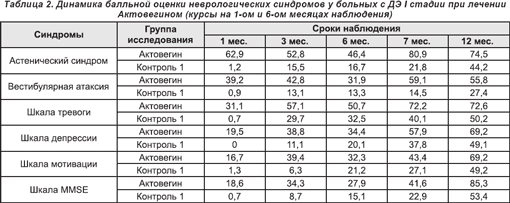
У больных с ДЭ II стадии Актовегин положительно влиял на динамику вестибулярной атаксии и псевдобульбарных нарушений (в данном случае — аксиальных рефлексов), а также на балльную оценку по шкале «движение». Обращает на себя внимание значительное увеличение выраженности терапевтического «следового» эффекта Актовегина по всем неврологическим шкалам к 3 месяцу наблюдения, что было особенно выражено у пациентов с ДЭ II стадии. Терапевтический эффект Актовегина сохранялся до 4 месяцев после окончания лечения (табл. 3).
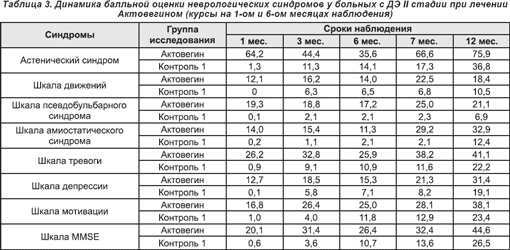
У больных с ДЭ III стадии также была продемонстрирована высокая клиническая эффективность Актовегина в отношении балльных оценок по шкалам астенического синдрома, движения, атаксии, псевдобульбарного и амиостатического синдромов (табл. 4).
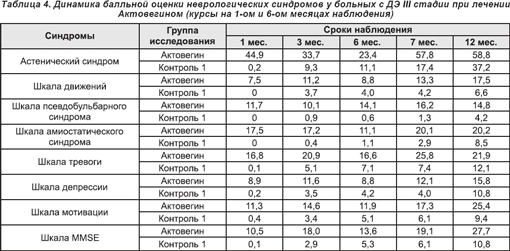
Актовегин, проявлявший высокую клиническую эффективность при лечении пациентов старших возрастных групп, статистически достоверно уменьшал проявления отмечавшейся у больных венозной дисциркуляции (р < 0,001), а также улучшал показатели реограммы (р < 0,001), снижал уровни С-реактивного белка (р < 0,05) и мочевины крови (р < 0,05).
Из табл. 5 следует, что при лечении Актовегином прослеживалась тенденция к увеличению частоты стабильного течения ДЭ по сравнению с больными 1 контрольной группы. К концу 12-месячного наблюдения, после проведения двух курсов лечения Актовегином, у пациентов с ДЭ отмечалась стабилизация прогрессирования заболевания. Частота стабильного течения ДЭ I, II и III стадии составляла 78,9, 81,8 и 66,7% соответственно против 42,9,41,0 и 36,2% в 1 контрольной группе.
В отношении развития инсульта из табл. 5 следует, что у больных с ДЭ I, II и III стадий, получавших Актовегин, инсультов не отмечалось, что говорит о статистически значимом снижении риска их возникновения.

Результаты проведенного исследования подтвердили безопасность курсового применения Актовегина в дозе 160 мг продолжительностью 25 дней при лечении пациентов с хронической недостаточностью кровообращения. Побочные эффекты, выражавшиеся в развитии аллергических реакций, были выявлены у 2 (3,3%) больных. Они были купированы приемом антигистаминных препаратов. Пациенты продолжали получать назначенное лечение и не были исключены из исследования. Влияния Актовегина на уровень глюкозы в крови и показатели ЭЭГ у исследуемых пациентов отмечено не было.
Таким образом, лечение больных ДЭ Актовегином в сочетании с гипотензивной и антитромботической терапией оказывает положительный эффект на имеющиеся неврологические синдромы, вызывая их регресс, причем отмечается нарастание терапевтического эффекта Актовегина после окончания курса лечения (до 4-5 месяца наблюдения), что способствует стабильному улучшению состояния больных. Лечение пациентов с ДЭ Актовегином в сочетании с гипотензивной и антитромботической терапией приводит к значительному снижению риска прогрессирования ДЭ I, II и III стадий (ОР = 0,4-0,3-0,5 соответственно стадиям заболевания), а также риска развития ТИА (ОР = 0-0,6-0,4) и инсультов (ОР = 0-0-0) по сравнению с больными 1 контрольной группы, получавшими только гипотензивную и антитромботическую терапию.
1. Актовегин: новые аспекты применения в клинической практике. — М., 1997. — 102 с.
2. Актовегин: в хирургии, внутренней медицине, лучевой терапии, дерматологии, спортивной медицине, общей медицинской практике // Научно-медицинская документация. Хафслунг Никомед фарма АГ. — Линц, Австрия. — 62 с.
3. Антиоксидантная и энергопротекторная терапия ишемического инсульта. — Метод. пособие. МЗ РФ РГМУ / Под ред. А.И. Федина, С.А. Румянцевой, О.Р. Кузнецова и др. — М., 2004. — 48 с.
4. Бригов А.Н. Современные проблемы профилактики сердечно-сосудистых заболеваний // Кардиология. 1996. — №3.— С. 18-22.
5. Бригов А.Н., Быстрова М.М., Орлов А.А. Профилактика инсульта — реальная задача в практике кардиологов и терапевтов // Кардиоваскулярная терапия и профилактика. — 2002. — №1. — С. 53-61.
6. Бурлакова Е.Б. Молекулярные основы применения антиоксидантов при лечении сердечно-сосудистых заболеваний // Биологические мембраны и проблемы современной кардиологии. — М., 1979. — С. 22-25.
7. Бурцев ЕМ. Дисциркуляторная энцефалопатия (эпидемиология, варианты клинического течения, классификация, лечение) // Проблемы неврологии и нейрохирургии. Сборник научных трудов. — Иваново, 1994. — С. 93-102.
8. Василенко Ф.И., Лифшиц Ф.И., Макарова Л.Д. и др. К патогенезу инфаркта головного мозга при атеросклеротической дисциркуляторной энцефалопатии в пожилом возрасте // VII Всероссийский съезд неврологов (тезисы докладов). — Н. Новгород, 1995.
9. Верещагин Н.В., Варакин Ю.Я. Профилактика острых нарушений мозгового кровообращения: теория и реальность // Журнал неврологии и психиатрии им. Корсакова, 1996. — №5. — С. 5-9.
10. Виленский Б.С. Препараты нейротрофического действия в лечении инсульта // Качество жизни. Медицина. Болезни сердечно-сосудистой системы, 2003. — №2. — С. 53-56.
11. Гомазков О.А. Апоптоз нейрональных структур и роль нейротрофических ростовых факторов. Биохимические механизмы эффективности пептидных препаратов мозга // Журнал неврологии и психиатрии им. Корсакова. Приложение «Инсульт», 2002. — Вып. 7. — С. 17-22.
12. Гомазков О.А. Молекулярные механизмы регуляции нейрохимических процессов // Успехи физиологических наук. М., 2003. Т. 34. № 3. С. 42-54.
13. Гусев Е.И., Скворцова В.И. Ишемия головного мозга М., 2001.326 с.
14. Гусев Е.И., Скворцова В.И. Нейропротекторы в комплексной терапии ишемического инсульта // Лечение нервных болезней, 2002. — Т.3. — № 3 (8). — С. 3-10.
15. Дамулин И.В. Дисциркуляторная энцефалопатия в пожилом и старческом возрасте. Дис. докт. мед. наук. — М., 1997.
16. Ермилов В.В., Капитонова М.Ю. Апоптоз: современные геронтологические и патологические аспекты // Клиническая геронтология, 1997. — №3. — С. 43-50.
17. Нейрометаболическая терапия хронической ишемии мозга. Метод. пособие МЗ и СР РФ/ под ред. З.А. Суслиной, С.А. Румянцевой. — М., 2005.
18. Одинак М.М., Вознюк И.А. Программированная клеточная гибель — патогенетический механизм дисциркуляторной энцефалопатии // Лечение нервных болезней. — 2002. — № 1(6). — С. 40-42.
19. Одинак М.М., Вознюк И.А. Новое в терапии при острой и хронической патологии нервной системы (нейрометаболическая терапия при патологии нервной системы). — 2001. — 62 с.
20. Профилактика и лечение инсульта. Рекомендации Европейской инициативной группы по проблеме инсульта // Журнал неврологии и психиатрии им. Корсакова. Приложение «Инсульт». — 2001. — Вып. 4. — С. 3-9.
21. Румянцева С.А., Гридчик И.Е., Врублевский О.П. Место актовегина и инстенона в лечении энцефалопатии различного генеза // Клиническая геронтология. — 1996. — №2. — С. 37-40.
22. Скворцова В.И. Участие апоптоза в формировании инфаркта мозга // Журнал неврологии и психиатрии им. Корсакова. Приложение «Инсульт». 2001. — Вып. 2. — С. 12-19.
23. Федин А.И. Оксидантный стресс и применение антиоксидантов в неврологии // Атмосфера. — 2002. — №1. — С. 15-19.
24. Фритас Г.Р., Богуславский Дж. Первичная профилактика инсульта // Журнал неврологии и психиатрии им. Корсакова. Приложение «Инсульт», 2001. — Вып. 1. — С. 7-21.
25. Шкалы, тесты и опросники в медицинской реабилитации. Руководство для врачей и научных сотрудников / под ред. А.Н. Беловой и О.Н. Щепетовой. — М., 2002. — 439 с.
26. Шмидт Е.В., Максудов Г.А. Классификация сосудистых заболеваний головного и спинного мозга // Журнал невропатологии и психиатрии им. Корсакова. — 1971. — №71. — С . 3-11.
27. Anderson K.M., Wilson P.W.F., Odell P.M. et al. An updated coronary risk profile // Circulation, 1991; 83: 356-62.
28. Argentine C., Prencipe M. The Burden of stroke: a need for prevention. In: Prevention oflschemic Stroke. Eds Fieschi C, Fischer M. London: Martin Dunitz 2000, p. 1-5.
29. Bogousslavsky J. On behalf of the European Stroke Initiative. Stroke prevention by the practitioner // Cerebrovasc Dis., 1999; 9 (Suppl. 4): 1-68.
30. Bonita R. Epidemiology of stroke // Lancet, 1992; 339: 342-47.
31. Brunner L.L., Kanter D.S., Manson J.E. Primary prevention of stroke // New Eng 1 Med 1995: 333: 1392-1400.
32. Burn J., Dennis M, Bamford J. et al. Long-term risk of recurrent stroke after a first-ever stroke: the Oxfordshire Community Stroke Project. // Stroke, 1994: 25: 333-37.
