Журнал «Болезни и антибиотики» 2 (05) 2011
Вернуться к номеру
Цефепим сегодня и завтра
Авторы: Березняков И.Г., Харьковская медицинская академия последипломного образования
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
С момента открытия цефалоспоринов — одного из наиболее популярных классов антибиотиков — прошло чуть более 65 лет. За эти годы они по праву заняли достойное место в арсенале средств борьбы человека с инфекциями. Причем при многих инфекционных заболеваниях цефалоспорины являются средством выбора.
Создание и внедрение в клиническую практику различных антимикробных средств вызвало обширные изменения в мире бактерий. Мощное давление, которое оказывают антибиотики на чувствительные к ним микроорганизмы, подтолкнуло и ускорило эволюцию последних. В результате появилась и стала широко распространяться среди микроорганизмов устойчивость к действию антибактериальных средств. Те же из бактерий, которые в силу разных причин не сумели или не успели приспособиться к новым условиям, уступали в конкурентной борьбе резистентным штаммам и видам микроорганизмов. Изменялась этиологическая структура многих инфекций, в особенности внутрибольничных. Все более значительную роль в этиологии последних начинают играть маловирулентные бактерии, обладающие природной устойчивостью к антибиотикам разных групп.
Многие перипетии этой борьбы человека и микроорганизмов прослеживаются на примере создания новых классов цефалоспоринов. Так, в середине ХХ века, накануне внедрения антибиотиков в клиническую практику, наибольшую угрозу таили инфекции, вызванные грамположительными кокками, прежде всего стафилококками. Спектр антимикробного действия цефалоспоринов I поколения включал основные клинически значимые виды грамположительных бактерий и некоторые виды грамотрицательных бактерий. Кроме того, препараты этой группы отличались устойчивостью к действию стафилококковых b-лактамаз, мощным стимулом для «освоения» выработки которых послужило победное шествие пенициллина по всему миру в первые годы его клинического использования.
Возрастание роли грамотрицательных бактерий в этиологии многих инфекций послужило толчком к созданию II, а затем и III поколений цефалоспоринов. Долгие годы цефалоспорины III поколения (самостоятельно или в комбинации с другими антибактериальными средствами) были золотым стандартом в терапии многих тяжелых инфекций. Но в быстро меняющемся мире нет ничего неизменного. Не вдаваясь в обсуждение всех возникших проблем, можно выделить некоторые. Прежде всего наметилась тенденция к восстановлению удельного веса грамположительных бактерий в этиологической структуре многих внутрибольничных инфекций. Во-вторых, неферментирующие бактерии, такие как Pseudomonas aeruginosa и Acinetobacter spp., проявили чудеса пластичности, приспособляемости к меняющимся внешним условиям. В настоящее время, например, смертность при госпитальных пневмониях, вызванных этими микроорганизмами, выше, чем при инфицировании другими бактериями. В-третьих, многие представители семейства Enterobacteriaceae приобрели способность вырабатывать b-лактамазы расширенного спектра действия. Речь идет прежде всего о Klebsiella pneumoniae, Escherichia coli, Proteus spp. В-четвертых, у некоторых микроорганизмов в процессе лечения антибиотиками в результате мутаций в регуляторных областях генома дерепрессируются («раскрываются») гены, отвечающие за синтез b-лактамаз. Многие штаммы Enterobacter spp., Serratia spp. и других бактерий, ставшие гиперпродуцентами хромосомных b-лактамаз и приобретшие таким образом устойчивость ко многим b-лактамным антибиотикам, широко распространились во внутрибольничной среде.
Как связаны эти проблемы с цефалоспоринами III поколения? Цефотаксим и цефтриаксон сохраняют достаточно высокую активность в отношении грамположительных микроорганизмов, но слабо действуют на P. aeruginosa. Антипсевдомонадные цефалоспорины III поколения цефтазидим и цефоперазон, напротив, проявляют высокую активность в отношении P. aeruginosa, но уступают цефотаксиму и цефтриаксону по силе действия на грамположительные микроорганизмы. Бактерии, вырабатывающие b-лактамазы расширенного спектра действия, разрушают цефалоспорины III поколения, что влечет за собой клинические неудачи в случае использования последних. Наконец, бактерии — гиперпродуценты хромосомных b-лактамаз не только появились вследствие широкого применения цефалоспоринов III поколения, но и стали устойчивыми к этим антибиотикам.
Каковы пути преодоления перечисленных трудностей? Их несколько. Можно прибегнуть к комбинированной антибактериальной терапии. В частности, назначать цефалоспорины III поколения в сочетании с аминогликозидами. Но и этот подход не всегда эффективен. Во-первых, представления о взаимном синергизме между антибиотиками этих двух групп, по-видимому, преувеличены [1]. Во-вторых, данная комбинация может оказаться неэффективной в терапии инфекций, вызванных P. aeruginosa (при сочетании цефотаксима или цефтриаксона с гентамицином) или Streptococcus pneumoniae (если в комбинации используется другой цефалоспорин III поколения — цефтазидим). В-третьих, представления о преимуществах комбинированной терапии b-лактамами и аминогликозидами не нашли подтверждения в клинической практике. В систематических обзорах и мета-анализах рандомизированных контролируемых исследований (РКИ) у больных с нейтропенической лихорадкой [2] и сепсисом [3] не выявлено улучшения выживаемости или эффективности вмешательства у пациентов, получавших комбинированную терапию. При этом добавление аминогликозида ассоциировалось с возрастанием частоты нежелательных лекарственных явлений (НЛЯ) [2, 3], в то время как доля инфекций, вызванных резистентными микроорганизмами, не снижалась [2–4].
Другой путь — использование карбапенемов. Это, безусловно, выход. В сущности, единственным ограничением в настоящее время является высокая стоимость антибиотиков данной группы. Не стоит сбрасывать со счетов и опасения лишиться, по сути, последнего средства борьбы с тяжелыми инфекциями при распространении резистентности к карбапенемам. Поэтому антибиотики этой группы применяются для лечения наиболее «проблемных» и тяжелых больных.
Наконец, есть и третья альтернатива. Это цефалоспорины IV поколения, единственным представителем которых, зарегистрированным на рынке Украины, является цефепим. Он, как цефотаксим и цефтриаксон, активен в отношении грамположительных микроорганизмов. Как цефтазидим и цефоперазон, может использоваться в лечении инфекций, вызванных P. aeruginosa. Наконец, цефепим в значительной мере «ускользает» от разрушения b-лактамазами, прежде всего хромосомными b-лактамазами класса С, и обладает рядом других достоинств. Эффективность цефепима была многократно доказана в ходе хорошо спланированных и тщательно проконтролированных клинических исследований.
Что побуждает врачей использовать тот или другой антибиотик? Это и спектр действия, включающий предполагаемые возбудители заболевания у конкретного пациента, и низкий уровень приобретенной резистентности среди клинически значимых патогенов, и доказанная эффективность, и минимальный риск НЛЯ, и совместимость с другими медикаментами, которые используются в комплексной терапии больного, и удобство применения, и хорошее знание препарата, а также многое другое. Что в связи с этим можно сказать о цефепиме?
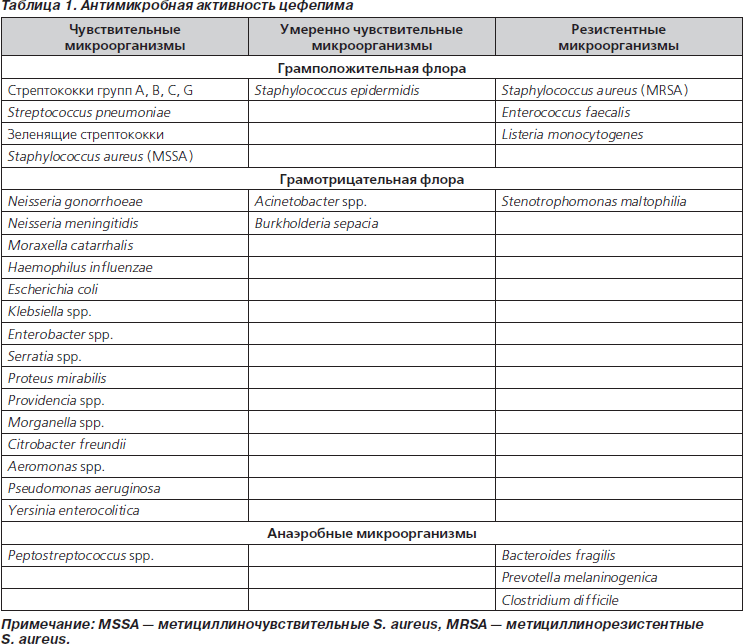
Спектр действия цефепима представлен в табл. 1. Он весьма широк и включает большинство клинически значимых микроорганизмов [5]. Однако решение об использовании антибиотика в конкретной клинической ситуации должно базироваться не только на знании спектра антибактериальной активности, но и на данных о распространении и механизмах устойчивости к нему среди предполагаемых возбудителей заболевания. Распространенность резистентности к конкретному антибиотику различается в разных стационарах и даже отделениях одной и той же больницы. Это связано с частотой использования обсуждаемого препарата и других антибактериальных средств, в том числе из той же группы, наличием перекрестной резистентности, особенностями профилактических мероприятий в данном стационаре или отделении и другими факторами. Результаты многоцентровых исследований дают только общее представление о распространенности устойчивости к определенному антибиотику среди клинически значимых микроорганизмов. Тем не менее они могут служить отправной точкой для принятия решений о внедрении новых подходов к антибактериальной терапии различных инфекций, замене схем, ставших неэффективными вследствие распространения резистентности среди микроорганизмов, и т.д. Кроме того, они позволяют составить общее представление о роли и месте конкретного антибиотика в ряду подобных. Но определяющее значение будет все же иметь локальный профиль резистентности.
Основными механизмами резистентности к b-лактамам являются:
— ферментативное разрушение антибиотиков бактериальными b-лактамазами;
— изменение мишеней для действия антибиотиков, так называемых пенициллинсвязывающих белков (псб);
— активное удаление антибиотиков из микробных клеток с помощью насосов.
Наибольшее значение имеет выработка b-лактамаз, которые различаются по субстратному профилю (преимущественное разрушение пенициллинов, цефалоспоринов и т.д.), локализации кодирующих их выработку генов (хромосомная, плазмидная), спектру действия, чувствительности к ингибиторам и т.д. Цефепим характеризуется высокой устойчивостью к действию большинства b-лактамаз классов А и С, но разрушается b-лактамазами класса В (как, впрочем, и все другие b-лактамные антибиотики, включая карбапенемы). Устойчивость к гидролизу хромосомными b-лактамазами класса С обеспечивает высокую активность цефепима в отношении микроорганизмов — гиперпродуцентов этих ферментов: Enterobacter spp., Citrobacter spp., Serratia spp., Morganella spp., Providencia spp. При этом перечисленные микроорганизмы гидролизуют цефалоспорины I–III поколений. Следует иметь в виду, что цефепим — единственный цефалоспориновый антибиотик, активный в отношении C. freundii — возбудителя энтероколитов, инфекций желче- и мочевыводящих путей (главным образом госпитальных), раневой инфекции, остеомиелита. Устойчивость к бактериальным b-лактамазам связывают с особенностями химического строения молекулы цефепима, биполярная структура которой обеспечивает:
— быстрое проникновение антибиотика через наружную мембрану грамотрицательных бактерий;
— нахождение благоприятной позиции в пориновом канале бактериальной клетки;
— более выраженное сродство к ПСБ кишечной и синегнойной палочек и других микроорганизмов.
Быстрое проникновение цефепима через наружную мембрану и эффективное связывание с ПСБ позволяет ему в значительной мере «ускользать» от разрушения b-лактамазами, которые локализуются в периплазматическом пространстве бактериальной клетки. В результате повышается активность этого антибиотика в отношении грамотрицательных микроорганизмов, в том числе штаммов, устойчивых к цефалоспоринам III поколения. К сожалению, предположения о превосходстве цефепима над цефалоспоринами предшествующих поколений при инфекциях, вызванных продуцентами b-лактамаз расширенного спектра действия, не нашли своего подтверждения в микробиологических и клинических исследованиях последнего десятилетия.
Изменение ПСБ играет важную роль в возникновении устойчивости к b-лактамам у ряда грамположительных микроорганизмов, в частности S. aureus. По активности в отношении метициллиночувствительных штаммов S. aureus цефепим превосходит цефалоспорины III поколения. В то же время цефепим не следует назначать при инфекциях, вызванных метициллинорезистентными золотистыми стафилококками (MRSA). Хотя некоторые штаммы MRSA in vitro могут быть чувствительными к цефепиму, другим цефалоспоринам или карбапенемам, все b-лактамные антибиотики при инфекциях, вызванных MRSA, следует считать клинически неэффективными и не назначать пациентам. Возможно, единственным исключением является цефтобипрол — антибиотик, зарегистрированный в Украине, однако толком не присутствующий на рынке.
Еще один механизм устойчивости — активное удаление антибиотиков из микробных клеток с помощью насосов — не играет у цефалоспоринов какой-либо значимой роли.
Фармакокинетика
Как и другие парентеральные цефалоспорины, цефепим хорошо всасывается при внутримышечном введении и распределяется во многих органах (кроме предстательной железы), тканях и секретах человеческого организма. Период полувыведения из плазмы крови составляет 2 ч, связывание с белками — 20 %. Наряду с цефотаксимом, цефтриаксоном и цефтазидимом цефепим лучше других цефалоспоринов проникает через гематоэнцефалический барьер. Концентрация антибиотика в цереброспинальной жидкости составляет 10 % от аналогичного показателя в плазме крови. Цефепим почти не метаболизируется в организме, экскретируется преимущественно почками, причем в моче создаются очень высокие концентрации антибиотика.
Нежелательные реакции при применении цефепима встречаются редко. Их спектр и частота существенно не отличаются от таковых у других цефалоспоринов. Вообще антибиотики группы цефалоспоринов всегда отличались хорошей переносимостью.
Цефепим может использоваться при беременности без каких-либо ограничений.
Клиническое использование цефепима
Основными показаниями к применению цефепима являются среднетяжелые и тяжелые внебольничные и нозокомиальные инфекции, зачастую вызванные полирезистентной флорой:
— инфекции нижних дыхательных путей (пневмония, абсцесс легкого, эмпиема плевры);
— осложненные и неосложненные инфекции мочевых путей;
— инфекции кожи и мягких тканей;
— осложненные интраабдоминальные инфекции;
— нейтропеническая лихорадка.
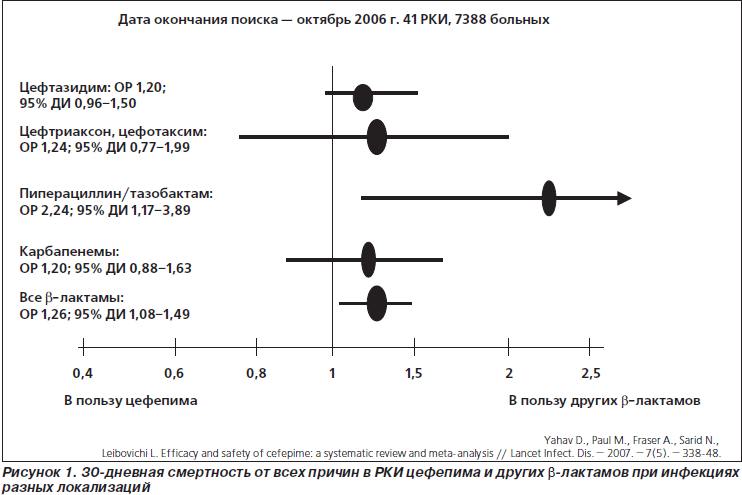
Широкая дискуссия о целесообразности использования цефепима развернулась после публикации в 2006 г. систематического обзора и мета-анализа M. Paul et al. [6], в котором продемонстрировано увеличение смертности больных с нейтропенической лихорадкой при лечении цефепимом по сравнению с терапией другими b-лактамными антибиотиками. Год спустя та же рабочая группа опубликовала новый систематический обзор и мета-анализ [7], в котором авторы установили увеличение смертности больных с инфекциями разных локализаций при лечении цефепимом на 26 % по сравнению с терапией другими b-лактамными антибиотиками (относительный риск (ОР) 1,26; 95% доверительный интервал (ДИ) 1,08–1,49). При этом риск смерти больных с нейтропенической лихорадкой при лечении цефепимом оказался еще выше: ОР 1,42; 95% ДИ 1,09–1,84.
Объективности ради следует указать, что далеко не при всех нозологических формах инфекций и при сравнении не со всеми антибиотиками были получены столь драматические результаты. Например, исходы в исследованиях цефепима у больных с пневмониями, по данным мета-анализа, не столь однозначны, а большая часть 95% ДИ в исследованиях цефепима у больных с интраабдоминальными инфекциями (ИАИ) и инфекциями мочевых путей (ИМП) находится на стороне пользы от антибиотика. При непосредственном сравнении цефепима с другими антибиотиками большая смертность при его использовании установлена только в случаях сравнения с пиперациллином/тазобактамом (рис. 1).
После этой публикации FDA (Американская администрация по контролю качества продуктов питания и лекарственных средств) опубликовала следующее заявление: «FDA сотрудничает с компанией — производителем [оригинального] цефепима, Bristol-Myers Squibb, над оценкой данных о повышении смертности у больных, получавших цефепим… До завершения этой работы медработникам, намеревающимся использовать цефепим, следует быть в курсе пользы и риска, описанных в инструкции по применению препарата, и новых данных, полученных в мета-анализе» [8].
В июне 2009 г. FDA издала финальную версию документа, посвященную анализу исследований цефепима. В нем утверждалось, что «FDA проанализировала исследование [мета-анализ D. Yahav et al. [7]] и произвела дополнительный анализ на основании вновь представленных данных, включая предоставленные компанией Bristol-Myers Squibb. FDA пришла к заключению, что [доступные] данные не указывают на повышенный риск смерти у больных, получавших лечение цефепимом. Цефепим остается адекватным выбором для лечения заболеваний по всем одобренным [ранее] показаниям» [9]. Сжатая версия этого документа вскоре была опубликована в медицинской печати [10].
Тем не менее полемика после публикации этого документа не прекратилась. Основные возражения против выводов экспертов FDA можно суммировать следующим образом.
В действительности мета-анализ FDA указывает на возможное повышение смертности при использовании цефепима на уровне как исследований, так и пациентов. Различия в риске (РР) составляют соответственно 5,38 на 1000 чел. (95% ДИ (–1,53)–12,28) и 4,83 на 1000 чел. (95% ДИ (–4,72)–14,38). Следует иметь в виду, что эксперты FDA измеряли различия в риске при использовании цефепима или антибиотиков сравнения, в то время как D. Yahav et al. определяли отношение рисков. Полученные в мета-анализе FDA различия не достигли статистической значимости, хотя не вызывает сомнений, что большая часть 95% ДИ находится на стороне вреда, то есть повышения смертности при использовании цефепима. На самом деле на основании данных мета-анализа FDA можно заключить, что существует вероятность в 71 %, что риск смерти при использовании цефепима выше, чем при лечении другими антибиотиками [11]. Эта вероятность в мета-анализе D. Yahav et al. составляла 99 % [7].
Наиболее негативные данные получены при анализе результатов клинических исследований у больных с нейтропенической лихорадкой. Согласно данным Yahav et al., ОР смерти таких больных при лечении цефепимом составлял 1,42 (95% ДИ 1,09–1,84); в мета-анализе FDA разница рисков на уровне исследований оказалась равной 9,67 (95% ДИ (–2,87)–22,21), а на уровне пациентов — 18,10 (95% ДИ (–9,22)–45,42). Другими словами, вероятность того, что цефепим повышает смертность у больных с нейтропенической лихорадкой, составляет 90,9 % (мета-анализ FDA на уровне исследований), 80,8 % (мета-анализ FDA на уровне пациентов) и 99,2 % (мета-анализ D. Yahav et al.). Если перевести эти риски в другие показатели, которые обычно используются для оценки исходов, например «количество больных, которое необходимо пролечить для достижения дополнительного негативного эффекта» (NNH), то есть число пациентов с нейтропенической лихорадкой, которых нужно лечить цефепимом для наступления одной избыточной смерти, то получатся следующие параметры: NNH = 54 (согласно мета-анализу D. Yahav et al.), NNH = 109 и NNH = 76 (согласно мета-анализу FDA на уровне исследований и пациентов соответственно). Кроме того, мета-анализ FDA указывает на статистически значимое увеличение смертности при лечении цефепимом больных с инфекциями кожи и мягких тканей, причем на уровне как исследований, так и пациентов: в обоих случаях РР = 17,97 (95% ДИ 3,73–32,21). Это означает 87,5% вероятность того, что лечение цефепимом принесет вред, а NNH = 56 [11]. В своем исследовании D. Yahav et al. не анализировали эту популяцию пациентов. Наконец, независимо от возраста (от 18 лет до старше 65 лет), пола, обнаружения возбудителя при начальном микробиологическом исследовании, метода анализа («по намерению лечиться» и др.) большинство данных о смертности свидетельствуют не в пользу цефепима.
Еще одно возражение сводится к тому, что в мета-анализ, подготовленный FDA, включены 33 «новых» исследования, которые не анализировались в работе D. Yahav et al. (2 клинических исследования (КИ), опубликованных позже, + 4 КИ, в которых либо цефепим сравнивали не только с b-лактамными антибиотиками, либо допускалось добавление других антибиотиков, + 27 неопубликованных КИ) [12], в том числе многие исследования, предоставленные компанией Bristol-Myers Squibb. Детальная характеристика этих исследований отсутствует, не приводятся объяснения, почему они не были опубликованы в рецензируемых журналах (направлялись ли они для публикации или были отвергнуты?). Эксперты FDA не представили данных о качестве включенных в анализ работ, в то время как D. Yahav et al. провели специальный анализ с учетом различного методологического качества включенных в работу исследований. В исследованиях, выполненных на высоком методологическом уровне, согласно данным D. Yahav et al., риск смерти в группе больных, получавших цефепим, был на 52 % выше (ОР 1,52; 95% ДИ 1,20–1,92). Вызывает недоумение и следующее обстоятельство: риск смерти при использовании цефепима, рассчитанный по данным опубликованных и рецензированных исследований, был существенно выше (ОР 1,23; 95% ДИ 1,07–1,42), в то время как тот же риск, рассчитанный по данным неопубликованных исследований, предоставленных в FDA компанией Bristol-Myers Squibb, при лечении цефепимом был статистически значимо ниже (ОР 0,80; 95% ДИ 0,66–0,97). Вероятность «неслучайности» подобных различий < 0,05. Возможными объяснениями могут быть: 1) тенденциозность при направлении спонсором неопубликованных КИ в FDA (отбор и качество самих КИ); 2) истинная случайность (хотя это объяснение представляется весьма маловероятным) [12].
Представленные аргументы производят впечатление. Смущает другое. Критики мета-анализа FDA довольно свободно обращаются с некоторыми цифрами. Так, в работе L. Leibovici et al. [12] указывается, что в мета-анализе D. Yahav et al. [7] проанализированы 55 РКИ, в то время как в окончательный анализ вошло только 41 исследование (рис. 1). В свою очередь, A.C. Kalil [11], утверждающий, что ознакомился с мета-анализом D. Yahav et al. [7], пишет о 50 новых исследованиях, включенных в мета-анализ FDA. Складывается впечатление, что мы читали разные работы. На самом деле их не более 47 (все равно, конечно, много). Тем не менее эти очевидные несоответствия, пропущенные рецензентами уважаемых журналов, заставляют усомниться и в других цифрах.
Каковы бы ни были предполагаемые биологические объяснения увеличения смертности при использовании цефепима, определенно установить причинно-следственные связи не представляется возможным. Достаточно уверенно можно говорить о повышенном риске смерти у больных с нейтропенической лихорадкой и инфекциями кожи и мягких тканей. Однако эти нозологические формы ассоциируются с невысокой, в целом, смертностью. По-видимому, при этих заболеваниях использовать цефепим не следует, тем более что на рынке имеется достаточное количество антибиотиков разных классов для лечения таких пациентов, включая карбапенемы.
Нереалистично надеяться и на проведения нового исследования III фазы для оценки безопасности цефепима. Во-первых, ожидаемое число событий (то есть смертей) в контрольной группе будет невелико, в связи с чем в исследование пришлось бы включать тысячи пациентов. Во-вторых, статистическую мощность такого исследования предстоит рассчитывать, исходя из безопасности, а не эффективности антибиотиков, что приведет к еще большему увеличению числа больных, которых предстоит включить в исследование. Наконец, это мега-исследование будет трудно профинансировать, поскольку сроки патентной защиты цефепима уже истекли. Разумным выходом в данной ситуации представляется сотрудничество между FDA и Европейским агентством по оценке продуктов медицинского назначения с целью анализа доступных баз данных по безопасности лекарств [11].
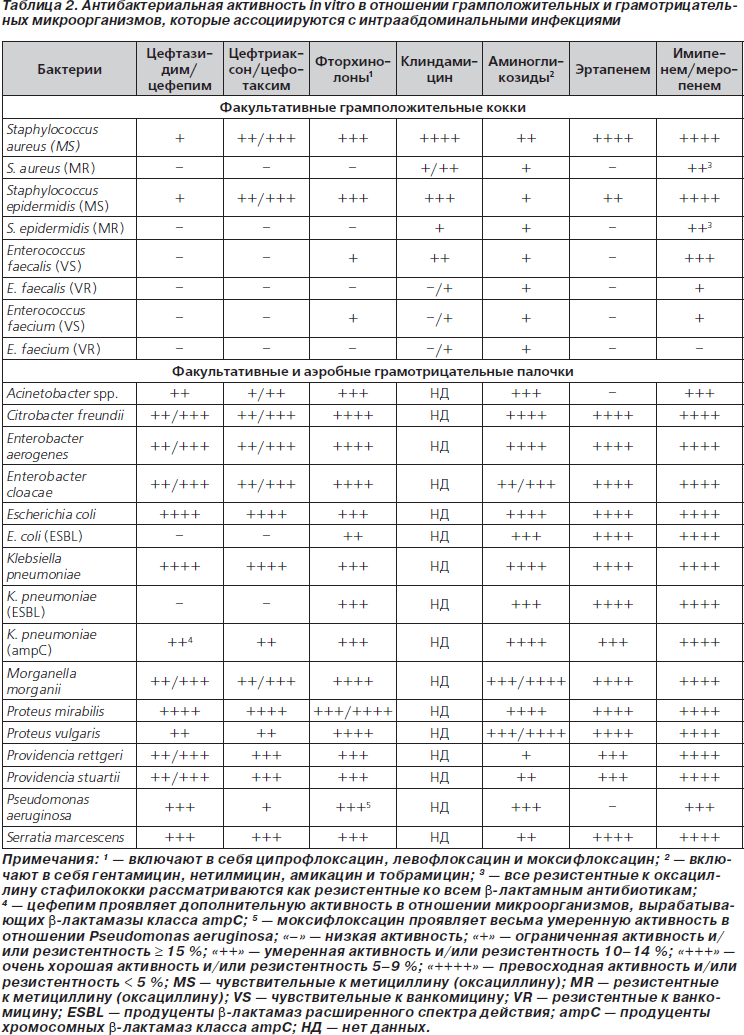
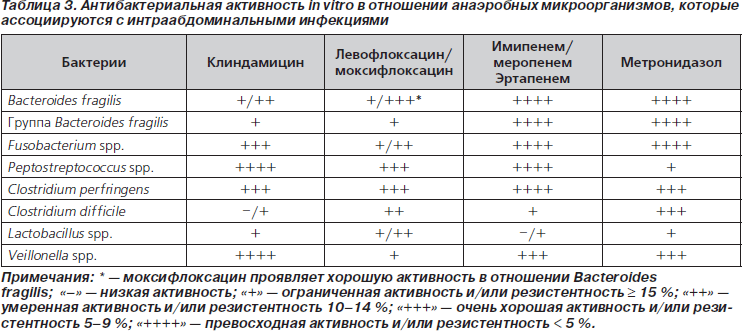
Справедливость подобного заключения можно проиллюстрировать на примере недавних рекомендаций по лечению ИАИ, принятых в США, Канаде и в России. В рекомендациях Общества хирургических инфекций и Общества инфекционных заболеваний Америки по диагностике и лечению осложненных ИАИ цефепим в комбинации с метронидазолом предлагается использовать для стартовой антибактериальной терапии как у взрослых, так и в педиатрической практике [13]. Причем у детей — при любой тяжести заболевания, а у взрослых — при тяжелых ИАИ или в группах высокого риска (у лиц с тяжелыми физиологическими расстройствами, больных старческого возраста или при наличии иммунодефицитов). Канадские эксперты также высказались в поддержку использования комбинации цефепима с метронидазолом [14]. В приложениях к канадским рекомендациям приводятся данные о сравнительной активности антибиотиков разных классов в отношении микроорганизмов — возбудителей ИАИ (табл. 2 (исключены данные по ингибиторозащищенным карбокси- и уреидопенициллинам, гликопептидам и тигециклину) и табл. 3 (исключены данные по цефокситину, ингибиторозащищенным карбокси- и уреидопенициллинам и тигециклину)). Они убедительно обосновывают целесообразность использования комбинации цефепима с метронидазолом для лечения больных с ИАИ. Отсутствие значимой активности цефалоспоринов в отношении энтерококков не должно смущать. До настоящего времени вопрос о необходимости включения антиэнтерококковых препаратов в режимы эмпирической терапии абдоминальных инфекций остается нерешенным. Согласно рекомендациям американских Общества хирургических инфекций и Общества инфекционных заболеваний, включение антиэнтерококковых препаратов в режимы эмпирической терапии легких и среднетяжелых внебольничных ИАИ не обязательно, однако при нозокомиальных и особенно послеоперационных инфекциях, а также в тех случаях, когда пациенты уже получали цефалоспориновые антибиотики, включение антиэнтерококковых препаратов в схемы лечения обосновано [15].
В российских рекомендациях по лечению ИАИ цефепим 4–6 г/сут в комбинации с метронидазолом 1,5 г/сут рассматриваются в качестве препаратов выбора при холангитах на фоне билиодигестивного анастомоза и при вторичных перитонитах вследствие деструкции органов брюшной полости (при наличии факторов риска затяжного течения и неблагоприятного исхода). К последним относятся:
— запоздалое оперативное вмешательство (более 24 ч);
— клинико-лабораторные проявления тяжелого сепсиса с полиорганной недостаточностью;
— тяжесть состояния по шкале АРАСНЕ II > 15 баллов;
— декомпенсированная сопутствующая патология;
— предшествующая антибиотикотерапия (в последние 90 дней перед госпитализацией);
— кровопотеря более 30 % объема циркулирующей крови;
— иммуносупрессивные состояния;
— кахексия;
— злокачественные новообразования [15].
Подведем итоги. FDA подтвердила адекватность использования цефепима по всем ранее одобренным показаниям. Тем не менее представляется разумным воздерживаться от использования цефепима при нейтропенической лихорадке и, по-видимому, при инфекциях кожи и мягких тканей, в то время как этот антибиотик остается действенным средством лечения больных с пневмониями, ИАИ, ИМП и инфекциями других локализаций как в виде монотерапии, так и, при необходимости, в сочетании с другими антибиотиками (например, метронидазолом).
1. Сидоренко С.В. Некоторые проблемы диагностики и этиотропного лечения бактериальных инфекций в интенсивной терапии // Вестник интенсив. тер. — 1998; Антибактериальная терапия. Прил. к журн. — 1–12.
2. Paul M., Soares-Weiser K., Leibovici L. b-lactam monotherapy versus b-lactam-aminoglycoside combination therapy for fever with neutropenia: systematic review and meta-analysis // BMJ. — 2003. — 326. — 1111-5.
3. Paul M., Benuri-Silbiger I., Soares-Weiser K. et al. b-lactam monotherapy versus b-lactam-aminoglycoside combination therapy for sepsis in immunocompetent patients: systematic review and meta-analysis of randomised trials // BMJ. — 2004. — 328. — 668-72.
4. Bliziotis I.A., Samonis G., Vardakas K.Z. et al. Effect of aminoglycoside and b-lactam combination therapy versus b-lactam monotherapy on the emergence of antimicrobial resistance: a meta-analysis of randomized, controlled trials // Clin. Infect. Dis. — 2005. — 41. — 149-58.
5. Gilbert D.N., Moellering R.C., Sande M.A. et al. The Sanford guide to antimicrobial therapy 1999. 29th ed. — Hyde Park (VT): Antimicrobial Therapy, Inc., 1999.
6. Paul M., Yahav D., Fraser A., Leibovici L. Empirical antibiotic monotherapy for febrile neutropenia: systematic review and meta-analysis of randomized controlled trials // J. Antimicrob. Chemother. — 2006. — 57. — 176-89.
7. Yahav D., Paul M., Fraser A. et al. Efficacy and safety of cefepime: a systematic review and meta-analysis // Lancet Infect. Dis. — 2007. — 7. — 338-48.
8. US Food and Drug Administration. Early Communication About an Ongoing Safety Review of Cefepime (Marketed as Maxipime) 06/18/2009. http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm070496.htm (дата последнего обращения 22.12.2010).
9. US Food and Drug Administration Center for Drug Evaluation and Research. Statistical Review and Evaluation. Clinical Studies NDA Number 50-679. Drug Name: Maxipime 04/22/2009. http://www.fda.gov/downloads/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInfomationforHealthcareProfessionals/UCM167309.htm (дата последнего обращения 22.12.2010).
10. Kim P.W., Wu Y.T., Cooper C. et al. Meta-analysis of a possible signal of increased mortality associated with cefepime use // Clin. Infect. Dis. — 2010. — 51. — 381-9.
11. Kalil A.C. Is cefepime safe for clinical use? A Bayesian viewpoint // J. Antimicrob. Chemother. — 2011. — 66. — 1207-1209.
12. Leibovici L., Yahav D., Paul M. Excess mortality related to cefepime // Lancet Infect. Dis. — 2010. — 10(5). — 293-294.
13. Solomkin J.S., Mazuski J.E., Bradley J.S. et al. Diagnosis and management of complicated intra-abdominal infection in adults and children: guidelines by the Surgical Infection Society and the Infectious Diseases Society of America // Clin. Infect. Dis. — 2010. — 50. — 133-64.
14. AMMI Canada guidelines. Canadian practice guidelines for surgical intra-abdominal infections // Can. J. Infect. Dis. Med. Microbiol. — 2010. — 21(1). — 11-37.
15. Савельев В.С., Гельфанд Б.Р. и редакционный совет. Абдоминальная хирургическая инфекция. Российские национальные рекомендации. — М., 2011. — 99 с.