Международный эндокринологический журнал 6 (38) 2011
Вернуться к номеру
Взаємозв’язки між структурно-функціональними порушеннями щитоподібної залози і компонентами метаболічного синдрому
Авторы: Паньків В.І.1, Гаврилюк В.М.2, Непорадна Л.Д.2, Попович Л.В.2, Яковина В.В.2, Івасів В.М.2, Дідушко О.М.3, Коритко О.О.4, Глуговська С.В.5, 1 Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України 2 Івано-Франківська обласна клінічна лікарня 3 Івано-Франківський національний медичний університет 4 Львівський національний медичний університет імені Данила Галицького 5 Чернівецький обласний клінічний ендокринологічний центр
Рубрики: Эндокринология
Версия для печати
Вступ
Захворювання щитоподібної залози (ЩЗ) за своєю поширеністю посідають перше місце серед ендокринної патології [1]. Згідно з результатами епідеміологічних досліджень, поширеність гіпотиреозу у жінок становить від 4 до 21 % і в чоловіків — від 3 до 16 % [2, 3]. У жінок субклінічний гіпотиреоз трапляється в 2–2,5 раза частіше, ніж у чоловіків. У старшій віковій групі поширеність субклінічного гіпотиреозу досягає 10–16 % [4]. Поширеність субклінічного тиреотоксикозу, за даними різних досліджень, становить 0,6–3,9 %, залежно від чутливості методу, що використовувався для визначення рівня тиреотропного гормону (ТТГ), і йодного забезпечення регіону [5]. Поширеність синдрому тиреотоксикозу в загальній популяції також відносно висока і досягає 1–2 % [6].
Епідеміологічні роботи, що вивчають структуру тиреоїдної патології у дорослих, становлять великий науковий і практичний інтерес. Порівняння результатів епідеміологічних досліджень дозволяє розкрити закономірності розвитку і прогресування більшості захворювань ЩЗ і виявити їх взаємозв’язок з іншою соматичною патологією.
Опубліковані на сьогодні дослідження, що оцінюють поширеність тиреоїдної патології у дорослого населення, значно відрізняються за дизайном. У такі роботи включалися як репрезентативні вибірки, так і клінічні групи, наприклад пацієнти, госпіталізовані в спеціалізований стаціонар [7]. У зв’язку з цим у літературі наведені різні дані щодо поширеності патології ЩЗ, що визначає актуальність епідеміологічних досліджень.
Поширеність окремих компонентів метаболічного синдрому (МС) у всьому світі становить 25–35 % [8]. Взаємозв’язок різних складових МС і функції ЩЗ неоднозначний. З одного боку, є численні дослідження, що підтверджують взаємозв’язок гіпотиреозу з артеріальною гіпертензією (АГ), ІХС і порушеннями ліпідного обміну, з іншого — порушення вуглеводного обміну і гіперсимпатикотонія тісно корелюють з гіпертиреозом [9, 10]. При цьому інсулінорезистентність спостерігається як при гіпо-, так і при гіпертиреозі [11]. З огляду на високу поширеність патології ЩЗ і МС в популяції вивчення взаємозв’язку цих розладів з метою поліпшення діагностики і лікування є актуальним.
Мета дослідження — вивчити поширеність структурно-функціональних порушень щитоподібної залози у дорослого міського населення Прикарпаття та їх взаємозв’язки з основними компонентами метаболічного синдрому.
Матеріали і методи дослідження
Обстежено 354 особи (175 жінок і 179 чоловіків) віком від 45 до 69 років з ознаками МС, які не перебували під диспансерним наглядом у лікарів з приводу патології ЩЗ. Контрольну групу становили 114 осіб аналогічного віку без ознак МС і без патології ЩЗ в анамнезі.
Середній вік чоловіків — 57,4 ± 0,6 року, жінок — 54,8 ± 0,4 року. Протокол дослідження включав: анкетування, збір анамнезу, клінічний огляд, пальпацію ЩЗ. В обстежуваних реєструвалася наявність захворювань ЩЗ в анамнезі, патологія ЩЗ у родичів. Пальпаторно-візуальна оцінка розмірів ЩЗ (за класифікацією ВООЗ, 2001) використовувалася як скринінговий метод.
Визначення рівнів ТТГ (межі нормальних значень 0,16–4,05 мОд/л), загального тироксину (межі нормальних значень 60–160 нмоль/л) проводили радіоімунологічним методом із використанням стандартних наборів виробництва фірми Immunotech (Чехія).
Ультразвукове дослідження (УЗД) ЩЗ здійснювали за допомогою апарату Logiq-100 з використанням лінійного датчика 7,5 мГц. За даними УЗД у поняття «вогнищева патологія» включали фокальні зміни структури ЩЗ (діаметр утворення менше за 1 см) і вузлову патологію (діаметр утворення понад 1 см).
Визначення вмісту загального холестерину (ЗХС), тригліцеридів (ТГ), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) здійснювали з використанням стандартних реактивів. Рівень холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) розраховували за формулою Фридвальда при концентрації ТГ, що не перевищує 4,5 ммоль/л: ХС ЛПНЩ = ХС – (ХС ЛПВЩ + + (ТГ/5), мг/дл (D.S. Friedwald, 1972). Використані ко-ефіцієнти атерогенності: ЗХС/ХС ЛПВЩ; ЗХС — ХС ЛПВЩ/ХС ЛПВЩ; ХС ЛПНЩ/ХС ЛПВЩ.
За абдомінальне ожиріння вважали значення обсягу талії (ОТ) понад 102 см у чоловіків і понад 88 см у жінок згідно з визначенням NCEP ATP III (2004). Критерії МС за рекомендаціями NCEP ATP III (2004): 3 і більше з нижчезазначених критеріїв: ОТ > 102 см у чоловіків і > 88 см у жінок, рівень ТГ > 1,7 ммоль/л, ХС ЛПВЩ < 1,0 ммоль/л у чоловіків і < 1,3 ммоль/л у жінок, артеріальний тиск (АТ) > 130/85 мм рт.cт., глюкоза плазми > 6,1 ммоль/л.
Статистичну обробку отриманих результатів, що включала створення бази даних і статистичний аналіз, проведено за допомогою пакета SPSS (V. 13,0). Вірогідність відмінностей оцінювали за критерієм Стьюдента (t), Пірсона (для нормального розподілу ознак). За наявності розподілу, відмінного від нормального, використовувався непараметричний метод — тест Манна — Уїтні для двох незалежних виборок. Отримані дані в таблицях і тексті наведені як відносні величини (%), а також як (М ± m), де М — середнє арифметичне значення, m — стандартна помилка середньої, Ме [25; 75] (Ме — медіана; 25 і 75 — 1-й і 3-й квартилі). Відмінності розглядали як статистично вірогідні при р < 0,05.
Результати дослідження та їх обговорення
При визначенні функціонального стану ЩЗ встановлено, що середній рівень ТТГ в осіб обох статей дорівнював 1,9 ± 0,3 мОд/л. Встановлені вірогідні гендерні відмінності значень ТТГ у чоловіків — 1,5 ± 0,2 мОд/л, у жінок — 2,3 ± 0,3 мОд/л (p < 0,05). В обстеженій вибірці середній показник Т4 становив 94,6 ± 1,3 нмоль/л, і не відрізнявся у чоловіків (91,7 ± 1,4 нмоль/л) і у жінок (97,2 ± 1,3 нмоль/л).
У великому дослідженні NHANES III, проведеному в США, показано, що в загальній популяції дорослих референсний рівень (інтервал середніх показників, визначений у 95 % тестованих) ТТГ перебуває в межах 0,45–4,12 мОд/л (2,5 і 97,5 перцентиля). У ділянку референсних значень не включаються дуже високі показники результатів аналізів у 2,5 % здорових пацієнтів і низькі показники в інших 2,5 %.
Для визначення референсних значень показників рівня ТТГ у нашому дослідженні було відібрано 126 осіб без дифузної і вогнищевої патології ЩЗ, без наявності в анамнезі оперативних втручань і замісної гормональної терапії. За отриманими даними, 2,5 і 97,5 перцентиля рівня ТТГ в осіб без структурної патології ЩЗ становлять 0,37 і 3,21 мОд/л. Отже, в популяційній вибірці дорослих мешканців Прикарпаття (45–69 років) референсний рівень ТТГ становить 0,37–3,21 мОд/л.
При обстеженні 354 осіб із МС встановлено гіпотиреоз у 21 (5,9 %), у тому числі субклінічний гіпотиреоз — у 18 (5,1 %). Співвідношення чоловіків і жінок, у яких діагностовано субклінічний гіпотиреоз, становить 1 : 4. Серед чоловіків частка вперше виявленого субклінічного гіпотиреозу досягла 3,9 % (7 осіб), серед жінок — 6,3 % (11 осіб). Отримані дані про поширеність гіпотиреозу у жінок і чоловіків характерні для жителів, які проживають за умов легкого йодного дефіциту. Ці дані збігаються з даними інших дослідників і свідчать про те, що загальна поширеність субклінічного гіпотиреозу досягає 7–10 % серед жінок і 2–3 % серед чоловіків [3]. У 4 осіб (1,1 %) діагностовано субклінічний гіпертиреоз (у чоловіків — 0,6 %, у жінок — 1,7 % від усіх обстежених). Отже, частота вперше виявлених функціональних порушень ЩЗ в осіб із МС становить 7,1 %. У 92,9 % обстежених функціональний стан ЩЗ не порушений.
Нами встановлено частоту дифузної і вогнищевої патології ЩЗ у чоловіків і жінок віком 45–69 років за даними пальпаторного та ультразвукового обстеження. Поширеність дифузного збільшення ЩЗ серед осіб із МС (354 особи) становила 16,1 % (57 осіб), при цьому зоб 1-го ступеня встановлено у 15,5 % (55 осіб), зоб 2-го ступеня — у 0,6 % (2 особи). Серед чоловіків з МС частота дифузного нетоксичного зоба досягала 8,9 % (16 осіб), серед жінок — 23,4 % (41 особа). Вузловий зоб методом пальпації діагностовано у 3,9 % (14 осіб), у тому числі: у чоловіків — в 1,1 %, у жінок — у 6,9 % .
Отримані нами рівні поширеності дифузного нетоксичного зоба можна порівняти з даними інших дослідників, згідно з якими його частота становить 10–20 % серед міського населення, що проживає в йододефіцитних регіонах [2].
За даними УЗД ЩЗ поширеність вогнищевої патології становила 12,7 % (45 осіб), у тому числі вузлової патології — 5,1 % (18 осіб), фокальних змін — 7,6 % (27 осіб). З огляду на дані пальпації частота вузлової патології становила 3,9 % (14 осіб), а за результатами УЗД — 12,7 % (45 осіб), виявлення вузлової патології візуально-пальпаторним методом становить лише 31,1 % від усіх випадків, виявлених за допомогою УЗД (р < 0,001).
Серед чоловіків і жінок віком 45–69 років у 18 осіб з вузловою патологією середній рівень ТТГ становив 1,4 ± 0,3 мОд/л. Визначені 2,5 і 97,5 перцентиля рівня ТТГ показали такі результати: 0,18 і 5,3 мОд/л. Як бачимо, показники ТТГ виходять за межі нормальних значень, що свідчить про функціональну нестабільність ЩЗ за наявності в ній вузлової патології.
У вибірці чоловіків і жінок без функціональної патології ЩЗ (329 осіб) проаналізована частота вогнищевої патології в крайніх квартилях об’єму ЩЗ. У чоловіків середній об’єм ЩЗ дорівнював 17,2 см3, частота вогнищевої патології — 8,9 %, у тому числі: фокальної патології — 5,6 %, вузлової патології — 3,3 %.
У жінок середній об’єм ЩЗ становив 14,9 см3, частота вогнищевої патології — 16,6 %, у тому числі: фокальної патології — 9,7 %, вузлової — 6,9 %. Як у чоловіків, так і в жінок зі збільшенням об’єму ЩЗ зростає частота її вузлової патології. Частота непальпованих утворень розміром до 1 см однаково часто виявляється при ультразвуковому обстеженні ЩЗ як при незбільшених розмірах органа, так і при його збільшенні.
Нами здійснено порівняльний аналіз показників ТТГ, Т4 в осіб віком 45–69 років за наявності та відсутності ознак МС. Серед 354 обстежених із МС рівні ТТГ вищі, ніж у 114 чоловіків і жінок без МС.
Дані про взаємозв’язок тиреоїдної функції з компонентами МС в осіб без порушень функціонального стану ЩЗ нечисленні і неоднозначні, але більшість дослідників описують опосередковану дію через такі компоненти, як абдомінальне ожиріння, ліпіди крові (ТГ, ЗХС, ХС ЛПВЩ) і АТ [12], виключаючи прямий вплив ТТГ на інсулінорезистентність.
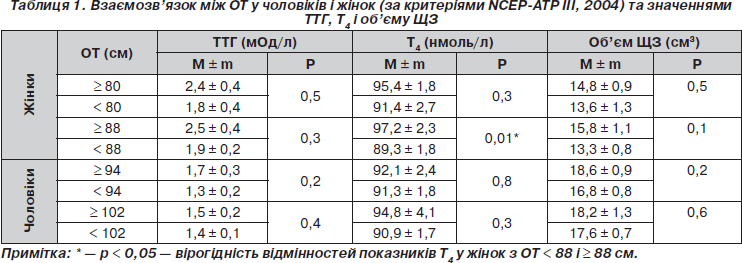
Обсяг талії є важливим компонентом МС як клінічний маркер інсулінорезистентності. При оцінці показників ТТГ, Т4 і об’єму ЩЗ при різних значеннях ОТ виявлені гендерні відмінності (табл. 1).
У чоловіків при будь-яких значеннях ОТ середні показники ТТГ, Т4 і об’єму ЩЗ вірогідно не відрізнялися. У групі жінок з абдомінальним ожирінням при значеннях ОТ ≥ 88 см показники Т4 вірогідно вищі, ніж при ОТ < 88 см (р = 0,01). У жінок встановлений вірогідний позитивний кореляційний зв’язок між ОТ і Т4 (r = 0,172; р < 0,05), у чоловіків такого зв’язку не спостерігалося. Отримано позитивний кореляційний зв’язок між тиреоїдним об’ємом і ОТ у жінок (r = 0,256; р < 0,01).
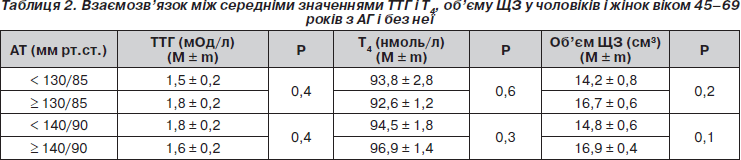
Нами оцінено показники ТТГ, Т4, об’єму ЩЗ за наявності АГ. Середні значення ТТГ, Т4 і об’єму ЩЗ в осіб з АГ і без неї не мали вірогідних відмінностей (табл. 2).
За даними кореляційного аналізу між рівнем ТТГ і показниками систолічного і діастолічного АТ (r = 0,038; р > 0,05) взаємозв’язок не виявлений. Відсутність кореляційного зв’язку між рівнем ТТГ і рівнями АТ, очевидно, обумовлена переважно еутиреоїдним (92,9 %) станом більшості обстежених.
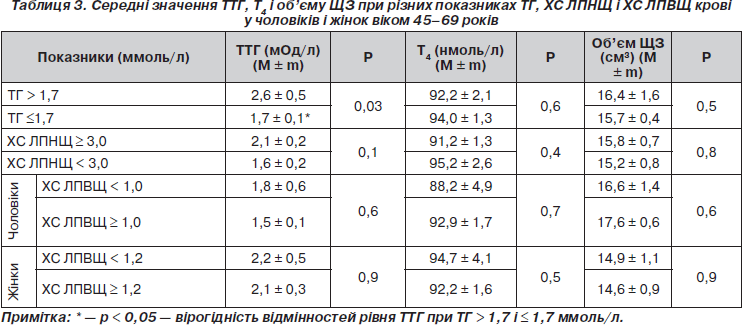
Проаналізовані показники ТТГ, Т4, об’єму ЩЗ залежно від рівнів ТГ, ХС ЛПНЩ і ХС ЛПВЩ. При рівнях ТГ > 1,7 ммоль/л вміст ТТГ у крові в середньому становив 2,6 ± 0,5 мОд/л, що вірогідно вище, ніж серед осіб при рівнях ТГ ≤ 1,7 ммоль/л: 1,5 ± 0,1 мОд/л (р < 0,05). Показники Т4 і об’єму ЩЗ істотно не відрізнялися в підгрупах з різними рівнями ТГ (табл. 3). Показники ТТГ, Т4, об’єму ЩЗ у чоловіків і жінок не мали вірогідних відмінностей у підгрупах з різними рівнями ХС ЛПНЩ і ХС ЛПВЩ.
При аналізі середніх значень ТТГ, Т4 і показників ЗХС встановлено, що рівень ТТГ в осіб із значеннями ЗХС ≥ 6,0 ммоль/л вищий, ніж в обстежених з рівнем ЗХС < 5,0 ммоль/л (р < 0,05). Рівень Т4 у групі обстежених з високими значеннями ЗХС (≥ 6,0 ммоль/л) вірогідно нижчий, ніж при показниках ЗХС < 5,0 ммоль/л (табл. 4).
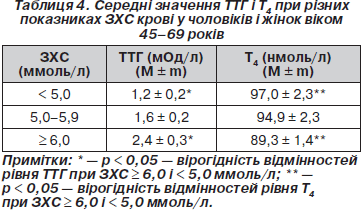
При проведенні кореляційного аналізу отримано вірогідний слабкий позитивний зв’язок між рівнем ЗХС і ТТГ (r = 0,13; р < 0,05), ХС ЛПНЩ і ТТГ (r = 0,12; р < 0,05). Виявлений вірогідний слабкий негативний зв’язок між ХС ЛПВЩ і Т4 (r = –0,151; p < 0,05). Не виявлено кореляційного зв’язку між рівнем ТГ і показниками ТТГ і Т4. При стандартизації показників ТТГ за віком зберігається позитивний кореляційний зв’язок між ЗХС і ТТГ (r = 0,14; р < 0,05), ХС ЛПНЩ і ТТГ (r = 0,136; р < 0,05).
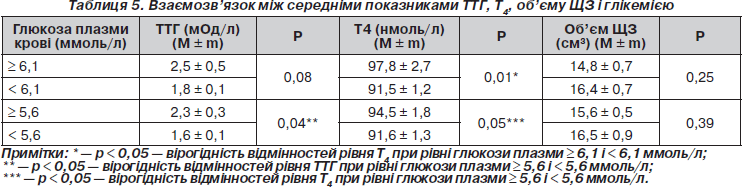
Оцінено показники ТТГ, Т4 і об’єму ЩЗ при різних рівнях глікемії за критеріями МС. За наявності підвищеного рівня глікемії показники ТТГ вірогідно вищі, ніж у групі з нормальними показниками (р < 0,05). Показники Т4 вірогідно вищі в підгрупах із підвищеними значеннями глюкози плазми крові (р < 0,05). Об’єм ЩЗ в обох групах не мав вірогідних відмінностей (табл. 5).
У літературі тривають дискусії про визначення верхньої межі нормальних значень для ТТГ у популяції. У загальній популяції у 70–80 % осіб рівень ТТГ перебуває в діапазоні 0,3–2,0 мОд/л [13]. Рекомендації Національної академії клінічної біохімії США пропонують звузити норматив для рівня ТТГ до 0,4–2,5 мОд/л. Одним із аргументів для цього стали результати дослідження NHANES III, в якому показано, що рівень ТТГ 2,5– 5,0 мOд/л визначається тільки у 5 % популяції [14].
Тому нами було розподілено обстежених на дві підгрупи: з ТТГ ≥ 2,5 мОд/л і ТТГ < 2,5 мОд/л. Між показниками АТ, ОТ і глікемії не отримано вірогідних відмінностей у цих підгрупах. Однак у показниках ліпідного спектра крові спостерігалися статистично вірогідні відмінності між умістом ТГ, ЗХС і ХС ЛПНЩ.
Для визначення високонормального рівня ТТГ, при якому, можливо, відбуваються зміни метаболічних параметрів у бік субклінічного гіпотиреозу, ми проаналізували квінтилі розподілу рівнів ТТГ в обстежених осіб. Середній рівень ОТ у крайніх квінтилях ТТГ не мав вірогідних відмінностей і становив: у 1-му 92,7 ± 1,5 см, у 5-му — 92,7 ± 1,8 см (р > 0,05). Рівень глюкози плазми крові при високонормальних показниках ТТГ у середньо- му досягав 6,2 ± 0,2 ммоль/л, у групі з низьконормальним рівнем — 5,9 ± 0,2 ммоль/л, але без статистичної вірогідності (р > 0,05). У значеннях систолічного і діастолічного АТ між 1-м і 5-м квінтилями ТТГ вірогідних відмінностей також не отримано. Однак встановлено виражені зміни в ліпідному профілі. Так, середні показники ЗХС, ХС ЛПНЩ, ТГ, індекси атерогенності в 5-му квінтилі були вірогідно вищими порівняно зі значеннями в другому квінтилі (р < 0,05).
Лише при виділенні крайньої 5-ї квінтильної групи зі значеннями ТТГ у діапазоні до 4,05 мОд/л виявлені особливості, які можна вважати за ранні клініко-функціональні метаболічні зміни (підвищені рівні ТГ, ЗХС і ХС ЛПНЩ) і розглядати як початкові ознаки формування субклінічного гіпотиреозу.
Отже, при високонормальних значеннях ТТГ у діапазоні від 2,5 до 4,05 мОд/л ліпідний спектр крові характеризується вищими значеннями ТГ, ЗХС, ХС ЛПНЩ порівняно з обстеженими з нижчим рівнем ТТГ у крові. Тому слід розглянути доцільність зниження параметрів ТТГ при оцінці функції ЩЗ у дорослих людей, можливо, до 2,5 мОд/л. Ми усвідомлюємо той факт, що для цього потрібне проведення великомасштабних популяційних досліджень.
Висновки
1. За результатами обстеження дорослого (віком від 45 до 69 років) населення Прикарпаття, поширеність дифузного нетоксичного зоба становить 16,1 %. Згідно з даними УЗД ЩЗ, поширеність вогнищевої патології досягає 12,7 % (45 осіб), у тому числі: вузлової патології — 5,1 % (18 осіб) і фокальних змін — 7,6 % (27 осіб).
2. Референсні значення рівня ТТГ у популяційній вибірці знаходяться в діапазоні 0,4–3,5 мОд/л. Поширеність синдрому гіпотиреозу в чоловіків і жінок віком 45–69 років становить 5,9 %, тиреотоксикозу — 1,1 %.
3. За наявності окремих компонентів метаболічного синдрому (вміст глюкози плазми крові ≥ 5,6 ммоль/л або ТГ > 1,7 ммоль/л) рівень ТТГ вірогідно вищий, ніж серед обстежених, які мають нижчі значення цих показників.
4. При високонормальних значеннях ТТГ у діапазоні 2,5–4,05 мОд/л ліпідний спектр крові характеризується вищими значеннями ТГ, ОХС, ХС ЛПНЩ порівняно з обстеженими з низьконормальним рівнем ТТГ (від 0,17 до 2,5 мОд/л).
5. В осіб з ознаками метаболічного синдрому за критеріями NCEP-АТР III (2004) середній рівень ТТГ вищий, ніж у людей того ж віку за відсутності метаболічного синдрому.
1. Ларін О.С., Паньків В.І., Селіваненко М.І., Грачова О.О. Аналіз діяльності ендокринологічної служби України у 2010 році та перспективи розвитку медичної допомоги хворим з ендокринною патологією // Міжнародний ендокринологічний журнал. — 2011. — № 3(35). — С. 10-18.
2. Canaris G.J., Manowitz N.R., Mayor G. et al. The Colorado thyroid disease prevalence study // Arch. Intern. Med. — 2000. — Vol. 160. — P. 526-533.
3. Empson M., Flood V., Ma G. et al. Prevalence of thyroid disease in an older Australian population // Intern. Med. J. — 2007. — Vol. 37, № 7. — P. 448-455.
4. Surks M.I., Ortiz E., Daniels G.H. et al. Subclinical thyroid disease: scientific review and guidelines for diagnosis and management // JAMA. — 2004. — Vol. 291, № 2. — P. 228-238.
5. Helfand M. Screening for subclinical thyroid dysfunction in nonpregnant adults: a summary of the evidence for the U.S. Preventive Services Task Force // Ann. Intern. Med. — 2004. — Vol. 140, № 2. — P. 128-141.
6. Song T.J., Kim S.J., Kim G.S. et al. The prevalence of thyrotoxicosis-related seizures // Thyroid. — 2010. — Vol. 20, № 9. — P. 955-958.
7. Gamboa-Domнnguez A., Lino-Silva S., Candanedo-Gonzбlez F. et al. Trends of thyroid pathology in a referral center: steady prevalence of papillary thyroid carcinoma but goiter increase in thyroidectomies // Rev. Invest. Clin. — 2011. — Vol. 63, № 2. — P. 148-154.
8. Day C. Metabolic syndrome, or What you will: definitions and epidemiology // Diab. Vasc. Dis. Res. — 2007. — Vol. 4, № 1. — P. 32-38.
9. Паньків В.І. Особливості перебігу гіпотиреозу у поєднанні з ішемічною хворобою серця // Практична ангіологія. — 2009. — № 9–10(28–29). — С. 52-56.
10. Макар Р.Д., Сандурська М.В. Гіпотиреоз: концептуальні аспекти крізь призму часу // Міжнародний ендокринологічний журнал. — 2009. — № 1(19). — С. 124-131.
11. Фадеев В.В. Актуальные проблемы диагностики и лечения гипотиреоза // Врач. — 2005. — № 3. — С. 63-64.
12. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Фундаментальная и клиническая тиреоидология (руководство). — М.: Медицина, 2007. — 816 с.
13. Nanderpump M.P.J., Tunbridge W.M.G., French J.M. et al. The incidence of thyroid disorders in the community — A twenty-year follow-up of the Whickham survey // Clinical Endocrinology. — 1995. — Vol. 43. — P. 55-69.
14. Belin R.M., Astor B.C., Powe N.R., Ladenson P.W. Smoke exposure is associated with a lower prevalence of serum thyroid autoantibodies and thyrotropin concentration elevation and a higher prevalence of mild thyrotropin concentration suppression in the third National Health and Nutrition Examination Survey (NHANES III) // J. Clin. Endocrinol. Metab. — 2004. — Vol. 89, № 12. — P. 6077-6086.