Журнал «Травма» Том 9, №4, 2008
Вернуться к номеру
Особенности показателей воспаления в крови шахтеров с реактивным артритом
Авторы: И.Ю. Чибисова, О.В. Синяченко - Донецкий национальный медицинский университет им. М.Горького, Донецк, Украина
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Особенностью патогенетических построений при хламидийном реактивном артрите у шахтеров являются большие уровни в крови нитритемии, интерлейкинов 1 и 4, уменьшение параметров иммуноглобулинов G и A, простагландина F2 и циклического гуанозинмонофосфата согласно увеличению продолжительности заболевания, влияние тяжести патологии урогениталий на состояние интегрального воспалительного ответа, участие иммунных нарушений, метаболизма арахидоновой кислоты и оксида азота в развитии поражений крестцово-подвздошных сочленений, периартикулярных тканей, позвоночника, кожи и периферической нервной системы, что зависит от горногеологических условий шахт.
Особливістю патогенетичних побудов при хламідійному реактивному артриті у шахтарів є великі рівні в крові нітритемії, інтерлейкінів 1 і 4, зменшення параметрів імуноглобулінів G та А, простагландину F2 і циклічного гуанозинмонофосфату відповідно до збільшення довготривалості захворювання, вплив тяжкості патології урогеніталій на стан інтегральної запальної відповіді, участь імунних порушень, метаболізму арахідонової кислоти та оксиду азоту у розвитку уражень крижово-клубових зчленувань, періартикулярних тканин, хребта, шкіри й периферичної нервової системи, що залежить від гірничогеологічних умов шахт.
Chlamidian reactive arthritis at miners has pathogenic peculiarities - high level of nitritemia, IL1 and IL4, IgG and IgA level, PgF2 and cGMF level decrease according to disease duration. Also pathology seriousness influence to an integral inflammation answers, immunal dysfunction and arahidonic acid participation metabolism participation in sacroiliacs joints dysfunction, damage of periarticulas tissues, spine, skin and nervous system. These all depends on mine and geological conditions.
реактивный артрит, шахтеры, кровь, воспалительный ответ
реактивний артрит, шахтарі, кров, запальна відповідь
reactive artritis, miners, blood
В настоящее время распространенность хламидийассоциированного реактивного артрита (РеА) составляет 30-40 человек на 100 тыс. взрослого населения [21], а по данным специальных эпидемиологических исследований частота заболевания в мужской популяции еще выше [13]. Помимо периферического артрита нередко развиваются сакроилеит, тендовагиниты, энтезопатии, спондилопатии и висцеральные изменения, что отрицательно сказывается на стойкую трудоспособность людей [1, 4, 8], которая констатируется почти у 15% больных [2], остается очень высоким уровень временной нетрудоспособности рабочих промышленных предприятий [24]. Неблагоприятная окружающая среда относится к провоцирующим факторам течения РеА [3]. Распространенность РеА среди шахтеров превышает таковую в популяции мужчин того же региона Украины в 36 раз (!), а интегральный коэффициент заболеваемости прямо коррелирует с глубиной разработок угля, мощностью и углом наклона угольных пластов [5,7]. Микротравматизация и большие статико-динамические нагрузки на опорно-двигательный аппарат у горнорабочих-угольщиков способствуют развитию профессионального остеоартроза и изменению характера других заболеваний суставов [6,9,11,12].
Как известно, Chlamydia trachomatis способна повышать уровень в крови IgG, IgМ и ЦИК, способствуя дальнейшей персистенции хламидийной инфекции и развитию осложнений РеА [17, 26]. На дисбаланс цитокиновой сети при РеА (содержание в крови концентраций IL1, IL2, IL6, IL10, TNF, γ-интерферонa) указывают E.Bressan et al. [10], S.Jarmalaite et al. [15], N.G.Kiknadze et al. [16], A.Kuuliala et al. [19], S.Pavy et al. [20]. Особенности патогенетических построений при РеА у шахтеров в настоящее время не изучены, не выяснено влияние на характер воспалительного ответа профессий горняков и горногеологических условий трудовой деятельности в шахтах. Это и стало целью и задачами данного исследования.
Материал и методы
Под наблюдением находились 93 мужчины рабочих профессий, страдающие РеА, которые были распределенны на две группы. 1-ю (основную) составили 36 (38,7%) шахтеров-угольщиков, а 2-ю (контрольную) – 57 (61,3%) металлургов, коксохимиков, машиностроителей и домостроителей. Из числа обследованных шахтеров подземных горнорабочих было 36,1%, горнорабочих очистных забоев – 22,2%, проходчиков – 13,9%, крепильщиков – 11,1% и подземных электрослесарей – 16,7%. Средний возраст больных РеА составил 34,8±1,13 года (35,5±1,85 года в основной группе и 34,4±1,43 года в контрольной), длительность заболевания – 4,8±0,59 года (соответственно в 1-й и 2-й группах 4,8±1,14 года и 4,7±0,65 года).
I степень активности заболевания констатирована в 32,3% наблюдений, II – в 32,3%, III – в 35,5%. У больных нешахтеров активность патологического процесса была более высокой (p=0,005). Значения суставного счета среди всех пациентов составили 11,3±1,16, индекса Ричи – 18,5±1,64, индекса Лансбури – 74,7±4,45. Сакроилеит установлен в 37,6% наблюдений, тендовагиниты – в 41,9%, энтезопатии – в 16,1%, спондилопатии (спондилоартроз, остеохондроз) – в 44,1%, поражение урогениталий на момент обследования (уретрит, простатит, цирцинарный и ксеротический баланит, кольцевидный баланопостит) – в 88,2%, глаз (конъюнктивит, увеит) – в 40,0%, кожи и ее придатков (псориазоподобная сыпь, кератодермия ладоней и подошв, ониходистрофия) – в 8,6%, сердца (миокардит, миокардиодистрофия, аортальные и митральные пороки сердца) – в 50,0%, почек (гломерулонефрит, пиелонефрит, интерстициальный нефрит) – в 25,8%, периферической нервной системы (ПНС) – в 16,1%. Признаки вегетососудистой дистонии отмечены в 9,7% случаев, причем симпатический тип вегетативной нервной системы установлен у 32,3% больных, а парасимпатический – у 36,6%.
Всем больным проводили бактериоскопическое исследование мазков из уретры и сока предстательной железы. Кроме того, определяли уровень антител к хламидиям, ДНК хламидий иммуноферментным методом (тест-системы Cleaview Chlamydia Unipath Ltd, Великобритания и Immuno-Comb Chlamydia trachomatis IgG) и методом полимеразной цепной реакции (ридер PR2100 Sanofi diagnostic pasteur, Франция). Рентгенологическое исследование суставов осуществляли с помощью аппарата Multix-Compact-Siеmens (Германия), ультразвуковое – Envisor-Philips (Голландия), электрокардиографическое – Fukuda Denshi Cardimax-FX326 (Япония), эхокардиографическое – SSA-270A-Toshiba (Япония).
Для оценки характера воспалительного ответа определяли в крови показатели иммуноглобулинов (Ig) A, M, G и циркулирующих иммунных комплексов (ЦИК), применяя анализаторы Cone-Progress (Финляндия) и Vitalab-Flexor (Нидерланды). Состояние метаболизма оксида азота (NO) оценивали по концентрации нитритов (NO2) в сыворотке с помощью реактива Грейса (использовали спектрофотометр СФ-46, Россия, при длине волны l=540 нм). Уровни в сыворотке крови простагландинов (Pg) E2 (PgE2) и PgF2a (PgF2), интерлейкина (IL) 1b (IL1), IL4, туморонекротического фактора (TNF) a и циклического гуанозинмонофосфата (GMP), являющегося вторичным мессенджером NO, определяли иммуноферментным методом (ридер PR2100 Sanofi diagnostic pasteur, Франция, наборы Amercham pharmacia biotech, Великобритания и ProCon, Россия). Иммуноферментным методом исследовали содержание в сыворотке крови С-реактивного белка (СРБ) и в цитратной плазме фибриногена (ФГ), применяя наборы Bio Systems (Испания) и реагент Roche (Германия).
Горногеологические условия шахт (глубина разработок угля, температура в шахте, влажность и запыленность воздуха, скорость его движения, мощность и угол наклона угольных пластов, величина водопритоков) были нам предоставлены Донецким угольным институтом, производственными объединениями Донецкуголь и Макеевуголь. Степень нагрузки на коленные суставы (Н, кН) высчитывали по формуле: Н = (22464 ´ W) + (21 ´ L) – (10564 ´ W2) – 7874, где W – мощность угольных пластов (метры), L – угол наклона угольных пластов (градусы).
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, корреляционного, регрессионного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica for Windows). Оценивали средние значения (M), их ошибки (m), коэффициенты корреляции, критерии регрессии, дисперсии, Стьюдента (S), Уилкоксона-Рао, хи-квадрат и достоверность статистических показателей (р).
Результаты и обсуждение
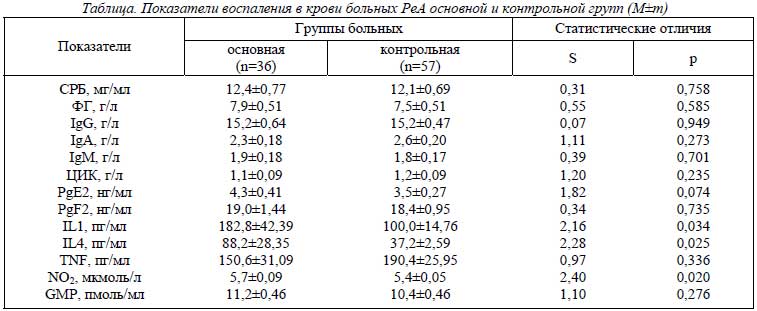
Полученные результаты исследования представлены в таблице. У шахтеров с РеА на 83% возрастает содержание IL1 (p=0,034), в 2,4 раза – IL4 (p=0,025) и на 6% NO2 (p=0,020). Следует подчеркнуть, что механические повреждающие силы при работе горняков в шахте могут влиять на структуру синовии, хряща и кости путем воздействия IL4, высвобождаемого под влиянием активации протеинкиназы-С и матриксных металлопротеиназ [23]. Вполне вероятно, что именно эти факторы определяют у шахтеров более высокий уровень в крови данного иммунорегуляторного цитокина. По данным многофакторного дисперсионного анализа, отсутствует влияние на интегральные показатели воспаления при РеА рабочих профессий, хотя, как свидетельствует однофакторный дисперсионный анализ, имеет место связь с этим фактором параметров IL4 (p=0,013) и TNF (p=0,042).
У представителей основной группы согласно увеличению продолжительности заболевания уменьшается общее состояние изученных показателей воспаления (p=0,019), чего не наблюдается в контрольной группе обследованных рабочих. Как свидетельствует регрессионный анализ, от длительности РеА обратно зависят исходные значения IgG (p=0,049), IgA (p=0,022), PgF2 (p=0,049), GMP (p=0,041). Во 2-й группе больных с продолжительностью патологического процесса обратно связан уровень в крови ФГ (p=0,029). В свою очередь параметры фибриногенемии у шахтеров прямо зависят от возраста пациентов (p=0,049).
Многофакторный дисперсионный анализ указывает, что на интегральное состояние показателей воспаления в основной группе больных влияет тяжесть поражения урогениталий (p<0,001), но не сакроилеита, тендовагинитов, энтезопатий, спондилопатий, офтальмопатий, изменений со стороны кожи, сердца, почек и ПНС. Регрессионная зависимость всех звеньев воспаления от клинических признаков РеА у больных шахтеров отсутствует, что в полной мере относится и к представителям нешахтерских профессий. Однофакторный дисперсионный анализ демонстрирует влияние в контрольной группе больных поражения урогениталий на показатели в крови ФГ (p=0,034), энтезисов – на концентрацию PgE2 (p=0,007) и TNF (p=0,032), кожи – на уровни IgM (p=0,019), PgE2 (p=0,006) и GMP (p=0,010), сердца – на содержание NO2 (p=0,014). Регрессионный анализ указывает на разнонаправленную зависимость параметров СРБ в крови больных нешахтеров от степени выраженности кожного (положительная, p=0,042) и почечного (отрицательная, p=0,047) синдромов, уровня ЦИК – на прямую связь с патологией только почек (p=0,005), концентрации PgE2 – с тяжестью энтезопатий (p=0,049), PgF2 – кардиопатии (p=0,048), IL1 – поражений урогениталий (p=0,032), IL4 (обратная зависимость) – крестцово-подвздошных сочленений (p=0,020) и периартикулярных тканей (p=0,017).
Одно и то же заболевание у шахтеров и рабочих других профессий значительно отличается по характеру влияния отдельных клинических признаков на показатели воспаления. Так, в основной группе сакроилеит оказывает воздействие на показатели в крови IgA (p=0,010), тендовагиниты – на уровни СРБ (p=0,041) и GMP (p=0,032), энтезопатии – на концентрацию IgM (p=0,036), поражение кожи – на содержание PgF2 (p=0,013) и GMP (p=0,037), почек – на IL1 (p=0,032), ПНС – на IL1 (p<0,001), ФГ (p=0,023) и TNF (p<0,001). От тяжести спондилопатий прямо зависят параметры в крови IgA (p=0,037) и TNF (p=0,043), от выраженности офтальмопатий – IgM (p=0,048), IL1 (p=0,028) и TNF (p=0,048). Таким образом, общностью основной и контрольной групп является только влияние кожного синдрома на уровень в крови GMP.
Нами не выявлено различий между параметрами простагландинемии у больных шахтеров и нешахтеров. В этой связи необходимо отметить, что простагландины относятся к естествнным медиаторам воспаления, а их продукция связана с высвобождением арахидоновой (эйкозатетраноиковой) кислоты под воздействием диацилглицерола, ферментов циклооксигеназ 1 и 2, фосфолипаз А2 и С. По современным представлениям PgE2 и PgF2 рассматриваются не как медиаторы, а как регуляторы воспаления и иммунных реакций. Различные формы простагландинов с разными типами клеточных рецепторов нередко проявляют противоположно направленную биологическую активность. Простагландинам, которые способствуют апоптозу хондроцитов, в генезе болезней суставов отводится большая роль [14, 18]. Иногда PgE2 способен обладать протекторным действием в отношении внеклеточного матрикса хряща, угнетая продукцию хондроцитами цитокинов.
Необходимо дать некоторые комментарии относительно более высоких показателей NO2 (конечных стойких метаболитов NO) в крови больных шахтеров. В настоящее время обмен NO привлекает все большее внимание при воспалительных болезнях суставов. Иммунные стрессы, обусловленные действием цитокинов у таких больных, стимулируют синтез NO [22]. Под влиянием цитокинов происходит экспрессия гена, ответственного за синтез индуцибельной оксидазотной синтетазы. При этом нейтрофилы, макрофаги, моноциты, фибробласты и пр. продуцируют и выделяют на протяжении многих часов в тысячу раз больше NO, чем после стимуляции конститутивной формой фермента. В этих случаях NO способствует иммунной защите организма, играя роль иммунорегулятора. В высоких концентрациях NO обнаруживает не регуляторное, а цитостатическое (цитотоксическое) действие, приводящее к усугублению различных проявлений аутоиммунного характера. Нитрирование белков при участии NO увеличивает их антигенность, что способствует аутоиммунным процессам. R.J.Van’T Hof et al [25] определяли синтез NO на уровень апоптоза клеток синовиальной среды суставов. У больных РеА степень апоптоза оказалась выше, чем при остеоартрозе. Такой ингибитор оксидазотной синтетазы, как L-NG-монометиларгинин, в значительной мере подавляет процессы апоптоза клеток суставной жидкости и хряща, а донатор NO S-нитроацетил-пеницилламин оказывает противоположное действие. Авторы считают, что NO играет роль медиатора апоптоза клеток синовиальной среды при РеА.
У шахтеров содержание в крови ФГ определяет развитие патологии глаз (p=0,043), почек (p=0,011) и ПНС (p=0,021), IgM – крестцово-подвздошных сочленений (p=0,042), PgE2 – позвоночника (p=0,041), TNF – энтезисов (p=0,005) и урогениталий (p=0,021), GMP – периартикулярных тканей (p=0,024), энтезисов (p=0,004), позвоночника (p=0,024) и кожи (p=0,019). У рабочих нешахтерских профессий уровень фибриногенемии оказывает воздействие на патологию урогениталий (p=0,017), глаз (p=0,025) и почек (p=0,004), содержание IgG и ЦИК – на развитие кардиопатии (соответственно p=0,020 и p=0,021), концентрация PgE2 – на формирование энтезопатий (p=0,008), IL4 – на спондилопатии (p=0,030). Следовательно, только показатели в крови ФГ у больных основной и контрольной групп оказывают влияние на развитие и тяжесть глазной и почечной патологии.
Множественный регрессионный анализ показывает прямую зависимость лабораторных показателей воспаления от мощности и угла наклона угольных пластов (соответственно p=0,007 и p=0,008), влажности рабочей зоны (p=0,003) и степени нагрузки на коленные суставы (p=0,026). Содержание в крови GMP обратно связано с толщиной угольных пластов (p=0,033), влажностью в шахте (p=0,049) и силовой нагрузкой на коленные суставы (p=0,045), концентрация провоспалительного IL1 – только с первым и вторым горногеологическим фактором (соответственно p=0,029 и p=0,023), причем имея позитивные взаимоотношения. Необходимо отметить, что от запыленности рабочей зоны прямо зависят параметры IgG (p=0,004), ЦИК (p=0,012), PgF2 (p=0,025), IL1 (p=0,017), TNF (p=0,036), а обратно – IL4 (p=0,016). По данным однофакторного дисперсионного анализа, влажность воздуха в шахте оказывает воздействие на показатели в крови больных РеА СРБ (p=0,025), IgA (p=0,047), PgF2 (p=0,046), IL4 (p=0,027) и GMP (p=0,037), мощность угольных пластов – на содержание PgF2 (p<0,001) и IL1 (p=0,038), запыленность воздуха – только на уровень PgF2 (p=0,044).
Выводы
Таким образом, особенностью патогенетических построений при РеА у шахтеров являются большие уровни в крови нитритемии, IL1 и IL4, уменьшение параметров IgG, IgA, PgF2 и GMP согласно увеличению продолжительности заболевания, влияние тяжести патологии урогениталий на состояние интегрального воспалительного ответа, участие иммунных нарушений, метаболизма арахидоновой кислоты и NO в патогенетических построениях поражения крестцово-подвздошных сочленений, периартикулярных тканей, позвоночника, кожи и ПНС. Профессии шахтеров не влияют на интегральное состояние воспалительного ответа и отдельные его параметры у больных РеА, но зависят показатели от мощности и угла наклона угольных пластов, влажности рабочей зоны, силовой нагрузки на коленные суставы и уровня запыленности в шахте.
- Абрагамович О.О., Жураєв Р.К. Перший досвід застосування флуренізиду в комплексному лікуванні пацієнтів з реактивним артритом хламідійної етіології // Укр. ревматол. журн.-2004.-Т.18, №4.-С.14-16.
- Бенца Т. Реактивные артриты // Ліки України.-2005.-Т.96-97, №7-8.-С.41-43.
- Данилюк С., Ященко О. Ревматичні хвороби в практиці сімейного лікаря // Ліка України.-2005.-Т.94, №5.-С.22-25.
- Джус М.Б. Клініко-імунологічні особливості перебігу реактивного артриту // Укр. ревматол. журн.-2004.-Т.17, №3.-С.44-48.
- Игнатенко Г.А. Реабилитация шахтеров с заболеваниями суставов // Укр. ревматол. журн.-2004.-Т.17, №3.-Додаток.-С.19.
- Козинская И.А. Течение остеоартроза у шахтеров разных профессиональных групп // Вестн. гигиены и эпидемиол..-2005.-Т.9, №1.-С.42-46.
- Синяченко О.В., Игнатенко Г.А. Болезнь Рейтера.-Донецк: Донеччина, 2002.-246 с.
- Синяченко О.В. Клиника, диагностика и лечение болезни Рейтера // Лікування діагност.-2003.-№4.-С.21-28.
- Синяченко О.В., Гринь В.К., Игнатенко Г.А. Остеоартроз у шахтеров.-Донецк: Юго-Восток, 2006.-202 с.
- Bressan E., Cunha F.Q., Tonussi C.R. Contribution of TNFalpha, IL-1beta and CINC-1 for articular incapacitation, edema and cell migration in a model of LPS-induced reactive arthritis // Cytokine.-2006.-Vol.36, N1-2.-P.83-89.
- Buckwalter J.A., Matrin J.A. Sports and osteoarthritis // Curr. Opin. Rheumatol.-2004.-16, N5.-P.634-639.
- Darling E.M., Athanasion K.A. Biomechanical strategies for articular cartilage regeneration // Ann. Biomed. Eng.-2003.-Vol.31, N9.-P.1114-1124.
- De Angelis R., Salaffi F., Grassi W. Prevalence of spondyloarthropathies in an Italian population sample: a regional community-based study // Scand. J. Rheumatol.-2007.-Vol.36, N1.-P.14-21.
- Goldring M.B., Berenbaum F. The regulation of chondrocyte function by proinflammatory mediators: prostaglandins and nitric oxide // Clin. Orthop.-2004.-Vol.427, Suppl.-P.37-46.
- Jarmalaite S., Mierauskiene J., Beitas K. et al. Sister chromatid exchanges and cell proliferative abilities in cultured peripheral blood lymphocytes of patients with rheumatoid and reactive arthritis // Clin. Exp. Rheumatol.-2006.-Vol.24, N6.-P.677-682.
- Kiknadze N.G., Bukiia T.Sh., Kartvelishvili E.Iu. Cytokines and smoking in the cases of reactive arthritis during urogenital chlamydiosis // Georgian Med. News.-2006.-N134.-P.76-80.
- Kinnunen A., Molander P., Laurila A. et al. Chlamydia trachomatis reactive T lymphocytes from upper genital tract tissue specimens // Hum. Reprod.-2000.-Vol.15, N7.-P.1484-1489.
- Kojima F., Naraba H., Miyamoto S. et al. Membrane-associated prostaglandin E synthase-1 is upregulated by proinflammatory cytokines in chondrocytes from patients with osteoarthritis // Arthr. Res. Ther.-2004.-Vol.6, N4.-P.R355-365.
- Kuuliala A., Kautiainen H., Repo H., Leirisalo-Repo M. Circulating soluble interleukin-2 receptor level predicts remission in very early reactive arthritis // Scand. J. Rheumatol.-2005.-Vol.34, N5.-P.372-375.
- Pavy S., Allanore Y., Kahan A. Spondylarthropathies and anti-TNFalpha drugs // Rev. Med. Interne.-2005.-Vol.26, N9.-P.717-724.
- Rihl M., Klos A., Kuipers J.G. Infection and musculoskeletal conditions: Reactive arthritis // Best Pract. Res. Clin. Rheumatol.-2006.-Vol.20, N6.-P.1119-1137.
- Rivier С. Role of nitric oxide and carbon monooxide in modulating the ACTH response to immune and nonimmune signals // Neuroimmunomodulation.-1998.–Vol.5.–P.203-213.
- Salter D.M., Wright M.O., Millward-Sadler S.J. NMDA receptor expression and roles in human articular chondrocyte mechanotransduction // Biorheology.-2004.-Vol.41, N3-4.-P.273-281.
- Scharff R.L., Jessup A. Evaluating chronic disease for heterogeneous populations: the case of arthritis // Med. Care.-2007.-Vol.45, N9.-P.860-868.
- Van’T Hof R.J., Hocking L., Wright P.K., Ralston S.H. Nitric oxide is a mediator of apoptosis in the rheumatoid joint // Rheumatology.-2000.-Vol.39, N9.-P.1004-1008.
- Williams D.M.., Grubbs B.G., Pack E. et al. Humoral and cellular immunity in secondary infection due to murine Chlamydia trachomatis // Infect. Immun.-1997.-Vol.65, N7.-P.2876-2882.