Журнал «Травма» Том 9, №1, 2008
Вернуться к номеру
Результаты параллельного изучения чувствительности микроорганизмов к антибиотикам на средах агв и мюллер-хинтона
Авторы: В.Г. Пернакова, Е.Н. Поддубная, В.Т. Шевченко, Л.Л. Поповиченко - НИИ травматологии и ортопедии Донецкого национального медицинского университета им. М. Горького, Донецк, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Проведены параллельные исследования чувствительности к 22 антибиотикам 91 штамма микроорганизмов на средах АГВ (ФГУП НПО «Микро-ген» МЗ РФ) и Мюллер-Хинтона (Hi Media, Индия). Учитывали величины зон задержки роста вокруг дисков с антибиотиками и число активных в отношении штамма антибиотиков. Для S. aureus, S. epidermidis, P. aeruginosae благоприятной является среда АГВ. Равноценны и взаимозаменяемы обе среды при испытании чувствительности к антибиотикам семейства Enterobacteriaceae. В определении чувствительности к антибиотикам Enterococcus spp, S. pyogenes более эф-фективной оказалась среда Мюллер-Хинтона. Предлагается дифференцированное использование исследованных питательных сред.
Проведені паралельні дослідження чутливості до 22 антибіотиків 91 штаму мікроорганізмів на середовищах АГВ (ФГУП НПО “Мікроген”, МОЗ РФ) і Мюллер-Хінтона (Hi Media, Індія). Враховували розміри зон затримки росту навколо дисків з антибіотиками та кількість актив-них щодо штама антибіотиків. Для S. aureus , S. epidermidis, P. aeruginosae сприятливим є середовище АГВ. Рівнозначними і взаємно замі-нюваними є обидва середовища при випробуванні чутливості до антибіотиків родини Enterobacteriaceae. У визначенні чутливості до анти-біотиків Enterococcus spp, S. pyogenes ефективнішим виявилось середовище Мюллер-Хінтона. Запропоновано диференційне використання досліджених живильних середовищ.
In this paper authors made parallel investigation of sensitivity of 91 strains of microorganisms to 22 antibiotics on AGV (FSEP SPU “Microgen”, Russia) and Muller-Hinton (Hi Media, India) mediums. Author has consider zones of stunted growth around discs with antibiotics and quanity of active strains. For S.aureus, S.epidermidis, P.aeruginosae auspicious medium is AGV. Both mediums are equivalent and replaceable for Enterobacte-riaceae group of microorganisms. Muller-Hinton medium is most effective for estimation of sensitivity to Enterococcus spp and S. pyogenes. Authors has propose differentiate usage of this mediums.
бактерии, антибиотики
бактерії, антибіотик
bacterium, antibiotics
Неотъемлемой частью и окончательным этапом диагностического микробиологического исследования является определение чувствительности выделенного из биологического материала штамма к антибиотикам (АБ). Из ряда предлагаемых методов при рутинных микробиологических исследованиях наиболее распространенным и практически значимым является метод диффузии в агар с применением стандартных дисков антибиотиков при посеве материала на специально разработанную для этих целей среду АГВ [1,2].
В работах последних лет ряд авторов [1,4] отдают предпочтение для определения чувствительности микроорганизмов к АБ, как автоматизированным, так и ручным методом, среде Мюллер-Хинтона (МХ) производства Франции. Кроме нее, на рынках медицинских препаратов имеется среда МХ, производимая в Индии.
С целью определения результативности среды МХ индийского производства при определении чувствительности микроорганизмов к АБ мы предприняли одновременные параллельные исследования ее и среды АГВ. При этом мы пользовались питательной средой АГВ (ФГУП ПНО «Микроген» МЗ РФ) и средой Мюллер-Хинтона (Hi Media, Индия).
Материал и методы
Мы использовали культуры свежевыделенных из раневого содержимого [3] штаммов микроорганизмов: Staphylococcus aureus (13), Staphylococcuc epidermidis (13), Streptococcus pyogenes (3) , Enterococcus faecalis (15), Enterococcus faecium (3), Escherichia coli (13), Citrobacter freundii (10), Enterobacter cloaceae (1),Klebsiella pneumoniae (2), Proteus rettgeri (2), Morganella morganii (2), Alcaligenes faecalis (1), Pseudomonas aeruginosa (13). Суспензии бактериальных культур общепринятым методом [1,2] наносили на чашки Петри с испытуемыми средами. После удаления избытка культуры и подсушивания в термостате на посевы наносили стандартные диски с АБ: оксациллином, ванкомицином, гентамицином, амикацином, тетрациклином, доксициклином, эритромицином, полимиксином, фузидином натрия, левомицетином, цефоперазоном, цефотаксимом, офрамаксом, цефтриаксоном, абакталом, норбактином, цифраном, заноцином, локсофом. При этом полимиксин и левомицетин использовали только при исследовании грамотрицательных, эритромицин – только грамположительных микроорганизмов, а ванкомицин – для стафилококков и стрептококков. После 18-24 часового инкубирования посевов при температуре +37° С измеряли диаметры зон задержки роста и в соответствии с таблицами оценивали чувствительность культур к АБ.
Результаты и обсуждение
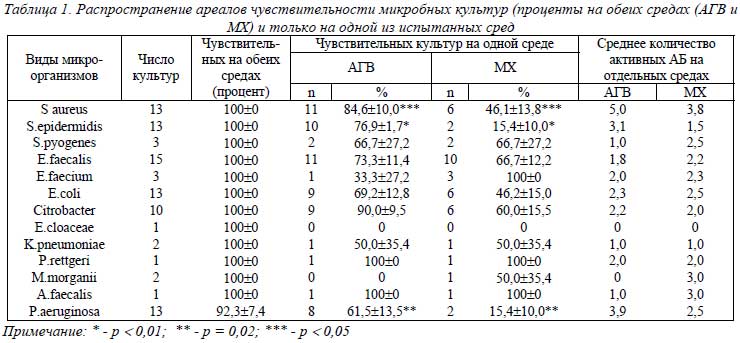
Проанализированы результаты параллельных исследований чувствительности микроорганизмов к антибиотикам (табл. 1). К ряду АБ чувствительность совпадала в 100%, у P. aeruginosae – в 92,3% исследований. Кроме того, к некоторым антибиотикам чувствительность определена только на АГВ или только на МХ (табл. 1). Наличие чувствительности только на среде АГВ встречалось в 61,5% - 90,0%, а на среде МХ – в 15,4-60,0%. Значительно чаще определяли наличие чувствительности только на среде АГВ по сравнению со средой МХ у S. aureus (р = 0,05), S. epidermidis (р < 0,01),
Р. aeruginosaе (р = 0,02). Эта же тенденция прослеживалась у E. coli, Citrobacter spp. Среднее число антибиотиков, проявивших активность только на среде АГВ и только на среде МХ, составляло у S. аureus 5,04 и 3,5, у S.еpidermidis 3,1 и 1,5, у P.аeruginosa – 3,9 и 2,5, у других микроорганизмов на среде АГВ 1-2,3, а на среде МХ – 1-2,5.
Таким образом, и по частоте выявления чувствительности к АБ только на одной среде, и по количеству активных антибиотиков на 1 анализ превалировала среда АГВ, в особенности при исследовании S.аureus, S.еpidermidis, P.аeruginosae.
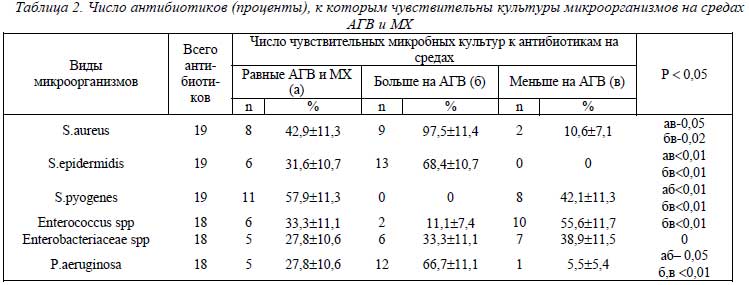
Была исследована частота выявления параллельно на средах АГВ и МХ чувствительности микроорганизмов к конкретным антибиотикам.
Из полученных данных следует, что у S.аureus чувствительность к 5 АБ (оксациллину, гентамицину, тетрациклину, доксициклину, фузидину) в 1,5 – 22 раза выше на среде АГВ. Кроме того, более высокая частота выявления чувствительных культур S. аureus на среде АГВ по сравнению со средой МХ была к рефлину (1,5), норбактину (1,5), цифрану (1,3). Практически равные показатели чувствительных культур S.аureus на средах АГВ и МХ были к 4 АБ цефалоспоринового ряда, к 3 фторхинолонам и ванкомицину. У S.аureus из 19 исследований более высокая частота выявления чувствительных культур на среде АГВ по сравнению со средой МХ была к 9 АБ, равная – к 8, и только к 2 АБ была ниже, чем на среде МХ (табл. 2). При этом частота высоких показателей чувствительных культур была существенно больше (р = 0,02), чем низких. У S.еpidermidis частота чувствительных культур на АГВ не превышала таковую на среде МХ к АБ оксациллину, рефлину, цефалотину, норбактину, заноцину, локсофу. Превышение частоты чувствительных культур S.еpidermidis на среде АГВ по отношению к аналогичному показателю на среде МХ в пределах 1,1 – 1,4 было к 9 АБ: тетрациклину, доксициклину, фузидину, цефазолину, цефоперазону, цефотаксиму, абакталу, цифрану, ванкомицину, а в пределах 1,5 – 2,0 к АБ гентамицину, эритромицину, офрамаксу, цефтриаксону. У S.еpidermidis в большинстве исследований (13 из 19) частота чувствительных к АБ культур на среде АГВ была выше, чем на среде МХ. Показатели чувствительных культур на среде АГВ ниже, чем на среде МХ, отсутствовали (р< 0,01).
В 3 культурах S. рyogenes равные числа активных АБ на обеих средах приближались к более низким на среде АГВ по сравнению со средой МХ, а более высокие показатели на среде АГВ отсутствовали (р < 0,01).
У Enterococcus spp были равные частоты чувствительности культур к АБ цефалотину, рефлину, цефоперазону, абакталу, ванкомицину, гентамицину. К другим АБ частота выявления чувствительных штаммов на среде АГВ преимущественно составляла 0,8 соответствующего показателя на МХ. Из этого следует, что на среде АГВ в большинстве культур Enterococcus spp частота выявления чувствительных была несколько ниже, чем на среде МХ. Равные частоты чувствительных культур бактерий семейства Enterobacteriacecae (ЕВ) на обеих средах были к полимиксину, офрамаксу, цефтриаксону, локсофу, цифрану, выше на среде АГВ к АБ гентамицину, амикацину, левомицетину, цефалотину, норбактину (1,3 – 1,7), а ниже – к АБ доксициклину, цефазолину, рефлину, цефоперазону, цефoтаксиму, абакталу, цифрану (0,4-0,8). Таким образом, при исследовании чувствительности ЕВ к 18 АБ на среде АГВ были равны и более высокие показатели к 11 АБ, а ниже к 7 АБ, чем на среде МХ (табл.2). В культурах P.аeruginosae равное число чувствительных на обеих средах было к заноцину (7,7%), а к 4 АБ чувствительности не было; выше на среде АГВ, чем на МХ, к амикацину (1,5), полимиксину (1,4), абакталу (2,5), локсофу (5,0). Были определены единичные чувствительные культуры только на среде АГВ при отсутствии таковых на среде МХ к АБ гентамицину (23,1%), цефазолину (23,1%), цефотаксиму (15,4%), офрамаксу (15,4%), норбактину (15,4%), цифрану (23,1%). Таким образом, на среде АГВ выявляли больше чувствительных культур P.аeruginosae, чем на среде МХ, в том числе к наиболее активным к P.аeruginosae антибиотикам – амикацину, полимиксину; к 7 антибиотикам находили от 7,7% до 23,1% чувствительных культур только на среде АГВ.
Из полученных данных следует, что у одних видов микроорганизмов(S.аureus, S.еpidermidis, P.аeruginosa) выявляется чувствительность к большему числу антибиотиков на среде АГВ, чем на среде МХ (р< 0,02, р < 0,01), а к равному на обеих средах числу в пределах 27,8% - 42,9%. У бактерий семейства ЕВ частоты выявления чувствительности к равному, большему и меньшему числам АБ на среде АГВ по сравнению со средой МХ не имеют существенных различий. Бактерии рода Enterococcus и S. pyogenes в большинстве своем на среде АГВ выявляют чувствительность к меньшему числу АБ, а также к равному по сравнению со средой МХ, и только в 0-11,1% они были чувствительны к большему числу АБ.
В связи со сказанным мы рекомендуем применять для определения чувствительности к АБ стафилококков и P.аeruginosae среду АГВ. Чувствительность семейства ЕВ к АБ можно определять как на среде АГВ, так и на среде МХ. Для определения чувствительных к АБ бактерий рода Enterococcus и S. pyogenes рекомендуется среда МХ.
Проведенные исследования не выявили однозначного преимущества среды МХ над средой АГВ. Вероятно, неоднозначность результатов определения чувствительности к АВ определяется некоторыми различиями в составе исследуемых сред и физиологическими потребностями в питании различных родов микроорганизмов. Питательной основой в среде АГВ является панкреатический гидролизат кильки и крахмал, а в среде МХ – мясной настой, кислотный гидролизат казеина и крахмал. Стабилизатором плотности в обеих средах является агар микробиологический. Среда МХ в соответствии с высоким содержанием агара более плотна, чем АГВ. Среда МХ содержит крахмала (углеводов) в 3 раза больше, чем среда АГВ. По содержанию углеводов эта среда ближе к среде Эндо. Возможно, обогащение углеводами среды МХ обеспечивает благоприятное влияние ее на микроорганизмы: обитатели желудочно-кишечного тракта, в частности Enterococcus spp и бактерии семейства Enterobacteriacecae. Род Streptococcus, также требует для роста углеводы. Возможно, характер роста S.pyogenes на испытуемых средах и определяется разностью содержания в них крахмала. Как полноценный источник пищевых протеинов издавна ценили панкреатические перевары мяса или рыбы [1,2,3]. По-видимому, кислотный гидролизат имеющего низкую пищевую ценность белка казеина в сочетании с мясным настоем по питательной ценности беднее панктеатического гидролизата кильки. Возможно, в связи с этим микроорганизмы, не требующие для своего роста углеводов (стафилококки,P.aeruginosa), лучше реализуют свои ростовые возможности и антибиотикочувствительность на среде АГВ.
Выводы
- Для определения чувствительности к антибиотикам S.аureus, S.еpidermidis, P.аeruginosae более благоприятной является среда АГВ производства НПО «Микроген».
- Равноценны и взаимозаменяемы среды АГВ и МХ (Hi Media, Индия) при испытании чувствительности к АБ бактерий семейства Enterobacteriaceae.
- Рекомендуется среда МХ производства HiMedia (Индия) при определении чувствительности к АБ Enterococcus spp, S.pyogenes в связи с положительными результатами эксперимента.
- Авдеева Л.В., Полищук Е.И., Покас Е.В. Методические подходы к определению чувствительности микроорганизмов к антибиотикам // Лабор. диагностика. – 2005. – № 3(33). – С. 35-40.
- Методические указания по определению чувствительности микроорганизмов к антибиотикам методом диффузии в агар с использованием дисков /МЗ СССР, 10 марта 1983 г. – М., 1983. – 15 с.
- Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений /Приказ № 535 МЗ СССР. – М., 1985. – 126 с.
- Скала Л.З., Сидоренко С.В., Нехорошева А.Г., Лукин И.Н., Грудинина С.А. Практические аспекты современной клинической микробиологии. –М., 2004. – 310 с.