Журнал «Медицина неотложных состояний» 3(10) 2007
Вернуться к номеру
Диагностика и лечение острой сердечной недостаточности (Часть первая. Диагностика)
Авторы: А.Н. Пархоменко, О.И. Иркин, Ж.В. Брыль Отдел реанимации и интенсивной терапии ННЦ, Институт кардиологии им. Н.Д. Стражеско АМН Украины, Киев
Рубрики: Медицина неотложных состояний, Кардиология
Разделы: Справочник специалиста
Версия для печати
Острая сердечная недостаточность (ОСН) — клинический синдром, характеризующийся быстрым возникновением симптомов, характерных для нарушенной функции сердца (сниженный сердечный выброс, недостаточная перфузия тканей, повышенное давление в капиллярах легких, застой в тканях). Она развивается без связи с наличием кардиологической патологии в прошлом. Нарушения сердца могут носить характер систолической или диастолической дисфункции, нарушений сердечного ритма, нарушений преднагрузки и постнагрузки. Эти нарушения часто носят угрожающий жизни характер и требуют проведения экстренных мероприятий. ОСН может развиться как острое заболевание de novo (то есть у пациента без имевшейся раньше дисфункции сердца) или в качестве острой декомпенсации хронической сердечной недостаточности [3].
Причины ОСН разнообразны. Чаще всего она является следствием декомпенсации хронической сердечной недостаточности (ХСН). Ишемическая болезнь сердца является причиной ОСН в 60–70 % случаев [3, 4], особенно у пожилых пациентов. У более молодых лиц ОСН развивается вследствие дилатационной кардиомиопатии, аритмий, врожденных и приобретенных пороков сердца, миокардитов [5, 6]. Наряду с прогрессированием заболевания, лежащего в основе ОСН, ее появлению могут способствовать сердечные и несердечные провоцирующие факторы.
Основные причины и факторы, способствующие развитию ОСН
1. Декомпенсация хронической сердечной недостаточности.
2. Обострение ИБС (острый коронарный синдром):
— инфаркт миокарда или нестабильная стенокардия с распространенной ишемией миокарда;
— механические осложнения острого инфаркта миокарда;
— инфаркт миокарда правого желудочка.
3. Гипертонический криз.
4. Остро возникшая аритмия.
5. Остро возникшая клапанная регургитация, усугубление предшествующей клапанной регургитации.
6. Тяжелый аортальный стеноз.
7. Тяжелый острый миокардит.
8. Тампонада сердца.
9. Расслоение аорты.
10. Послеродовая кардиомиопатия.
11. Несердечные провоцирующие факторы:
— недостаточная приверженность к лечению;
— перегрузка объемом;
— инфекции, особенно пневмония и септицемия;
— тяжелый инсульт;
— обширная операция;
— почечная недостаточность;
— бронхиальная астма;
— передозировка лекарственных средств;
— злоупотребление алкоголем;
— феохромоцитома;
12. Синдромы высокого сердечного выброса:
— септицемия;
— тиреотоксический криз;
— анемия;
— шунтирование крови.
ОСН возникает за счет сердечных и несердечных причин, которые могут быть преходящими или вызывать необратимое повреждение сердца, приводящее к ХСН. Дисфункция сердца может быть связана с нарушением систолической или диастолической функции миокарда (ишемия, инфекция, выраженная гипертрофия и другие причины нарушенного расслабления миокарда), острой дисфункцией клапанов, тампонадой, нарушениями ритма или проводимости, а также несоответствием пред- или постнагрузки [7]. Многочисленные несердечные заболевания способны привести к ОСН в основном за счет влияния на пред- и постнагрузку: увеличения постнагрузки при системной (артериальной) или легочной гипертензии, массивной ТЭЛА; увеличения преднагрузки при повышенном поступлении жидкости или ее сниженном выведении (почечная недостаточность, эндокринные заболевания); синдрома высокого сердечного выброса при инфекции, тиреотоксикозе, анемии, болезни Педжета, ятрогениях. ОСН может осложняться нарушением функции различных органов и в тяжелых случаях вызывать полиорганную недостаточность, приводящую к смерти. Длительное лечение лежащего в основе заболевания, включая его анатомическую коррекцию (если возможно), позволяет предупредить повторные эпизоды ОСН и улучшить прогноз.
Несмотря на значительные достижения последних лет в лечении ОСН, ближайший и отдаленный прогноз остается неблагоприятным. Смертность особенно высока при ОИМ, осложнившимся развитием ОСН, и составляет 30 % в течение первого года [8]. При развитии отека легких внутрибольничная летальность составляет 12 %, годичная летальность — 40 % [9, 10]. Около 45 % пациентов, госпитализированных с ОСН, в течение последующего года повторно поступают в стационар хотя бы один раз [11, 12]. Риск смерти или повторной госпитализации в течение 60 суток составляет по разным данным от 30 до 60 % [13–15]. Улучшить клинический исход при ОСН можно с помощью ранней диагностики и правильно выбранной тактики лечения.
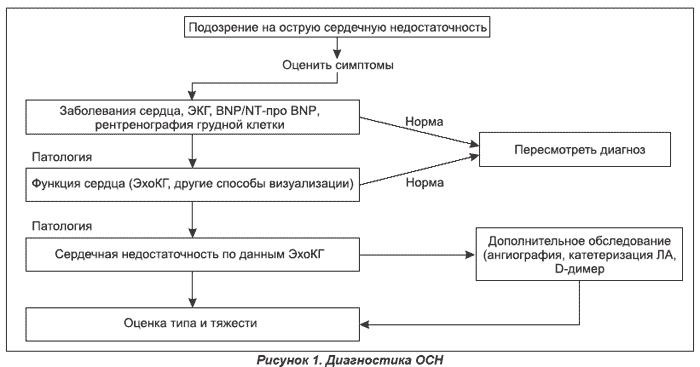
Диагноз ОСН ставится на основании характерных жалоб больного, клинических симптомов и результатов дополнительных методов обследования (ЭКГ, рентгенография грудной клетки, эхокардиография, определение уровня биомаркеров в крови) (рис. 1).
Оценка клинического состояния
Жалобы.При поступлении больной предъявляет жалобы на одышку / удушье, сухой кашель, кровохарканье, страх смерти. При развитии отека легких появляется кашель с пенистой мокротой, часто окрашенной в розовый цвет. Больной принимает вынужденное положение сидя.
При физикальном обследовании следует обратить особое внимание на пальпацию и аускультацию сердца с определением качества сердечных тонов, наличия III и IV тонов, наличия и характера шумов. У пожилых пациентов необходимо определить признаки периферического атеросклероза: неравномерный пульс, шумы на сонных артериях и брюшной аорте. Важно систематически оценивать состояние периферической циркуляции, температуру кожных покровов, степень заполнения желудочков сердца. Давление заполнения правого желудочка можно оценить с помощью венозного давления, измеренного в наружной яремной или верхней полой вене. О повышенном давлении заполнения левого желудочка обычно свидетельствует наличие влажных хрипов при аускультации легких и/или признаков застоя крови в легких при рентгенографии грудной клетки.
ЭКГ. При острой сердечной недостаточности ЭКГ бывает неизмененной крайне редко. В выявлении этиологии ОСН может помочь определение ритма, признаков перегрузки. Особое значение имеет регистрация ЭКГ при подозрении на острый коронарный синдром [16–19]. Кроме того, на ЭКГ можно выявить нагрузку на левый или правый желудочек, предсердия, признаки перимиокардита и хронических заболеваний, таких как гипертрофия желудочков или дилатационная кардиомиопатия.
Рентгенография грудной клетки позволяет оценить размеры и четкость тени сердца, выраженность застоя крови в легких. Это исследование используется для подтверждения диагноза, дифференциальной диагностики с заболеваниями легких, а также для оценки эффективности лечения.
Эхокардиография необходима для выявления структурных и функциональных изменений [20, 21], лежащих в основе ОСН. Ее применяют для оценки и мониторирования локальной и общей функции желудочков сердца, структуры и функции клапанов, патологии перикарда, механических осложнений инфаркта миокарда, объемных образований сердца [22, 23]. Сердечный выброс можно оценить по скорости движения контуров аорты или легочной артерии. Кроме того, при допплеровском исследовании можно определить давление в легочной артерии (по струе трикуспидальной регургитации) и мониторировать преднагрузку левого желудочка [24].
Для подтверждения и/или исключения наличия ХСН у больных, госпитализированных в отделение неотложной терапии с одышкой, предложено использовать определение мозгового натрийуретического пептида (МНП) в плазме крови (вещество, образуемое в желудочках сердца при механическом растяжении его стенок и перегрузке объемом) для исключения или подтверждения наличия хронической сердечной недостаточности (ХСН) у пациентов, госпитализированных в стационар с жалобами на одышку [25]. Пограничные значения составляют 300 пг/мл для NT?проМНП и 100 пг/мл для МНП, однако при определении этих значений в исследованиях почти не включались пожилые пациенты. Во время развития отека легких значения МНП к моменту госпитализации пациента могут быть нормальными. С другой стороны, МНП обладает хорошим негативным предсказательным значением при исключении сердечной недостаточности [26]. Различные клинические состояния могут влиять на концентрацию МНП, например почечная недостаточность и септицемия. Если выявляются повышенные концентрации, требуется проведение дальнейших диагностических тестов. Если ОСН подтверждена, повышенное содержание в плазме МНП и NT-проМНП представляет важную прогностическую информацию. Тем не менее истинное значение МНП требует дальнейшего изучения [27].
Инвазивная оценка газов артериальной крови с определением параметров, характеризующих ее оксигенацию (pO2), адекватность дыхания (pCO2), кислотно-щелочное равновесие (pH) и дефицит оснований, необходима при тяжелой ОСН. У больных с умеренным снижением сердечного выброса и при отсутствии шока с вазоконстрикцией альтернативой могут служить пульсовая оксиметрия и определение CO2 в конце выдоха. Для оценки баланса поступления кислорода и потребности в нем можно определять сатурацию венозной крови (SvO2). При кардиогенном шоке и длительно существующем синдроме малого выброса рекомендуется определять насыщение кислородом смешанной венозной крови в легочной артерии [28].
Инвазивный контроль гемодинамики
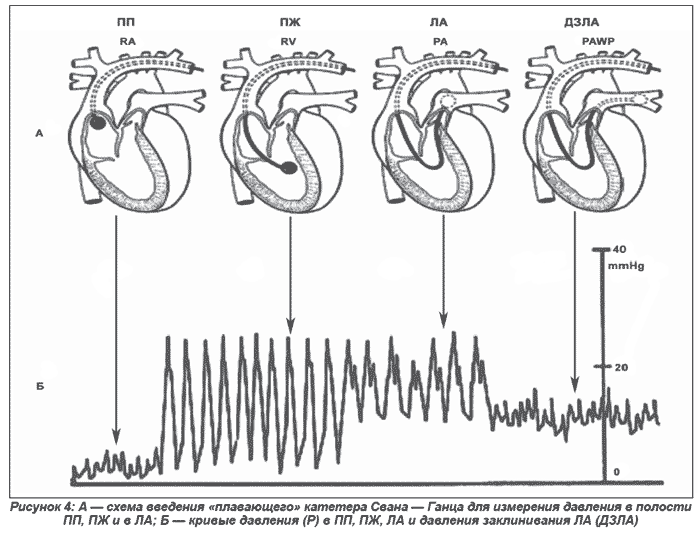
Катетеризация ЛА позволяет получить наиболее точную и полную информацию о нарушениях гемодинамики правых отделов сердца. Метод позволяет измерить давление в ЛА, правом предсердии, ПЖ, оценить давление в левом предсердии по давлению заклинивания в ЛА (ДЗЛА), определить легочное сосудистое сопротивление, сердечный выброс (методом термодилюции) и насыщение смешанной венозной крови кислородом.
Для катетеризации ЛА используют катетер Свана — Ганца, который снабжен баллончиком и термистором. Катетер вводят через одну из центральных вен в полую вену и правое предсердие. Здесь баллончик раздувают и катетер проводят в ПЖ, а затем в ЛА, где продвигают до точки заклинивания. Положение катетера определяют по форме кривой давления, а если это не удается, то рентгенологически.
Катетеризация ЛА позволяет выявить гемодинамические нарушения и определить степень их выраженности при ТЭЛА. В типичных случаях выявляется повышение давления в правом предсердии, среднего давления в ЛА, снижение СИ, нормальное ДЗЛА, повышение легочного сосудистого сопротивления. Многие исследования 90-х годов показали отсутствие эффективности прямого гемодинамического контроля больных с ОСН. Отсутствие усиления эффекта терапии при наличии увеличения осложнений, связанных с катетеризацией, сделало способ катетеризации ЛА второстепенным в контроле лечения и диагностике ОСН. Исследования последних лет показали снижение осложнений катетеризации ЛА при использовании обученного персонала и эффективность при контроле диуретической терапии, решении вопроса о назначении прессорных аминов и других негликозидных кардиотоников (левосимендан) [29–32].
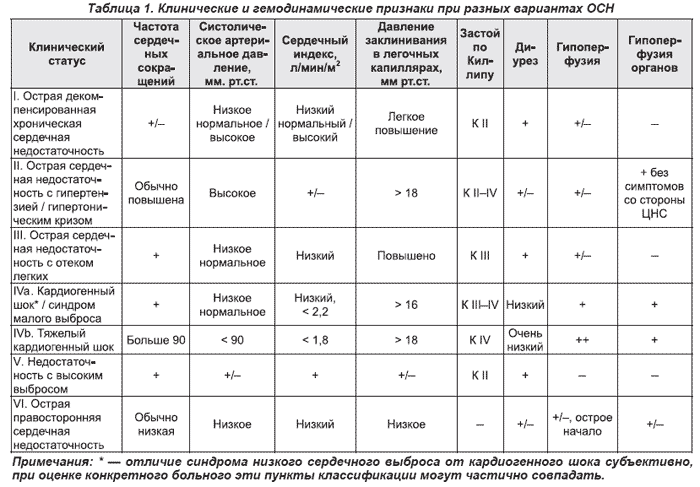
Классификация ОСН
Классификация по Киллипу разработана для сердечной недостаточности после ОИМ и может применяться при сердечной недостаточности de novo. Она основана на клинической симптоматике и результатах рентгенографии органов грудной полости [33].
Классификация Killip
Стадия I — нет признаков сердечной недостаточности.
Стадия II — сердечная недостаточность (влажные хрипы в нижней половине легочных полей, III тон, признаки венозной гипертензии в легких).
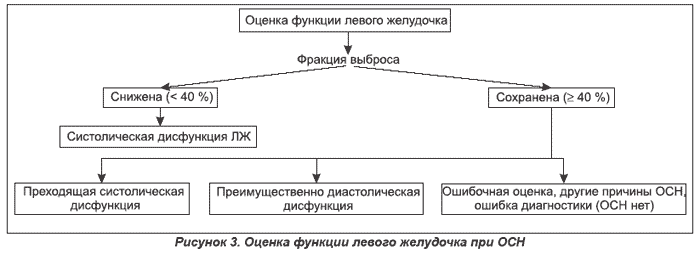
Стадия III — тяжелая сердечная недостаточность (явный отек легких; влажные хрипы распространяются более чем на нижнюю половину легочных полей).
Стадия IV — кардиогенный шок (систолическое АД менее 90 мм рт.ст. с признаками периферической вазоконстрикции: олигурия, цианоз, потливость).
Классификация клинической тяжести основана на клинических признаках (оценке периферической перфузии и застоя в легких при аускультации) и используется при декомпенсации хронической сердечной недостаточности [34].
Класс I — нет признаков периферической гипоперфузии и застоя в легких («теплые и сухие»).
Класс II — нет признаков периферической гипоперфузии с застоем в легких («теплые и влажные»).
Класс III — признаки периферической гипоперфузии без застоя в легких («холодные и сухие»).
Класс IV — признаки периферической гипоперфузии с застоем в легких («холодные и влажные»).
ОСН характеризуется разнообразием клинических вариантов:
— отек легких (подтвержденный при рентгенографии грудной клетки) — тяжелый респираторный дистресс с влажными хрипами в легких, ортопноэ и, как правило, насыщением артериальной крови кислородом < 90 % до начала лечения;
— кардиогенный шок — клинический синдром, характеризующийся гипоперфузией тканей из-за сердечной недостаточности, которая сохраняется после коррекции преднагрузки. В отношении параметров гемодинамики нет четких определений данного состояния. Обычно наблюдается артериальная гипотония (систолическое АД < 90 мм рт.ст. или снижение среднего АД на 30 мм рт.ст. и более) и/или снижение скорости диуреза (< 0,5 мл/кг/час), частота сердечных сокращений > 60 уд./мин, наличие застоя в тканях возможно, но необязательно;
— острая декомпенсированная сердечная недостаточность (впервые возникшая декомпенсация ХСН) с характерными жалобами и симптомами ОСН умеренной степени выраженности, которые не соответствуют критериям кардиогенного шока, отека легких или гипертонического криза;
— гипертензивная ОСН — симптомы ОСН у больных с относительно сохранной функцией левого желудочка в сочетании с высоким АД и рентгенологической картиной венозного застоя в легких или отека легких;
— сердечная недостаточность с высоким сердечным выбросом — симптомы ОСН у больных с высоким сердечным выбросом, обычно в сочетании с тахикардией (вследствие аритмий, тиреотоксикоза, анемии, болезни Педжета, ятрогенных и других причин), теплыми кожными покровами и конечностями, застоем в легких и иногда низким АД (септический шок);
— правожелудочковая недостаточность — синдром низкого сердечного выброса в сочетании с повышенным давлением в яремных венах, увеличением печени и артериальной гипотензией.
Клинические синдромы при ОСН
ОСН возникает за счет сердечных и несердечных причин, которые могут быть преходящими или вызывать необратимое повреждение сердца, приводящее к ХСН. Дисфункция сердца может быть связана с нарушением систолической или диастолической функции миокарда (ишемия, инфекция, выраженная гипертрофия и другие причины нарушенного расслабления миокарда), острой дисфункцией клапанов, тампонадой, нарушениями ритма или проводимости, а также несоответствием пред- или постнагрузки [35–39]. Многочисленные несердечные заболевания способны привести к ОСН в основном за счет влияния на пред- и постнагрузку: увеличения постнагрузки при системной (артериальной) или легочной гипертензии, массивной ТЭЛА; увеличения преднагрузки при повышенном поступлении жидкости или ее сниженном выведении (почечная недостаточность, эндокринные заболевания); синдрома высокого сердечного выброса при инфекции, тиреотоксикозе, анемии, болезни Педжета, ятрогениях [40, 41].
ОСН может осложняться нарушением функции различных органов и в тяжелых случаях вызывать полиорганную недостаточность, приводящую к смерти. Длительное лечение лежащего в основе заболевания, включая его анатомическую коррекцию (если возможно), позволяет предупредить повторные эпизоды ОСН и улучшить прогноз.
С клинической точки зрения ОСН можно разделить на лево- или правожелудочковую недостаточность с низким сердечным выбросом, лево- или правожелудочковую недостаточность с симптомами застоя крови, а также их сочетанием.
ОСН с низким сердечным выбросом возникает при многих заболеваниях, включая острый коронарный синдром, острый миокардит, острую дисфункцию клапанов сердца, ТЭЛА, тампонаду сердца. Кроме того, причиной низкого сердечного выброса может быть недостаточное давление заполнения желудочков сердца. Тяжесть симптомов варьирует от утомляемости при нагрузке до развернутой картины кардиогенного шока.
Левожелудочковая недостаточность с симптомами застоя крови может быть следствием дисфункции миокарда при хроническом заболевании, острой ишемии и инфаркта миокарда, дисфункции аортального и митрального клапанов, нарушений ритма сердца, опухолей левых отделов сердца, а также ряда несердечных причин (тяжелая артериальная гипертензия, высокий сердечный выброс при анемии или тиреотоксикозе, опухоль или травма головного мозга). Тяжесть симптомов варьирует от одышки при нагрузке до отека легких.
Правожелудочковая недостаточность с симптомами застоя крови связана с патологией легочной артерии и правых отделов сердца: обострение хронического заболевания легких с легочной гипертензией, острое тяжелое заболевание легких (массивная пневмония, ТЭЛА), острый инфаркт правого желудочка, дисфункция трикуспидального клапана (травма, инфекция). Кроме того, следует рассмотреть возможность острого или подострого заболевания перикарда, прогрессирования тяжелой недостаточности левых отделов сердца с вовлечением правых отделов, а также декомпенсации длительно существующего врожденного порока сердца. Несердечные причины включают в себя нефрит, нефротический синдром, конечную стадию заболевания печени и опухоли, секретирующие вазоактивные пептиды.
Правильная и своевременная диагностика ОСН, оценка причины развития ОСН и выбор тактики лечения, исходя из клинической ситуации, могут привести к быстрому наступлению адекватной и стойкой компенсации состояния при минимальных потерях.
Список литературы
1. Nieminen M.S., Bohm M., Cowie M.R. et al. Executive summary of the guidelines on the diagnosis and treatment of acute heart failure (Task Force on Acute Heart Failure of the European Society of Cardiology) // Eur. Heart J. — 2005. — 26. — Р. 384-416.
2. Felker G.M., Adams K.F., Konstam M.A. et al. The problem decompensated heart failure: nomenclature, classification, and risk stratification // Am. Heart J. — 2003. — 145. — S18-25.
3. Cleland J.G., Swedberg K., Follath F. et al. The EuroHeart Failure survey programme-a survey on the quality of care among patients with heart failure in Europe. Part 1: Patient characteristics and diagnosis // Eur. Heart J. — 2003. — 24 (5). — 442-463.
4. Fox K.F., Cowie M.R., Wood D.A. et al. Coronary artery disease as the cause of incident heart failure in the population // Eur. Heart J. — 2001. — 22 (3). — 228-236.
5. MosessoV.N., Dunford J., Blackwel T. et al. Prehospital therapy for acute congestive heart failure: state of the art // Prehosp. Emerg. Care. — 2003. — 7 (1). — 13-23.
6. Cowie M.R., Mosterd A., Wood D.A. et al. The epidemiology of heart failure // Eur. Heart J. — 1997. — 18. — Р. 208-225.
7. Lopez de Sa E., Lopez-Sendon J., Anguera I. et al. Prognostic value clinical variables at presentation in pacients with non-ST-segment elevation acute coronary syndromes: results of the Proyecto de Estudio del Pronostico de la Angina (PERA) // Medicine (Baltimore). — 2002. — 81. — S434-442.
8. Stevenson R., Ranjadayalan K., Wilkinson P. et al. Short and long term prognosis of acute myocardial infarction since introduction of thrombolysis // BMJ. — 1993. — 307 (6900). — 349-353.
9. Roguin A., Behar D., Ben Ami H. et al. Long-term prognosis of acute pulmonary oedema — an ominous outcome // Eur. J. Heart Fail. — 2000. — 2. — 137-144.
10. Fonarow G.C., Stevenson L.W., Walden J.A. et al. Impact of a comprehensive heart failure management program on hospital readmission and functional status of patients with advanced heart failure // J. Am. Coll. Cardiol. — 1997. — 30. — 725-732.
11. Krumhols M.H., Fonarov G.C. The treatment target in acute decompensated heart failure // Rev. Cardiovasc. Med. — 2001. — 2 (Suppl. 2). — S7-12.
12. Krumholz H.M., Chlen J., Murillo J.E. et al. Admission to hospitals with on-site cardiac cateterization facities: impact long-term costs and outcomes // Circulation. — 1998. — 98. — 2010-2016.
13. Cowie M.R., Wood D.A., Coats A.J. et al. Incidence and aetiology of heart failure; a population-bazed stady // Eur. Heart J. — 1999. — 20. — 421-428.
14. McAlister F.A., Lawson F.M., Teo K.K., Armstrong A. Systematic review of randomized trials of disease management programs in heart failure // Am. J. Med. — 2001. — 110. — 378-384.
15. Rich M.V., Beckham V., Wittenberg C. A multidisciplinary intervention to prevent the readmission of elderly patients with congestive heart failure // Nengl. J. Med. — 1995. — 333. — 1190-1195.
16. Braunwald E.
17. Wijns W., Vatner S.F., Camici P.G. Hibernatiting myocardium // N. Engl. J. Med. — 1998. — 339. — 173-181.
18. Van de Werf F.
19. Fuster V.
20. Boli R. Basik and clinical aspects of myocardialstunning // Prog. Cardiovasc. Dis. — 1998. — 40. — 477-516.
21. Atar D., Gao W.D., Marban E. Alterations of excitation-contraction coupling in stunned myocardium and in failing myocardium // J. Mol. Cell. Cardiol. — 1995. — 27. — 783-791.
22. Tousignant C.P., Walsh F., Maser C.D. The use of transesophageal echocardiography for preload assessment in critically ill patiens // Anesth. Analg. — 2000. — 90. — 351-355.
23. Jardin F., Valtier B., Beauchet A., Dubourg O., Bourdarias J.P. Invasive monitoring combined with two-dimensional echocardiographic study in septic shock // Intensive. Care Med. — 1994. — 20. — 550-554.
24. Nishimura R.A., Tajik A.J. Determination of left-sided pressure gradients by utilizing Doppler aortic and mitral regurgitant signals: validation by simultaneous dual catheter and Doppler studies // J. Am. Coll. Cardiol. — 1988. — 11. — 317-321.
25. Maisel A.S., Krischnaswarny P., Novak R.M. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure // N. Engl. Med. — 2002. — 347. — 163-167.
26. Dao Q., Krischnaswarny P., Kazanegra R. Utility of B-type natriuretic peptide in the diagnosis of congestive heart failure in an urgentcare setting // J. Am. Coll. Cardiol. — 2001. — 37. — 379-385.
27. Cowie M.R., Jourdin P., Maisel A. et al. Clinical applications of B-type natriuretic peptide (BNP) testing // Eur. Heart J. — 2003. — 24. — 1710-1718.
28. Rawles J.M., Kenmure A.C. Controlled trial of oxygen in uncomplicated myocardial infarction // BMJ. — 1976. — 1. — 1121-1123.
29. Marik P.E. Pulmonary artery catheterization and esophageal Doppler monitoring in the ICU // Chest. — 1999. — 116. — 1085-1091.
30. Zion M.M., Balkin J., Rosenmann D. et al. Use of pulmonary artery catheters in patients with acute myocardial infarction. Analysis of experience in 5,841 patients in the SPRINT Registry. SPRINT Study Group // Chest. — 1990. — 98. — 1331-1335.
31. Connors A.F. Jr., Speroff T., Dawson N.V. et al. The effectiveness of right heart catheterization in the initial care of critically ill patients. Support Investigators // JAMA. — 1996. — 276. — 889-897.
32. Ivanov R., Allen J., Calvin J.E. The incidence of major morbidity in critically ill patients managed with pulmonary artery catheters: a meta-analysis // Crit. Care Med. — 2000. — 28. — 615-619.
33. Killip T., Kimbal J.T. Triatment of miocardial infarction in a coronary care unit a two year experientse with 250 patients // Am. J. Cardiol. — 1967. — 20. — 457-464.
34. Nochria A., Fang J.S. Clinical assessment identifiens hemodinamic profiles that predict outcomes in patients admitted with heart failure // JASS. — 2003. — 41. — 1797-1804.
35. Cotter G., Moshkovitz Y., Milovanov O. et al. Acute heart failure: a novel approach to its patogenesis and treatment. — 2002. — 4. — 227-234.
36. Weisman H.F., Healy B. Miocardial infarct expansion, infarct extension, and reinfarction: patophysiologic concepts // Prog. Cardiovasc. Dis. — 1987. — 30. — 73-110.
37. Filippatos G.S., Gangopadhyay N., Lalude O. et al. Regulation of apoptosis by vasoactive peptides // Am. J. Physiol. Lung. Cell. Mol. Physiol. — 2001. — 281. — L749-L761.
38. Hollenberg S.M., Kavinsky C.J., Parrillo J.E. Cardiogenic shock // Ann. Intern. Med. — 1999. — 131. — 47-59.
39. Bohm M., KL, Schnabel P., Zolk O. Transition from hypertrophy to failure-в-adrenergic desensitization of the heart // Heart Fail. Rev. — 1999. — 4. — 329-351.
40. Nochria A., Lewis E., Stevenson L.W. Medical management of advenced heart failure // JAMA. — 2002. — 287. — 628-640.
41. Grady K.L., Kennedy G., Moser D.K., Piano M., Stevenson L.W. AHA Scienttific Statement: Team management of pacients with heart failure: A Statement of health care professional from the cardiovascular nursing council of the American Heart Associacion // Circulation. — 2000. — 1002. — 2443-2456.
