Понятие об остром коронарном синдроме стало активно применяться учеными-кардиологами и клиницистами с начала 90-х годов. Возникновение этого термина связано с появлением новых данных о механизмах «обострения» ишемической болезни сердца, синтезом и внедрением в клинику новых групп фармакологических препаратов, изменением взглядов на тактику ведения больных с острой коронарной недостаточностью.
Термин «острый коронарный синдром» (ОКС) является объединяющим понятием и отражает единый патогенез большой группы клинических ситуаций в неотложной кардиологии. Возможны следующие варианты манифестации ОКС [2]:
— нестабильная стенокардия;
— инфаркт миокарда (ИМ) без зубца Q;
— инфаркт миокарда с зубцом Q.
Морфологической основой ОКС являются атеросклеротические бляшки с последующим формированием пристеночного или окклюзирующего тромба. Эти повреждения зависят от стадии развития и морфологических особенностей атеросклеротических бляшек.
На относительно ранних этапах они содержат большое, асимметрично расположенное (относительно размера всей бляшки) ядро с большим количеством липидов и макрофагов, с тонкой, содержащей незначительное количество коллагена покрышкой (верхняя часть фиброзной капсулы бляшки, обращенная в просвет сосуда). Это так называемые ранимые бляшки, которые занимают лишь небольшую часть диаметра сосуда, то есть являются эксцентрическими [14]. Благодаря своей эластичности и небольшим размерам, они обычно не вызывают гемодинамически значимого сужения артерий и нередко не выявляются при ангиографии.
Пусковым механизмом повреждения нестабильных атеросклеротических бляшек могут служить гемодинамические факторы (повышение или резкое изменение артериального давления, повышение частоты и силы сердечных сокращений, спазм, компрессия и растяжение сосудов), приводящие к так называемой усталости фиброзной капсулы бляшки.
Нарушение целостности атеросклеротической капсулы (эрозия, трещина, надрыв, разрыв) приводит к контакту высокотромбогенных субэндотелиальных структур и содержимого бляшки с клетками крови и неизбежному образованию тромба с частичной или полной окклюзией сосуда. Тромбоцитарные агрегаты представляют собой скопления активных тромбоцитов с экспонированными IIb/IIIa рецепторами, способных адгезировать к лопнувшим бляшкам в системном кровотоке. Этот процесс получил название атеротромбоза [15].
Важную роль в прогрессировании атеросклероза и развитии его осложнений играет также воспалительный ответ в области атеросклеротической бляшки. При этом гладкомышечные клетки сосудов приобретают некоторые свойства макрофага, в том числе способность к продукции провоспалительных хемокинов и хемоаттрактантов, а также к секреции протеаз и пролиферации. Индукторами воспалительного ответа служат свободные радикалы, реактогенные формы кислорода, а также окисленные липопротеиды низкой плотности (ЛПНП) [16]. Результатом их воздействия является формирование уязвимой атеросклеротической бляшки. В пользу воспалительной теории атерогенеза свидетельствует повышение в крови больных ИБС концентрации белков острой фазы, прежде всего С?реактивного белка [8].
Клинические проявления при этом зависят от локализации процесса (сосуды головного мозга, коронарные артерии сердца или периферические артерии конечностей), от диаметра окклюзированного сосуда, степени и продолжительности окклюзии, своевременности и эффективности лечебных мероприятий. При пристеночном тромбозе в коронарных артериях развивается острый коронарный синдром (нестабильная стенокардия и ИМ без зубца Q), при полной обтурации тромбом коронарной артерии — ИМ с зубцом Q.
С помощью интракоронарного ультразвукового исследования установлено, что у больных ОКС наряду с наличием атероматозной бляшки, осложненной разрывом и последующим тромбозом артерии, существуют уязвимые бляшки с разной степенью развития и других локализаций, в том числе в артериях, не имеющих отношения к актуальному событию [5]. Именно эти бляшки в зависимости от того, проводится ли больному эффективная профилактика повторных разрывов бляшек или нет, и могут служить причиной повторных острых коронарных событий (внезапная смерть, острый ИМ, нестабильная стенокардия). Поэтому больные ОКС нуждаются в длительном лечении, способном уменьшить риск повторных обострений заболевания.
За прошедшие десять лет в рандомизированных клинических исследованиях (4S, WOSCOPS, CARE, LIPID, HPS, MAAS) показано, что регулярный прием статинов в течение 5–6 лет уменьшает число повторных осложнений ИБС (острого ИМ, нестабильной стенокардии и смертельных исходов на 25–40 %, а ишемических инсультов — на 25–30 %. Эти впечатляющие достижения ассоциировались со снижением общего холестерина (ОХС) и холестерина липопротеидов низкой плотности (ХС ЛПНП) на 25–30 % и 30–35 % соответственно [1, 12].
Полученные положительные результаты объясняются, прежде всего, стабилизацией атеросклеротической бляшки, предотвращением ее повреждения и формирования тромбоза за счет гиполипидемических и так называемых плейотропных (не связанных со снижением ХС и ХС ЛПНП) эффектов. К этим эффектам в настоящее время относят противовоспалительный, антитромботический, антитромбоцитарный и нормализующий функциональное состояние эндотелия.
Известно, что на протяжении нескольких недель после инфаркта миокарда концентрация липидов в крови ниже их обычного уровня [14]. Но в первые сутки после возникновения острого коронарного синдрома концентрация липидов еще не успевает измениться и соответствует истинному ее значению у больного.
Признание разрыва ранимой бляшки основным патофизиологическим механизмом, инициирующим острые коронарные синдромы и способность ингибиторов ГМГ-КоА-редуктазы воздействовать на различные патогенетические звенья его возникновения, послужило еще одним аргументом в пользу применения статинов в острой стадии ИБС [7, 18].
Ингибиторы ГМГ-КоА-редуктазы (статины) обладают многосторонними эффектами:
1) восстанавливают нарушенную барьерную функцию эндотелия, подавляют оксидативный стресс, ведущий к модификации липопротеидов низкой плотности; последние, в свою очередь, активируют макрофаги, способствуя усилению захвата и внедрению ЛПНП в подинтимальное пространство, продукции воспалительных протромботических субстанций и металлопротеаз; усиливают обратный захват эфиров холестерина из атеросклеротической бляшки для транспортировки их в печень, способствуя меньшей подверженности атером разрывам;
2) подавляют асептическое воспаление артерий;
3) подавляют выработку металлопротеаз, вызывающих деградацию фиброзной оболочки бляшки и тем самым предотвращают разрыв покрышки бляшки;
4) усиливают вазодилатируюшие свойства венечных артерий, приводя к усилению коронарного кровотока, увеличению коронарного резерва, снижению периферического сопротивления венечных артерий и усилению перфузии миокарда [16].
Уровень ХС ЛПНП наиболее эффективно снижается статинами. Снижение уровня ХС ЛПНП приводит к ослаблению воспалительного ответа, то есть к подавлению синтеза медиаторов воспаления, что в итоге стабилизирует бляшку и препятствует локальному тромбозу.
Для стабилизации бляшки требуется от 4 до 8 нед., однако действие статинов на процессы нормализации нарушенных функций эндотелия и механизмы тромбообразования, характерные для атеросклероза, проявляется быстрее [11]. Содержание холестерина в крови после эпизода обострения ИБС обычно снижается и возвращается к исходному примерно через 3 мес. Однако лечение больных статинами с различными формами ОКС должно начинаться с первых дней поступления в стационар и продолжаться неопределенно долго.
Назначение статинов в стационаре, когда больной психологически наиболее восприимчив к рекомендациям лечащих врачей, может увеличить количество пациентов, регулярно принимающих эти средства после выписки из стационара. Именно в этот период пациенты психологически наиболее готовы осознать необходимость применения профилактических вмешательств, способных предупредить рецидив обострения и преждевременную смерть.
Подтверждение этим положениям дали результаты регистра нестабильной стенокардии PREVENIR во Франции. Обследовано более 1400 больных ИБС перед выпиской из стационара после госпитализации в связи с нестабильной стенокардией. К тому времени (1998 г.) это состояние уже рассматривалось как показание к применению статинов. Спустя полгода больные были обследованы повторно. Среди тех, кто получал статины при выписке из больницы, 95,5 % продолжали их принимать. Из тех же, кто при выписке статинов не получал (но кому, как уже было отмечено, он был показан) только 14 % принимали один из препаратов этой группы [13]. Но это только наиболее практически важная, но не единственная причина назначения статинов при ОКС.
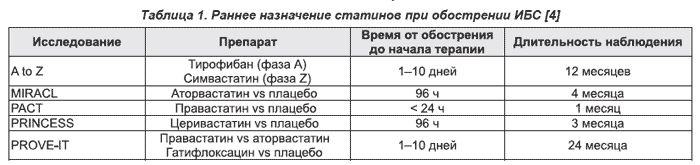
Изучению безопасности и эффективности статинов у больных с острым коронарным синдромом в разные сроки после его возникновения посвящено большое количество исследований (табл. 1).
В исследовании MIRACL (Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering) было обследовано 3086 больных 18 лет и старше в первые 24–96 часов после возникновения ОКС (нестабильная стенокардия или инфаркт миокарда без зубца Q), которые были рандомизированы к приему плацебо или аторвастатина в дозе 80 мг/сутки в течение 16 недель. Первичными конечными точками были смерть, нефатальный инфаркт миокарда, остановка сердца с реанимацией, документированная повторная симптоматическая ишемия с необходимостью повторной госпитализации. Средний уровень ХС ЛПНП в группе аторвастатина снизился на 40 % до 72 мг/дл, что существенно ниже целевого значения ХС ЛПНП, рекомендуемого больным ИБС (менее 115 или 100 мг/дл, 3,0 или 2,6 ммоль/л) [21].
Общее количество первичных конечных точек в группе аторвастатина оказалось достоверно меньше, чем в группе плацебо (14,8 и 17,4 % соответственно, p = 0,048) за счет достоверного снижения риска документированной симптоматической ишемии с необходимостью повторной госпитализации: 6,2 % в группе аторвастатина и 8,4 % в группе плацебо, p = 0,02. Интересно, что между двумя изучавшимися группами была найдена достоверная разница в частоте случаев мозгового инсульта (12 случаев против 14, p = 0,045).
Эти данные прежде всего свидетельствуют о безопасности начала терапии ингибиторами ГМГ-КоА-редуктазы, приводящей к выраженному снижению уровней липидов, в период госпитализации в связи с развитием острого коронарного синдрома, и о способности статинов (в частности аторвастатина) благоприятно влиять на прогноз непосредственно после обострения ИБС.
Для включения в это исследование не было ограничений (нижнего лимита) по исходному уровню ОХС и ХС ЛПНП, в то время как по результатам исследований SYMPHONY и SYMPHONY-2 отмечался дополнительный положительный эффект от раннего назначения статинов при ОКС у пациентов с гиперхолестеринемией и его отсутствие и даже вред при низком исходном уровне холестерина [17]. Это обстоятельство объясняется тем, что именно плейотропные свойства статинов при ОКС могут вызвать как положительные, так и вредные эффекты. Положительный эффект обусловлен у этих пациентов их противовоспалительными, антитромбоцитарными и антитромботическими свойствами статинов [23]. Но их способность за короткий срок ингибировать гладкомышечные клетки и, следовательно, синтез коллагена и эластина, может приводить к дальнейшей дестабилизации бляшки и замедлению процесса заживления. Установить, где находится баланс между этими эффектами и тем более управлять ими в настоящее время не представляется возможным.
Недавние исследования показали, что противовоспалительный эффект статинов (снижение С-реактивного белка) проявляется уже в течение первых недель (между 7-м и 14-м днем), и этот эффект не связан со снижением уровня ХС ЛПНП. Этим обстоятельством объясняется относительно быстрое наступление клинического эффекта при применении статинов, особенно при ОКС: смертность по результатам изучения Шведского регистра при назначении статинов достоверно снижалась на 30, 60, 90-й дни и через 1 год. Через 1 год по всей группе риск смерти снизился на 57 %.
Одним из немногих законченных на сегодняшний день многоцентровых исследований, где начало терапии статином приходилось на первые сутки после развития ОКС, было исследование PACT (Pravastatin Acute Coronary Treatment). Кроме того, исследование предполагало самый короткий срок лечения и наблюдения — 30 дней после рандомизации.
Больные рандомизировались в две группы: получающих правастатин по 40 мг в день или плацебо. Часть больных в начале исследования получали по 20 мг правастатина. Лечение в рамках протокола осуществлялось в течение 4 недель, а дальнейшая терапия — по усмотрению лечащих врачей. В первичную комбинированную конечную точку входили: смерть от любых причин, ОИМ (исключая послуживший поводом для включения), повторная госпитализация в связи с нестабильной стенокардией в первый месяц после рандомизации. Всего было обследовано 3408 пациентов.
За 30 дней наблюдения зарегистрировано 410 конечных точек, включая 128 ИМ, 249 госпитализаций в связи с повторным эпизодом нестабильной стенокардии и 33 смерти. Абсолютное снижение риска для первичной конечной точки в группе правастатина составило 0,8 % (95% ДИ –1,4; 3,0), а относительное снижение риска — 6,4 % (–13,2; 27,6) с большим доверительным интервалом. Эффект правастатина и плацебо на композитную конечную точку — смерть, ИМ, возобновление нестабильной стенокардии — был несколько больше в группе правастатина, но статистической достоверности этих различий не получено [4].
При ретроспективном анализе после разделения группы пациентов, принимавших правастатин, по дозам был выявлен более выраженный эффект в подгруппе, принимавших по 40 мг.
Задачей исследования A to Z — Z-фазы, проводившегося с 1999 по 2003 год, было сравнение эффективности двух подходов при ОКС для ответа на два вопроса:
а) насколько эффективно и безопасно назначение симвастатина в первые дни после развития ОКС;
б) насколько эффективна стратегия максимально агрессивной гиполипидемической терапии после эпизода ОКС [9].
В Z-фазу международного рандомизированного двойного слепого исследования включались пациенты с любым ОКС и рандомизировались либо к приему симвастатина в дозе 40 мг до 5-х суток от развития ОКС с увеличением дозы через 30 дней до 80 мг/сутки (n = 2265), либо к приему плацебо (n = 2232), через 4 месяца заменявшегося 20 мг симвастатина.
Однако среди пациентов с ОКС раннее назначение активной терапии симвастатином существенного уменьшения частоты основных коронарных событий не отмечалось — имелась только положительная тенденция к уменьшению.
Наиболее вероятными причинами негативного результата A to Z исследователи называют [10]: недостаточное число конечных точек (~ 600 вместо планируемых 900, необходимых для адекватной статистической силы полученных данных); более «агрессивную» антитромботическую терапию и частоту инвазивных процедур, чем в других аналогичных работах, что «нивелировало» эффект статина (тирофибан получало подавляющее число пациентов A to Z, 50 % из них подверглись инвазивной реваскуляризации). Кроме того, уровень ХС ЛПНП в группе контроля A to Z был существенно ниже, чем в группе «правастатина» в исследовании PROVE IT, а начало терапии начиналось не с максимальной дозы (в отличие от PROVE IT и MIRACLE). При этом в группах активного гиполипидемического вмешательства в обоих исследованиях достигнутые уровни ЛПНП оказались примерно одинаковы.
В последние годы завершено несколько специальных контролируемых исследований, подтвердивших необходимость назначения статинов при ОКС одновременно с аспирином, антикоагулянтами и b-адреноблокаторами. Прогрессирование дисфункции эндотелия считают одним из первых этапов формирования уязвимой атеросклеротической бляшки — основного субстрата ОКС. В исследовании RECIFE изучали влияние правастатина на эндотелийзависимую вазодилатацию, которую оценивали по изменению диаметра плечевой артерии в ответ на прием нитроглицерина с помощью ультразвуковой допплерографии. Были рандомизированы 60 больных c острым инфарктом миокарда или нестабильной стенокардией с уровнем общего холестерина более 5,2 ммоль/л и холестерина ЛПНП более 3,4 ммоль/л. В течение 6 недель им проводили терапию правастатином или плацебо. Под действием правастатина сывороточные уровни общего холестерина и ЛПНП снизились соответственно на 23 % (р < 0,05) и 33 % (р < 0,01). При лечении правастатином было выявлено достоверное увеличение потокзависимой дилатации плечевой артерии на 42 % (р = 0,02) [13]. Таким образом, полученные данные продемонстрировали возможность коррекции эндотелиальной дисфункции с помощью статинов у больных ОКС. L. Correia и соавт. применяли аторвастатин 80 мг/сут. или плацебо у пациентов с ОКС. При лечении аторвастатином не было отмечено повышения концентрации С-реактивного белка. В плацебо-контролируемом исследовании L-CAD изучали эффективность правастатина у больных, перенесших за несколько дней до включения острый инфаркт миокарда или чрескожную транслюминальную ангиопластику по поводу нестабильной стенокардии. Оценивали суммарную частоту смерти от любых причин, сердечно-сосудистой смерти, нефатального острого инфаркта миокарда, инсульта, новых случаев атеросклеротического поражения периферических артерий и инвазивных вмешательств на коронарных артериях. Исходно и через 6 и 24 месяца выполняли коронарную ангиографию. Через 24 месяца было отмечено достоверное уменьшение частоты комбинированной конечной точки у больных, получавших правастатин. Кроме того, в этой группе выявили значительное увеличение диаметра просвета пораженной коронарной артерии, которое отсутствовало у пациентов, принимавших плацебо.
В 2004 году были представлены результаты исследования PROVE-IT, в котором больные с ОКС получали правастатин в стандартной (40 мг/сут.) дозе или аторвастатин в высокой (80 мг/сут.) дозе. Целевой уровень ЛПНП в группе правастатина соответствовал таковому в международных рекомендациях (менее 2,5 ммоль/л, или 100 мг/дл). У больных, принимавших аторвастатин, стремились к более низким величинам этого показателя (1,7 ммоль/л, или 70 мг/дл) [3]. В течение 2 лет оценивали частоту комбинированной конечной точки, включавшей в себя смерть от любых причин, приступы стенокардии, нестабильную стенокардию, инсульт и коронарную реваскуляризацию. Целевые значения ЛПНП были достигнуты в обеих группах, однако лечение аторвастатином, которое обеспечивало более выраженное снижение уровня ЛПНП, привело к достоверному уменьшению частоты комбинированной конечной точки на 16 % по сравнению с правастатином.
Но, как и ожидалось, в группе леченых аторвастатином чаще встречались побочные эффекты: в 3 раза чаще, чем в группе леченых правастатином в умеренных дозах, имело место 3-кратное по сравнению с нормой повышение печеночных трансаминаз; 3,3 % пациентов были вынуждены прекратить прием высоких доз аторвастатина из-за миалгии или же повышения уровня креатинкиназы [6].
Следовательно, для того чтобы учитывать риск осложнений при назначении высоких доз статинов, необходимо тщательное мониторирование состояния пациентов, особенно функционального состояния печени.
Таким образом, после стабилизации состояния пациента основные усилия должны быть направлены на вторичную профилактику атеросклероза и ИБС:
1) уменьшение риска дальнейшего прогрессирования атеросклероза и предупреждение осложнений ИБС;
2) антиангинальную терапию в случае сохранения стенокардии.
У больных ОКС без подъема сегмента ST должна быть начата терапия статинами. Целевыми считаются уровни общего холестерина менее 4,5 ммоль/л (175 мг/дл), холестерина ЛПНП менее 2,5 ммоль/л (100 мг/дл).
Целесообразно уже в остром периоде оценить показания к гиполипидемической терапии и при необходимости подобрать адекватную дозу статина (уровень общего холестерина во всех случаях не должен превышать 5 ммоль/л, содержание холестерина ЛПНП в крови — 2,6–3 ммоль/л). К статинам с доказанной эффективностью относятся: аторвастатин (10–80 мг/сут.), правастатин (10–40 мг/сут.), флувастатин (20–80 мг/сут.), симвастатин (10–40 мг/сут.), ловастатин (10–40 мг/сут.).
По результатам наших исследований (В.И. Волков, Л.Н. Яковлева, Т.Н. Бондарь и др.), терапия симвастатином в дозе 20–40 мг уже через 2 недели обеспечила увеличение содержания нитрита и нитрата на 18 и 14 % соответственно (p < 0,05) в сочетании с повышением уровня SH-групп на 11 % (p < 0,05) и уменьшением малонового диальдегида (МДА) на 21 % (p < 0,05), что свидетельствует о повышении синтеза и стабильности эндогенного NO. Увеличение образования эндотелиального оксида азота неразрывно связано с улучшением параметров, характеризующих функциональное состояния эндотелия: по результатам ПРГ прирост диаметра плечевой артерии увеличился на 7 %, (p < 0,01) через 2 недели лечения.
В этот же срок терапии следует отметить разрушение корреляционной связи между (NO2 + NO3) и металлопротеиназой-9 (ММП-9). Поскольку такая связь в контрольной группе сохранялась на протяжении всего периода наблюдения и дополнялась связью (NO2 + NO3) с МДА и С-реактивным белком (СРБ), можно предположить, что источником роста этого показателя (NO2 + NO3) у больных контрольной группы является индуцибельное звено, а у больных, получавших симвастатин, — конститутивное.
Через 4 недели лечения выявлены достоверное снижение общего ХС и ХС ЛПНП, СРБ, ММП-9 и дальнейшая нормализация функционального состояния эндотелия (по пробе с РГ). В этот срок отмечено достоверное (на 30 с) увеличение времени до развития ишемических смещений сегмента ST (Т2), установлена обратная корреляционная зависимость между Т2, уровнем СРБ и между Т2 и ХС ЛПНП, то есть антиишемический эффект статинов связан с развитием гиполипидемического и противовоспалительного эффектов. В этот же срок наблюдения проявился также антиагрегационный эффект статинов (по снижению суммарного индекса АДФ-индуцированной агрегации тромбоцитов). Кроме того, симвастатин у больных ОКС без подьема сегмента ST в дозе 40 мг в сутки через 4 недели вызывал уменьшение сывороточной концентрации СРБ и ММП-9, что свидетельствует о наличии у препарата плейотропных свойств.
Следовательно, положительное влияние статинов на прогноз и целесообразность их назначения при ОКС можно считать доказанными уже сегодня. Использование статинов в практике ведения пациентов с ОКС позволяет существенно снизить риск неблагоприятных исходов в острый период, а продолжение их приема на амбулаторном этапе — уменьшить вероятность рецидивов обострений ИБС.
Комментарий автора
К настоящему времени выяснено, что быстрое снижение уровня ХС ЛПНП при обострении коронарной болезни сердца (КБС),то есть при остром коронарном синдроме возможно и безопасно. В частности установлено, что раннее назначение симвастатина существенно ускоряет проявление его гиполипидемического эффекта и достижение больными целевого уровня ХС ЛПНП. Так, в одном из исследований, в которое были включены 150 больных с острым коронарным синдромом (инфаркт миокарда, нестабильная стенокардия) пациенты были разделены на две группы. В одной они сразу, уже в период госпитализации, получали симвастатин в дозе 40 мг/сут, в другой — в течение 3 месяцев находились на гиполипидемической диете. В результате у пациентов первой группы уровень ХС ЛПНП к концу 3-го месяца снизился в два раза до среднего уровня 2,28 ммоль/л, и у 82 % из них был достигнут целевой уровень ХС ЛПНП (3,0 ммоль/л). В группе сравнения ХС ЛПНП за это время не изменился. Снижение ХС ЛПНП в этом исследовании не сопровождалось какими-либо специфическими побочными явлениями (повышение активности печеночных ферментов, миалгии). Безопасность раннего применения продемонстрирована и в ряде клинических испытаний других статинов (правастатина, аторвастатина).
В настоящее время имеются неоспоримые доказательства выраженного снижения риска осложнений КБС при использовании статинов. Поэтому нельзя упускать любую возможность для увеличения числа больных, использующих достоинства статинов. Одна из таких реальных возможностей — раннее назначение этих средств при острых коронарных синдромах. В Москве такое назначение целесообразно и по следующей причине: после перенесенного инфаркта миокарда больные бесплатно обеспечиваются некоторыми статинами (в частности симвастатином) в течение 6 месяцев, и больным надо дать шанс полностью использовать эту льготу.
Вышеперечисленные процессы приводят к формированию атеросклеротических бляшек, которые в зависимости от состава могут отличаться той или иной степенью предрасположенности к разрыву («ранимостью»).
Бляшки без липидов или с минимальным их содержанием, состоящие преимущественно из фиброзной и склеротической ткани, характеризуются как фиброзные, а с умеренным или высоким содержанием жиров — как липидные. Показано, что фиброзные бляшки преобладают у больных со стабильной стенокардией (90 %), а липидные — у больных со стенокардией покоя (81 %). Основная причина «ранимости» бляшек по P. Libby [17] — это то, что «в их капсуле (наружной покрышке) снижен синтез коллагена и повышено его разрушение». Наряду с преобладанием липидного ядра, истончением капсулы и изменением в ней количества коллагена, к факторам, от которых зависит подверженность бляшки разрыву, E. Falk и соавт. отнесли механическую «усталость» ее фиброзной оболочки. «Усталость — это результат длительного циклического напряжения под влиянием огромного числа периодов сжатия и растяжения» [10].
Еще одним фактором, ослабляющим капсулу, является воспаление внутри бляшки, сопровождающееся инфильтрацией ее покрышки макрофагами. Воспалительная реакция в последние годы признается одним из наиболее вероятных механизмов, способствующих ослаблению капсулы бляшки и последующему ее разрыву. Патоморфологическими исследованиями у больных с острым коронарным синдромом была подтверждена инфильтрация макрофагами атеросклеротических бляшек с разрывами [2, 6, 8]. Одно из этих исследований показало, что площадь, занятая макрофагами, в срезах бляшек больных с нестабильной стенокардией и инфарктом миокарда без зубца Q была соответственно в четыре и шесть раз больше, чем в аналогичном материале у больных со стабильной стенокардией [21].
По данным сравнительного гистопатологического исследования биоптатов бляшек-«виновников» (из стенозов, «ответственных» за обострения) и бляшек из других стенозов коронарных артерий у одного и того же больного, выяснилось, что бляшки-«виновники» характеризовались большим содержанием воспалительных и пенистых клеток, холестерина и наличием тромбоза [25]. Те же авторы на большом материале продемонстрировали зависимость между присутствием в биоптате макрофагов и наличием в нем тромба [23].
У больных с нестабильной стенокардией в системном кровотоке обнаружены такие признаки воспаления, как повышение уровней маркеров воспаления или реактантов острой фазы — С-реактивного протеина [3, 18], фибриногена [22], причем это повышение не зависит от того, сохраняются ли у больных эпизоды ишемии миокарда. Повышение уровня СРБ не могло быть объяснено наличием некроза миокарда, так как наблюдалось у больных с нормальным содержанием в крови креатинфосфокиназы и тропонина-Т.
В 1990 году В. Berk и соавт. [3] обнаружили, что увеличение концентрации СРБ наблюдается не только у пациентов с ИМ, но и у больных, страдающих нестабильной стенокардией (90 %), причем значительно чаще, чем при стабильной стенокардии (13 %). При этом у больных с нестабильной стенокардией (как и при ИМ) имеет место гиперпродукция интерлейкина-6 [4]. В 1994 году G. Liuzzo и соавт. [18], впервые использовав для определения СРБ высокочувствительный иммуноферментный метод, подтвердили, что концентрация СРБ увеличивается чаще при нестабильной (65 %), чем при стабильной (13 %) стенокардии, и привлекли внимание к прогностическому значению уровня СРБ у больных коронарным атеросклерозом. Ими было показано, что в подгруппе больных с тяжелой нестабильной стенокардией увеличение концентрации СРБ ассоциируется с рядом параметров, свидетельствующих о неблагоприятном прогнозе, таких как увеличение времени госпитализации пациентов, частота рецидивирования стенокардии и необходимость в аортокоронарном шунтировании, развитие ИМ и внезапной смерти. В этом исследовании было также установлено, что у больных с нестабильной стенокардией увеличение концентрации СРБ может наблюдаться при нормальном уровне тропонина-Т и, следовательно, не связано с некрозом миокарда. Эти данные были подтверждены и другими исследователями. Убедительные результаты, свидетельствующие о важном прогностическом значении СРБ, были получены F. Haverkate и соавт. [13], которые в рамках программы ЕСАТ (European Concerted Action on Thrombosis and Disability) обследовали 2121 больного (1030 человек с нестабильной стенокардией, 743 — со стабильной стенокардией), наблюдавшихся в 15 кардиологических центрах Западной Европы в течение двух лет. Увеличение концентрации СРБ, достоверно ассоциировавшееся с увеличением относительного риска сосудистых катастроф (внезапная смерть и ИМ) у больных как с нестабильной, так и со стабильной стенокардией, дает относительный риск развития ИБС, равный 1,55 [15].
«Целевые уровни» снижения ХС ЛПНП определены как 2,6 ммоль/л в США и 3,0 в Европе.
Предполагается, что в случае применения статинов могут действовать следующие механизмы стабилизации атеросклеротической бляшки:
— уменьшение объема липидного ядра (или стабилизация его размера);
— укрепление оболочки (покрышки) бляшки;
— противовоспалительный эффект — влияние на воспалительные элементы в бляшке;
— влияние на гладкомышечные клетки;
— влияние на синтез коллагена;
— влияние на локальную функцию эндотелия;
— уменьшение вероятности спастических реакций — триггеров разрыва.
Кроме того, статины вызывают следующие системные эффекты:
— улучшают функциональное состояние эндотелия — восстановление или улучшение эндотелийзависимой дилaтации;
— оказывают положительное влияние на реологические и тромбообразующие свойства крови;
— укрепляют оболочки бляшки, вероятно, за счет оказываемого ими противовоспалительного действия [16].
Атеросклеротические изменения сопровождаются прогрессирующей эндотелиальной дисфункцией, что может привести к патологической вазоконстрикции и стимулирует агрегацию тромбоцитов. Уменьшается синтез оксида азота и ослабляется ответ на его воздействие. При применении статинов отмечались значительное улучшение вазодилaтации и антитромботическое действие. Возможно, статины обладают защитными свойствами, зависящими не только от снижения уровня ХС ЛПНП.
Субанализ данных, полученных в исследовании CARE, показал корреляцию между повышенными признаками воспаления и риском развития инфаркта и инсульта. У пациентов, которые принимали статины, уровень СРБ был ниже на 38 %, чем у тех, кто получал плацебо. Этот факт служит подтверждением благоприятного противовоспалительного действия статинов. Способно ли раннее их применение оказать клинически значимое благоприятное влияние на прогноз у пациентов с острым коронарным синдромом? Этот вопрос в настоящее время изучается в рамках исследования PROVE-IT (Pravastatin or Atorvastatin Evaluation and Infection Therapy).
К сожалению, в ряде случаев отсутствие своевременно начатой липидснижающей терапии наряду с редкими медицинскими противопоказаниями обусловлено недоверием больных к данному лечению. При этом, как показывает опыт, инициализация лечения в остром периоде заболевания (при вторичной профилактике) позволяет значительно повысить процент положительных результатов.
Кроме улучшения показателей липидного обмена, чрезвычайно важна и возможность дополнительных положительных воздействий, которыми обладают препараты из группы статинов, а также доказанная безопасность тех из них, которые прошли тщательную проверку в ходе многочисленных многоцентровых исследований и хорошо зарекомендовали себя за долгие годы практического применения.
Как показывают исследования, положительное действие какого-либо медикаментозного препарата не может служить подтверждением эффективности всех лекарственных средств, относящихся к данному классу. Поэтому до получения результатов проводимых в настоящее время крупных рандомизированных исследований практическим врачам следует отдавать предпочтение препаратам, эффективность и безопасность которых научно доказана. Что касается гипохолестеринемических средств из группы статинов, то для вторичной профилактики больных с ишемической болезнью сердца прежде всего рекомендованы симвастатин и правастатин.
По современным представлениям, значение статинов во вторичной профилактике сердечно-сосудистых осложнений при ИБС не вызывает сомнения [3]. Результаты клинических исследований демонстрируют и пользу этих препаратов в первичной профилактике, по крайней мере у пациентов с сочетанием нескольких факторов риска [4]. Отмечается существенное снижение риска смерти и нефатального острого инфаркта миокарда через 30 дней после развития ОКС. Если статин отменяли, то вероятность неблагоприятного исхода возрастала в 2,93 раза (р = 0,005) и заметно превосходила увеличение риска в группе больных, не получавших препараты этой группы [28].
Исследование MIRACL — это первое крупное рандомизированное исследование, в котором специально изучалась эффективность статинов у 3086 больных нестабильной стенокардией или острым инфарктом миокарда без зубца Q. Лечение начинали в первые 24–96 часов после госпитализации. Первичной конечной точкой была частота случаев смерти, нефатального острого инфаркта миокарда, сердечной реанимации, рецидивов ишемии миокарда, требовавших повторной экстренной госпитализации. Продолжительность наблюдения составляла 16 недель. В группе аторвастатина частота комбинированной точки оказалась ниже (14,8 %), чем в группе плацебо (17,4 %, р = 0,048). Кроме того, прием аторвастатина привел к снижению риска рецидивов ишемии миокарда на 26 % (р = 0,02). В исследовании MIRACL было также подтверждено противовоспалительное действие статинов при ОКС. У больных, принимавших аторвастатин, выявили достоверное уменьшение концентрации сывороточных белков острой фазы — С-реактивного белка и сывороточного амилоида A (SAA). Этот эффект аторвастатина не зависел от исходного уровня ЛПНП и возраста пациентов. В какой степени следует снижать уровень ЛПНП у больных ОКС? Продолжается исследование A to Z, целью которого является изучение влияния блокатора IIв/IIIа рецепторов тирофибана (фаза А), симвастатина в низкой (20 мг) и высокой (80 мг) дозах (фаза Z), а также различных режимов сопутствующей терапии (эноксапарин + аспирин или нефракционированный гепарин + аспирин) на прогноз пациентов с ОКС. Эффективность симвастатина в фазе Z будет оцениваться на основании суммарной частоты сердечно-сосудистой смерти, острого инфаркта миокарда, рецидивов ОКС и инсульта. Фаза Z будет продолжаться до тех пор, пока общее число первичных конечных точек не достигнет 970. Не вызывает сомнения, что результаты исследования A to Z станут еще одним аргументом в пользу назначения статинов больным ОКС. Большой интерес вызывают возможные различия в эффективности различных доз симвастатина, а также влияние на нее сопутствующей терапии (блокатор IIb/IIIa рецепторов, нефракционированный или низкомолекулярный гепарин) и некоторых исходных характеристик пациентов (возраст, исходные величины общего холестерина и ЛПНП).

