Международный эндокринологический журнал 4 (36) 2011
Вернуться к номеру
Взаимосвязь степени инсулинорезистентности и уровня эндогенного кортизола у больных сахарным диабетом 2-го типа
Авторы: Черныш П.П., Акбаров З.С., Каюмов У.К., Хайдарова Ф.А., Максутова Н.Н., Ташкентский институт усовершенствования врачей, РСНПМЦ эндокринологии МЗ РУз, г. Ташкент, Узбекистан
Рубрики: Эндокринология
Версия для печати
Наследственный характер инсулинорезистентности у больных сахарным диабетом 2-го типа вызывает сомнения в силу имеющейся связи уровня кортизола в крови с клиническими проявлениями и осложнениями сахарного диабета 2-го типа.
41 пациенту с сахарным диабетом 2-го типа в стадии компенсации в дополнение к базисной сахароснижающей терапии проведено лечение перитолом в дозе 12 мг/сут как препаратом с антиглюкокортикоидным действием. При этом выявлено, что, понижая уровень эндогенного кортизола в крови, удается значительно снизить инсулинорезистентность, проявляющуюся уменьшением гликемии натощак, снижением уровня иммунореактивного инсулина, а также индексов HOMA-IR и HOMA-FB. Высказывается предположение, что именно эндогенный кортизол может быть ответственным за инсулинорезистентность больных сахарным диабетом 2-го типа.
Сахарный диабет 2-го типа, наследственность, инсулинорезистентность, кортизол.
В настоящее время общепризнанной патогенетической основой развития сахарного диабета (СД) 2-го типа считается сочетание инсулинорезистентности (ИР) и дисфункции b-клеток поджелудочной железы. Считается также, что ИР является первичной и наследственно обусловленной [1]. Этот факт настолько укоренился в медицине, что не вызывает никаких возражений. Утверждается, что генеалогические и популяционно-генетические исследования помогают даже установить тип наследования различных клинических форм СД, а также ответить на вопрос об их генетической самостоятельности или, иными словами, выделить нозологически самостоятельные формы болезни [4]. В данном контексте перспектива излечения или какого-то кардинального решения вопроса для больного СД 2-го типа выглядит неутешительно: ничего не поделаешь — это наследственно обусловлено, а следовательно, неизлечимо.
Имеющиеся литературные данные о взаимосвязи кортизола и СД 2-го типа позволяют усомниться в абсолютной справедливости этого тезиса. Взаимосвязь повышения уровня глюкозы и кортизола в крови подтверждена рядом исследований [10, 13], причем у больных СД 2-го типа с сопутствующими осложнениями (нефро-, нейро- и ангиопатией) достоверно чаще выявлялся повышенный уровень кортизола как в крови, так и в моче, ассоциировавшийся как со степенью компенсации диабета, так и с количеством осложнений [11]. В литературе имеются также данные о тесной связи гиперинсулинемии, гиперкортизолемии с абдоминальным ожирением [12] и метаболическим синдромом [15]. Именно это позволяет заподозрить эндогенный кортизол в качестве возможной причины ИР. Кроме того, предложенная нами в 2007 году новая концепция этиологии и патогенеза СД 2-го типа [8, 9] также во главу угла ставит именно кортизол как причину инсулинорезистентности.
В связи с этим целью настоящего исследования явилось изучение патогенетического влияния уровня эндогенного кортизола на выраженность ИР и состояние углеводного обмена у больных СД 2-го типа.
Материал и методы
Под наблюдением находился 41 больной (22 женщины и 19 мужчин) с СД 2-го типа средней степени тяжести в стадии компенсации или субкомпенсации без выраженных диабетических осложнений, в возрасте от 37 до 68 лет (средний возраст 52 года), со средней длительностью заболевания 4,8 года. Критериями исключения являлись: тяжелая неконтролируемая артериальная гипертензия (АД ≥ 200/110 мм рт.ст.), нефропатия с ХПН II стадии, стенокардия напряжения III–IV ФК, хроническая сердечная недостаточность II–IV ФК.
Обследование включало: измерение роста, массы тела, окружности талии (ОТ) и окружности бедер (ОБ), а также расчет индекса массы тела (ИМТ) по формуле:
ИМТ = МТ (кг)/Р (м)2,
где МТ — масса тела, Р — рост.
Характер распределения жировой ткани определяли по соотношению окружности талии и окружности бедер (ОТ/ОБ). Артериальное давление (АД) измерялось в покое в положении сидя, четыре раза на плечевой артерии (три раза на правой руке, один раз на левой).
Взятие крови для исследований гормонального статуса проводилось из локтевой вены утром натощак в пробирки. Уровень гормонов определялся при помощи радиоиммунологического метода с использованием стандартных наборов IMMUNOTECH (Чехия). Всем пациентам определяли уровни тиреотропного гормона, иммунореактивного инсулина (ИРИ), АКТГ и кортизола.
Концентрацию глюкозы в капиллярной крови определяли глюкозооксидазным методом натощак и через 2 часа после приема пищи. Уровень гликозилированного гемоглобина (HbA1c) определяли колориметрическим методом по R. Flutchiger, K.H. Winterhalter (1976) в модификации E.C. Abraham и соавт. (1978).
ИР и функциональная активность b-клеток поджелудочной железы оценивалась с использованием индексов HOMA-IR и HOMA-FB. Расчет проводился по следующим формулам [14]:
НОМА-IR = инсулин сыворотки натощак (мкЕД/мл) ´´ глюкоза плазмы натощак (ммоль/л)/22,5;
HOMA-FB = (20 х ИРИ (мкЕД/мл))/(гликемия натощак (ммоль/л) – 3,5).
Для снижения уровня кортизола в крови использовался препарат перитол (ципрогептадин) производства фирмы «Эгис», Венгрия. Он назначался дополнительно к базисной индивидуально подобранной сахароснижающей терапии в дозе 12 мг/сут. Продолжительность терапии перитолом составляла около 9 месяцев. Контрольные визиты пациентов осуществлялись на 14-й день от начала приема препарата и в дальнейшем — 1 раз в месяц. При этом проводилось определение АД, массы тела, ОТ и ОБ, повторно определяли уровень гликемии натощак, липидов (холестерин, триглицериды, ЛПВП, ЛПНП, ЛПОНП), содержание кортизола, АКТГ, инсулина, HbA1c, гликемического профиля.
Статистическая обработка результатов проводилась с помощью пакетов прикладных программ STATISTICA 6.0 и SPSS Statistics 17.0.
Результаты исследования и их обсуждение
Если полагать, что резистентность к инсулину является наследственно обусловленной и связана с мутацией гена, то какой-либо физиологический фактор не должен влиять на выраженность фенотипических проявлений, во всяком случае значимо. В противном случае это означало бы, что фактор влияет на степень экспрессии генов, однако обычно действие мутантного гена не «затушевывается» многочисленными взаимодействиями его продукта с продуктами других генов или с факторами окружающей среды [3], следовательно, изменение уровня эндогенного кортизола, особенно в границах обще- принятой нормы, не должно повлиять на выраженность ИР, а также на показатели углеводного обмена.
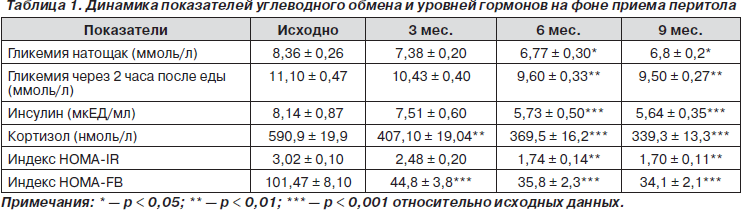
Снижение уровня кортизола (на 20 % от исходного) стало наблюдаться уже после первого месяца приема перитола и продолжало снижаться в течение всего периода наблюдения, достигнув минимальных значений к 9-му месяцу. Вместе с этим стали изменяться и показатели гликемии натощак, индексы HOMA-IR и HOMA-FB (табл. 1). Базисная сахароснижающая терапия при этом оставалась в прежнем объеме.
Из табл. 1 видно, что начало изменений содержания инсулина в крови и показателей углеводного обмена происходило не одновременно со снижением концентрации кортизола, а отставало примерно на два месяца. Причина такой диссоциации вначале была неясна. Ответ подсказало следующее обстоятельство. Мы обратили внимание, что, несмотря на продолжающееся снижение уровня кортизола в крови к 9-му месяцу, снижение показателей индексов НОМА, утренней и постпрандиальной гликемии, а также уровня инсулина прекратилось, и они достоверно не отличались от соответствующих показателей на 6-м месяце приема перитола. Объяснением этому факту могло служить только то, что состояние углеводного обмена зависит не только и не столько от самого снижения кортизола, сколько от достижения его определенного уровня в крови. На это указывало то, что показатели гликемии, уровня ИРИ, а также выраженности инсулинорезистентности (индекс НОМА-IR) достоверно уменьшались только при уровне кортизола меньше 400 нмоль/л. Таким образом, следовало, что на степень ИР и выраженность гипергликемии содержание кортизола в крови оказывает непосредственное влияние.
Однако при дальнейшем снижении кортизолемии не происходило параллельного достоверного снижения и нормализации показателей углеводного обмена, что могло свидетельствовать о следующем: 1) уровень кортизола в крови хотя и является ключевым фактором, определяющим степень инсулинорезистентности, но сама по себе инсулинорезистентность еще не определяет всего спектра проявлений СД 2-го типа; 2) имеются дополнительные патогенетические механизмы, лежащие в основе нарушения углеводного обмена.
Если уровень кортизола в крови имеет значение для развития и поддержания ИР и гипергликемии, то следует ожидать, что он должен быть индивидуально повышенным у больных СД 2-го типа. По существующим критериям нормальными значениями кортизола в крови считаются от 138 до 635 нмоль/л. При этом верхний и нижний предел нормы отличаются в 4,5 раза! Если допустить, что у больного СД 2-го типа исходный и его индивидуально нормальный уровень кортизола составляет около 200 нмоль/л, то его увеличение до, например, 400 нмоль/л уже превысит его индивидуальную норму в 2 раза, что будет иметь определенное патогенетическое значение. Анализ исходных показателей уровня кортизола выявил, что у подавляющего большинства (у 37 больных) этот уровень был выше среднего и составил в среднем 590 нмоль/л. Дополнительно было замечено, что чем длительнее протекало заболевание, тем выше были исходные уровни кортизола. Так, при длительности СД 2-го типа до двух лет средний уровень кортизола в крови составил 491 нмоль/л, при длительности заболевания от 2 до 5 лет — 496, от 6 до 10 лет — 526 и больше 10 лет — 681 нмоль/л.
В ходе исследования также было обнаружено и достоверное снижение ИРИ. К 9-му месяцу приема перитола его уровень снизился в 1,5 раза по сравнению с исходными значениями. Этот феномен, очевидно, является вторичным и связан с уменьшением выраженности ИР и, как следствие этого, уменьшением потребности организма в эндогенном инсулине. Подтверждением этому может служить и достоверное снижение показателей индекса НОМА-IR практически в 1,8 раза от исходного (с 3,02 ± 0,10 до 1,70 ± 0,11), что указывает на значительное снижение ИР у наблюдаемых пациентов. В этом отношении показательно изменение значений индекса HOMA-FB. По литературным данным [2, 5], повышение функциональной активности b-клеток поджелудочной железы связывают с увеличением индекса НОМА-FB. В нашей работе произошло, наоборот, его понижение, что могло бы трактоваться как негативный результат. Однако его снижение произошло из-за преимущественного уменьшения содержания ИРИ, а не гликемии, что может свидетельствовать как раз о восстановлении нормальной функции b-клеток, их «глюкозокомпетентности» [2] и в данном случае может расцениваться как позитивный факт.
Проведенное исследование выявило значительное снижение ИР у больных СД 2-го типа и приближение значения индекса HOMA-IR к таковым у здоровых людей [7] только в результате изменения уровня эндогенного кортизола, что свидетельствует о ее кортизолзависимом характере.
Работы в области молекулярной биологии и генетики показывают, что у больных СД 2-го типа, возможно, имеются генетические дефекты, ответственные за передачу сигнала после соединения инсулина со своим рецептором (пострецепторные дефекты) [6], но кортизол относится к гормонам, действующим не на мембранные рецепторы, а пострецепторно. Возможно, именно кортизол как раз и является тем пострецепторным «виновником» инсулинорезистентности, а генетические дефекты здесь ни при чем? Дальнейшие исследования должны показать справедливость данного утверждения.
Выводы
В случае подтверждения патогенетической роли эндогенного кортизола в развитии и поддержании ИР, а также в прогрессировании СД 2-го типа могут открыться новые перспективы не только в профилактике, но и в лечении данного заболевания. Возможность влияния на ИР путем снижения уровня кортизола в крови позволит сократить количество фармакологических групп препаратов, принимаемых данной категорией больных, а также целенаправленно подходить к разработке методов профилактики сопутствующей патологии (артериальная гипертензия, нарушения липидного обмена) и осложнений данного заболевания.
1. Аметов А.С. Инсулиносекреция и инсулинорезистентность: две стороны одной медали // Проблемы эндокринологии. — 2002. — № 3. — С. 31-36.
2. Анциферов М.Б., Дорофеева Л.Г. Инкретиномиметики в терапии сахарного диабета 2-го типа // Лечащий врач. — 2009. — № 3. — С. 14-21.
3. Гинтер Е.К. Медицинская генетика: Учебник для студентов медвузов. — М.: Медицина, 2003. — С. 60-61.
4. Дедов И.И., Кураева Т.Л., Ремизов О.В. и др. Генетика сахарного диабета у детей и подростков: Пособие для врачей. — Москва, 2003. — С. 3.
5. Чубенко Е.А., Беляева О.Д., Баженова Е.А. и др. Плейо-тропные эффекты моксонидина // Сердце: журнал для практикующих врачей. — 2010. — № 5. — С. 293-296.
6. Шестакова М.В., Брескина О.Ю. Инсулинорезистентность: патофизиология, клинические проявления, подходы к лечению // Consilium medicum. — 2002. — № 10. — С. 523-527.
7. Хайдарова Ф.А. Окружность талии как маркер метаболических нарушений у женщин c синдромом поликистозных яичников и нормальной массой тела // Международный эндокринологический журнал. — 2009. — № 6 (24). — С. 90-97.
8. Черныш П.П. К вопросу об этиологии и патогенезе сахарного диабета 2-го типа // Журнал теоретической и клинической медицины. — 2007. — № 4. — С. 17-24.
9. Черныш П.П. Иной взгляд на феномен инсулинорезистентности при сахарном диабете 2-го типа // Медицинский журнал Узбекистана. — 2008. — № 1. — С. 103-107.
10. Boyle S.H., Surwit R.S., Georgiades A., Brummett B.H. et al. Depressive Symptoms, Race and Glucose Concentrations. The role of cortisol as mediator // Diabetes Care. — 2007. — Vol. 30. — P. 2484-2488.
11. Chiodini I., Adda G., Scillitani A., Coletti F., Morelli V. et al. Cortisol Secretion in Patients With Type 2 Diabetes // Diabetes Care. — 2007. — Vol. 30. — P. 83-88.
12. Lee Z.S., Chan J.C., Yeung V.T., Chow C.C. et al. Plasma insulin, growth hormone, cortisol, and central obesity among young Chinese type 2 diabetic patients // Diabetes Care. — 1999. — Vol. 22, Issue 9. — P. 1450-1457.
13. Manco M., Fernбndez J., Valera M., Dйchaud H. et al. Massive Weight Loss Decreases Corticosteroid-Binding Globulin Levels and Increases Free Cortisol in Healthy Obese Patients // Diabetes Care. — 2007. — Vol. 30. — P. 1494-1500.
14. Matthews D.R., Hosker J.P., Rudenski A.S. et al. Homeostasis model assessment: insulin resistance and b-cell function from fasting plasma glucose and insulin concentrations in man // Diabetologia. — 1985. — Vol. 28. — P. 412-419.
15. Schutte A.E., Olckers A. Metabolic syndrome risk in black South African women compared to Caucasian women // Horm. Metab. Res. — 2007. — Vol. 39 (9). — P. 651-657.