Журнал «Здоровье ребенка» 6 (27) 2010
Вернуться к номеру
Особливості профілактики і дієтотерапії харчової алергії у дітей раннього віку
Авторы: Няньковський С.Л., Івахненко О.С., Добрянський Д.О., Львівський національний медичний університет ім. Данила Галицького
Рубрики: Педиатрия/Неонатология
Версия для печати
У роботі наведені основні дані щодо профілактики й лікування харчової непереносимості в дітей. Розглянуті сучасні алгоритми діагностики й лікування алергії до білка коров’ячого молока в дітей раннього віку, сучасні принципи застосування елімінаційних дієт, використання сумішей з різним ступенем гідролізу.
Харчова алергія, непереносимість білка коров’ячого молока, профілактика, лікування, діти.
Протягом останніх десятиріч у різних країнах, особливо у промислово розвинутих, вчені з тривогою спостерігають різке зростання кількості різноманітних алергічних захворювань у дітей і дорослих [1, 2]. Навіть у наймолодших дітей можуть спостерігатися клінічні прояви алергічних реакцій, які переважно пов’язані з особливостями харчування. На сьогодні не існує чітких епідеміологічних даних щодо поширеності харчової алергії в дітей раннього віку. За даними досліджень, прояви харчової алергії зустрічаються у 3–35 % людей, у той же час доведена харчова алергія, підтверджена відповідними імунологічними дослідженнями, спостерігається в 1–4 % випадків [3]. За даними інших досліджень, поширеність алергічних реакцій і захворювань у дітей становить 15–20 %, харчової гіперчутливості або харчової алергії у дітей на першому році життя — 6–8 % і їх кількість продовжує збільшуватися, незважаючи на суттєве покращення методів профілактики і лікування [4–6]. Протягом 2007 р. симптоми харчової алергії у США були зареєстровані більше ніж у 3 мільйонів дітей віком до 18 років, а її поширеність протягом 10 років збільшилась на 18 % [7].
Стрімке збільшення поширеності алергічних захворювань у дітей пов’язують зі змінами оточуючого середовища, способу життя і харчування, збільшенням алергенного навантаження на дитячий організм. Цьому сприяє і покращення діагностики цих захворювань, завдяки чому з алергією/гіперчутливістю асоціюється ряд симптомів і станів у дітей раннього віку, такі як зміни зі сторони шкіри, кольки, діарея, риніт, повторні захворювання верхніх дихальних шляхів, які раніше не пов’язували з алергією на харчові продукти. Певну роль у розвитку алергічних захворювань відіграє генетична схильність. Майже у третини дітей, у яких розвинулись алергічні захворювання, можна знайти прямих родичів з алергічними захворюваннями. Маніфестація алергічних захворювань у дітей має чітку залежність від віку. У дітей раннього віку переважно спостерігають різноманітні гастроінтестинальні симптоми, ознаки атопічної екземи, обструктивні симптоми, що супроводжуються свистячим видихом. У старшому віці частіше спостерігається астма та ринокон’юнктивіт [8, 9].
Сенсибілізація до алергенів у дітей має свою особливість. Як правило, на початку, протягом перших двох-трьох років життя, це сенсибілізація до харчових алергенів, пізніше до алергенів помешкання (домашній пил, кліщі, домашні тварини), з подальшим розвитком гіперчутливості до алергенів зовнішнього середовища (у тому числі різноманітних алергенів рослин) [8]. Поширеність реакцій на білок коров’ячого молока (БКМ) у дітей раннього віку залишається дискутабельною. Незважаючи на те що реальна частота алергічних реакцій на БКМ, за даними літератури, становить від 2 до 7,5 % [10], симптоми, які можна віднести до непереносимості БКМ, спостерігаються в 5–15 % дітей раннього віку [11]. Це обумовлює можливість застосування тривалих елімінаційних дієт у матері-годувальниці або у дитини, з ризиком порушення фізичного розвитку дитини, у випадках, коли вони цього не потребують.
Враховуючи можливість негативного впливу тривалих елімінаційних дієт у матері-годувальниці й у дитини, встановлення діагнозу харчової алергії в дітей раннього віку вимагає застосування чітких діагностичних алгоритмів у медичній практиці лікарів-педіатрів і сімейних лікарів. Симптоми непереносимості БКМ і супутні функціональні розлади травної системи можуть з’явитися не тільки в дітей, у раціон яким вводиться коров’яче молоко, але й у немовлят, які перебувають на виключно грудному вигодовуванні. У молоці значної кількості жінок містяться харчові протеїни. Так, БКМ знаходять у грудному молоці в кількості від нанограмів (10—9 г) до мікрограмів (10—6 г) в 1 мл у 50–95 % годувальниць, білок курячого яйця — у 60–75 %, білок пшениці — у 70 %, протеїн арахісу — у 50 %. Незважаючи на незначну їх кількість, ці білки можуть спричинювати сенсибілізацію у деяких немовлят, які перебувають на грудному вигодовуванні, і розвиток у них алергічних реакцій [12]. Зазвичай харчові алергічні реакції в дітей на грудному вигодовуванні менш тяжкі або маловиражені, що пояснюється незначною кількістю алергену, який потрапляє в організм немовляти з грудним молоком. Найчастіше трапляються блювота, діарея, кишкові кольки і неспокій, симптоми атопічного дерматиту, хоча описані й 3 випадки синдрому некротичного ентероколіту в недоношених новонароджених як вияв алергії на БКМ [12].
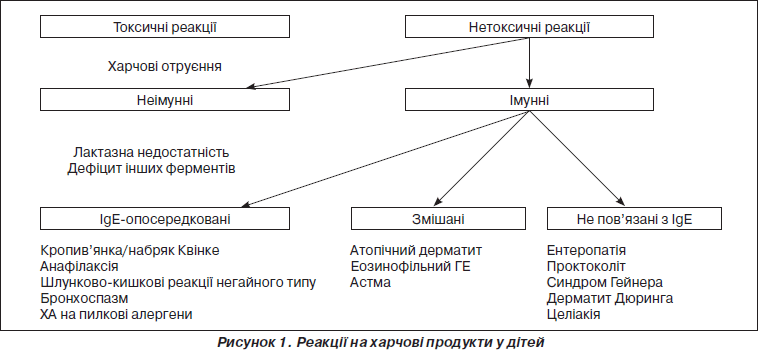
На сьогодні існує доволі багато класифікацій реакцій підвищеної чутливості на харчові продукти у дітей (рис. 1).
З практичного погляду алергічна реакція є різновидом імунної реакції, що має на меті звільнення організму від речовин з антигенними властивостями за допомогою антитіл (АТ) або Т-лімфоцитів. Водночас імунну реакцію відносять до фізіологічного захисту від Ag, тоді як алергічну реакцію вважають типовим патологічним процесом. Це пояснюється тим, що імунна реакція ніколи не супроводжується клінічними ознаками, ніколи не погіршує загальний стан людини, ніколи не ушкоджує власні тканини. Алергічна реакція, на відміну від імунної, завжди супроводжується погіршенням загального стану, різною симптоматикою і ушкодженням тканин. Порушення функції та структури тканин і органів при цьому настільки значні, що виділено окрему нозологічну групу алергічних захворювань.
При імунній реакції комплекс Ag + АТ вільно циркулює в біологічних рідинах (в тому числі в крові), ніколи не пов’язаний з клітинами організму, не фіксується до їх клітинних мембран. При алергічних реакціях комплекс Ag + АТ обов’язково прикріплюється до мембран клітин з наступним її ушкодженням і збільшенням проникності. Біологічно активні речовини, які до ушкодження були ізольовані в клітині, виходять в міжклітинне середовище і викликають різноманітні ефекти, такі як розширення або звуження судин, шкірний свербіж і набряк, спазм гладенької мускулатури, секреція слизу й інші, що обумовлює появу відповідної клінічної симптоматики і погіршення загального стану дитини. Таким чином, принципова різниця імунних і алергічних реакцій полягає в тому, що імунна реакція видаляє Ag з організму і при цьому не ушкоджує тканини, тоді як алергічна реакція видаляє Ag з організму, одночасно ушкоджуючи власні тканини.
Як вже зазначалось, поширеність харчової алергії точно не визначена і залежить від спадкових факторів, віку дитини, особливостей її харчування, географічного місця проживання, доступності сучасних діагностичних процедур, екологічних характеристик оточення [13, 14]. Якщо в нашій країні в дітей найчастіше трапляються алергічні реакції на БКМ і яєчний білок, то у Франції — на яєчний білок і горіхи, у Сінгапурі — на м’ясо птахів та морепродукти.
Група європейських експертів у 2004 році запропонувала стандартні діагностичні критерії харчової алергії, які використовуються й сьогодні. До таких критеріїв відносять:
— стійкі або рецидивні симптоми, пов’язані з прийманням харчового продукту;
— обтяжений спадковий алергологічний анамнез;
— комбінацію 2 або більше різних симптомів;
— симптоми, що виявляються з боку 2 або більше різних органів [15].
Діагностика харчової алергії може бути достатньо простою, якщо дитина має стійкі або рецидивні симптоми, пов’язані зі споживанням певного харчового продукту. Проте доволі часто вона є утрудненою, тому що клінічні прояви, які спостерігаються у дитини, можуть мати різноманітні причини. Крім того, самі симптоми мають тенденцію змінюватися з віком дитини і поширюватися на інші харчові продукти. Тому зазвичай це вимагає проведення додаткової лабораторної діагностики.
Діагностику харчової алергії слід починати з уточнення сімейного анамнезу і сімейної схильності до атопії. Абсолютно доцільним є ведення харчового щоденника матері, якщо вона годує груддю, і/або дитини, якщо вона знаходиться на змішаному/штучному вигодовуванні. Такий щоденник може істотно допомогти дієтологу або іншому лікарю встановити найбільш імовірні продукти, на які дитина має небажані реакції. Після цього можливим є застосування імунологічних тестів, які можуть допомогти підтвердити імуноопосередковану реакцію на харчові продукти, проте є неефективними у разі інших варіантів харчової непереносимості.
Шкірні тести з харчовими алергенами доволі часто проводять у дітей з підозрою на харчову алергію. Проте вони є інформативними у випадках алергії з IgE-опосередкованим механізмом, мають численні недоліки і протипоказання, можуть давати хибні результати і мають проводитися лікарем-алергологом у відповідних умовах [16]. Найбільш апробованим і надійним уважається шкірний пункційний тест. У дітей старше 1 року негативний результат фактично виключає наявність IgE-залежної харчової алергії (у немовлят імовірність 80–85 %). Діагностична точність позитивного результату цього тесту є меншою, що зазвичай визначає потребу проведення провокаційної проби. У дітей віком менше 1,5 року діагностичним є результат ³ 8 мм. За умови такого результату недоцільно проводити провокаційну пробу. Негативний результат тесту не виключає можливості алергії за клінічними даними.
Доволі часто в дітей застосовують різноманітні імунологічні методи дослідження, які дозволяють визначити в сироватці крові специфічні IgE-антитіла до різних харчових алергенів. Для цього може бути використаний радіоалергосорбентний тест (РАСТ) або імуноферментний аналіз (ІФА). Першій РАСТ був проведений більше 20 років тому, і на сьогодні доступними є більше 200 різноманітних алергенів харчових продуктів. Флуоресцентний ІФА (CAP-FEIA) відрізняється найкращими діагностичними характеристиками, що перевищують можливості шкірних тестів, однак вимагає спеціальної сертифікованої лабораторії.
Найбільш надійним способом довести наявність алергії на певний харчовий продукт є проведення провокаційної проби. Проте при застосуванні цієї методики існує небезпека виникнення анафілактичної реакції, і її проведення має здійснюватися алергологами в умовах лікарні. Крім того, до початку проведення провокаційної проби мають бути відмінені b-міметики (за 12–36 годин) й антилейкотрієнові препарати (за 1 тиждень).
Відкриту провокаційну пробу використовують, щоб виключити або підтвердити наявність реакції на певний алерген (харчовий продукт), просту сліпу провокаційну пробу — для підтвердження наявності об’єктивних симптомів. Золотим діагностичним стандартом уважають подвійну сліпу провокаційну пробу, яку використовують для вивчення нових діагностичних методів і оцінювання суб’єктивних симптомів харчової алергії. При проведенні провокаційної проби перевагу віддають свіжим харчовим продуктам, титрування дози проводять кожні 20 хв (0,1–0,3–1,0–3,0–10,0–30,0–100,0 мл). Максимальна доза продукту, що використовують для провокації, обумовлюється середньою кількістю продукту, що зазвичай споживається (наприклад, 100 мл молока, 1 яйце, 5 г пшеничного білка). Негативну реакцію визначають протягом 1 тижня спостереження. Кількісне співвідношення плацебо/алерген — 1 : 2; інтервал — 1 день.
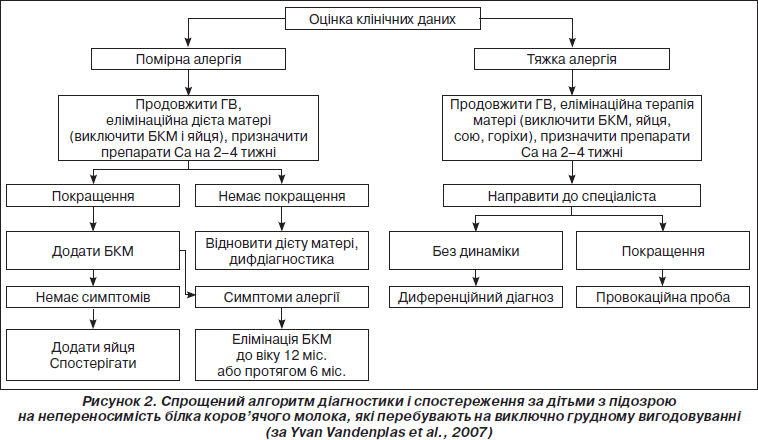
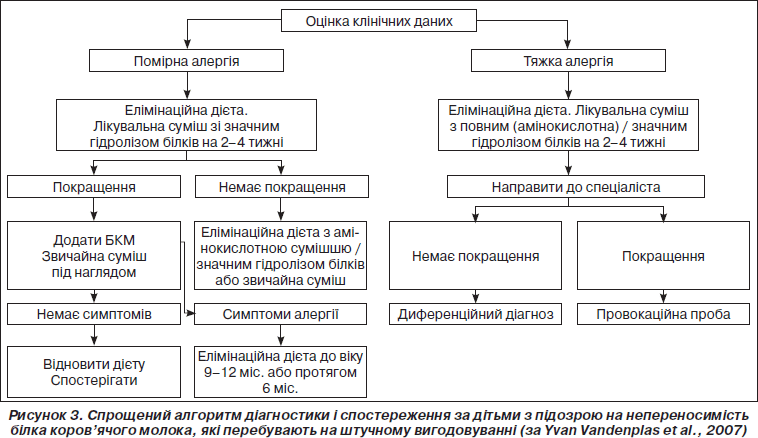
З огляду на те, що основною харчовою проблемою у дітей раннього віку є алергія на БКМ, у 2007 р. був запропонований алгоритм діагностики і спостереження у дітей з підозрою на алергію на БКМ залежно від типу їх вигодовування і тяжкості алергічних проявів.
Тяжкість стану алергічних проявів реакції на БКМ можна визначити залежно від наявних клінічних проявів (табл. 1).
Так, у дітей, які перебувають на виключно грудному вигодовуванні і мають клінічні ознаки, що дозволяють запідозрити алергію на БКМ, слід застосовувати такий алгоритм (рис. 2).
Дітям, які знаходяться на штучному вигодовуванні і мають клінічні ознаки, що дозволяють запідозрити алергію на БКМ, слід застосовувати дещо інший алгоритм (рис. 3).
Доволі часто у матерів, які годують груддю, й у дітей старше 6 місяців, у разі підозри на харчову алергію виникає необхідність застосовувати елімінаційну дієту. Це передбачає виключення одного, кількох або всіх продуктів, за винятком «дозволених» (олігоалергенна дієта), і призначення лікувальних гіпоалергенних продуктів. Тип елімінаційної дієти залежить від наявної проблеми, віку дитини і типу харчування. У дітей першого року життя найбільше значення має виключення БКМ, у більш старшому віці — звуження харчового раціону (рис або кукурудза, 2–3 овочевих продукти, 2–3 різновиди фруктів, вода (можливо, яблучний сік), сіль, цукор, маслинова олія). Доцільно використовувати індивідуальну схему розширення харчового раціону; введення продуктів прикорму після 6 міс., віддавати перевагу однокомпонентним стравам, застосовувати інтервали 5–7 днів між уведенням нових продуктів. Як початковий продукт рекомендують використовувати каші (рис, овес). Симптоми зникають за умови успішного використання елімінаційної дієти, і ті самі симптоми знову з’являються після контрольованої провокаційної проби.
Ключові питання призначення елімінаційної дієти такі:
— Алерген відомий чи ні?
— Діагностика чи лікування?
— Тип алергену (поширеність, харчове значення)?
— Доза, що спричинює реакцію?
— Тип реакції (негайного чи сповільненого типу, анафілактична реакція)?
— Клінічна маніфестація (шкіра, травний канал, дихальна система, системна)?
— Вік дитини?
— Моно- чи полівалентна алергія?
— Супутні захворювання?
При цьому виникає ряд проблем, що вимагають певної відповіді. Це наявність у багатьох продуктах прихованих антигенів, контамінація алергенами, можливість неадекватного маркування продуктів і перехресних реакцій. Ми знаємо, що БКМ наявний у таких продуктах, як молоко (в тому числі сухе і згущене), вершки, пінка, сметана, масло, маргарин, сир, йогурт, сироватка. Проте він може міститися і в таких продуктах, як промислово вироблене м’ясо, овочі, консервовані супи, соуси, підливи, хліб, десерти, солодощі, у продуктах, смажених (тушкованих) на маслі або маргарині.
Окремою загрозою при немотивованому застосуванні елімінаційних дієт є їх розбалансованість і неадекватне забезпечення харчовими інгредієнтами, які критично потрібні для забезпечення нормального росту й розвитку дитини. Повноцінне харчування у ранньому дитинстві є надзвичайно важливим фактором адекватного фізичного і нервово-психічного розвитку з мінімальним ризиком негативних наслідків. Так, у 2004 році L.C. Medeiros et al. у бразильському журналі J. Pediatr. опублікували результати дослідження впливу елімінаційної дієти на фізичний розвиток у 26 дітей з харчовою алергією (середній вік — 19,1 міс.). Авторами відзначено значно менше споживання цими дітьми енергії, білків, жирів, мікроелементів (в тому числі Са, Р), що супроводжувалося значною затримкою їх фізичного розвитку порівняно з дітьми, які знаходились на повноцінній віковій дієті.
Доцільність збереження природного годування у немовлят з харчовою алергією на сьогодні підтримується більшістю науковців і практичних лікарів. Надзвичайно важливим є раціональний підхід до призначення харчування дітям з ризиком або проявами алергії на БКМ, які знаходяться на змішаному або штучному вигодовуванні. Основні положення такого харчування містять як мінімум 2 постулати. Це необхідність гідролізу коров’ячого молока у сумішах і обов’язкова присутність пребіотичного комплексу — суміші олігосахаридів.
Доцільність гідролізу БКМ пояснюється тим, що чим коротша довжина ланцюга і менша молекулярна маса білка, тим нижча остаточна алергенність білка/пептиду. Цього можна досягнути за допомогою відповідного підігріву, ензиматичного гідролізу або ультрафільтрації. Так, у суміші Nutrilon Гіпоалергенний, яку доцільно використовувати з профілактичною метою для харчування у дітей з популяційним ризиком або підозрою на харчову алергію, використовується частковий гідроліз білків (< 5000 D). Ця суміш має значно меншу алергенність, прийнятну вартість, добру харчову збалансованість і смакові якості й імунологічні властивості, подібні до таких у грудного молока. Крім того, ця суміш містить унікальний комплекс пребіотиків-олігосахаридів (IMMUNOFORTIS), що забезпечує розвиток нормального біоценозу кишок, сприяє адекватним імунологічним реакціям і розвитку харчової толерантності.
Ряд дослідників беззаперечно довели існування зв’язку між складом мікрофлори кишок і ступенем зрілості механізмів імунної відповіді. Порушення мікроекології кишок відіграє значну роль у формуванні у дітей харчового несприйняття, у розвитку харчової алергії. У нормі не виникає активної імунної відповіді проти значної кількості харчових алергенів, які щодня потрапляють в організм дитини. Це пояснюється неможливістю їх доступу до імунної системи через стінку кишок внаслідок деструкції епітопів травними ферментами, неможливістю подолання антигенами кишкового епітелію і пов’язаного з ним слизового шару, що запобігає контакту молекул з клітинами, які презентують антиген. Значною мірою толерантність до харчових антигенів пов’язана з особливостями місцевого імунітету, а саме з супресією імунної відповіді за участі феноменів оральної толерантності, контрольованого фізіологічного запалення і місцевої секреції IgA. Кишкова мікрофлора може індукувати і підтримувати оральну толерантність — стан активної імунологічної ареактивності до антигенів, з якими організм раніше контактував оральним шляхом. В останніх дослідженнях було доведено, що саме мікрофлора кишок має фундаментальне значення для розвитку харчової алергії та толерантності за рахунок природжених реакцій імунної системи на бактерії товстих кишок й індукції Т-регуляторних лімфоцитів. Був зроблений аргументований висновок, що нестача лакто- та біфідобактерій може призводити до зменшення харчової толерантності [7, 18].
В останньому дослідженні S. Arslanoglu і співавт., яке було опубліковане в 2008 р., було доведено, що раннє призначення суміші з пребіотичним комплексом олігосахаридів, які містяться у сумішах лінійки Nutrilon (Immunofortis), істотно зменшує кількість випадків алергічної маніфестації й інфекційних захворювань у дітей перших 2 років життя [19]. Ці висновки підтверджуються і рядом інших наукових робіт, які були проведені на належному науковому і доказовому рівні [20].
За наявності доведеної алергії на БКМ з відповідними клінічними ознаками доцільність використання гіпоалергенної суміші Nutrilon Гіпоалергенний є сумнівною. У таких випадках необхідно застосовувати спеціальну лікувальну суміш Nutrilon Лікування алергії. Це суміш зі значно зниженою алергенністю (значний гідроліз білків), яку відносять до класу напівелементних лікувальних сумішей (розмір частинок білка < 3000 D). Важливим є і той факт, що ця суміш не містить лактози, містить олігопептиди і тригліцериди з середньоланцюжковими жирними кислотами, нуклеотиди і довголанцюжкові поліненасичені жирні кислоти, які забезпечують метаболічний ефект, подібний до ефекту грудного молока. Ця суміш має лише незначний гіркуватий присмак і добре сприймається дітьми.
У частині випадків тяжкої алергії на БКМ застосування навіть лікувальної напівелементної суміші може бути недостатньо ефективним. Тоді необхідно використовувати елементні (амінокислотні) суміші, які містять кристалічні амінокислоти, зовсім не мають алергенних властивостей, не містять лактози і легко всмоктуються, проте мають неприємний смак, високу осмолярність і дуже дорогі. В Україні на сьогодні такі суміші не завозяться жодним виробником дитячого харчування.
Суміші на основі білків іншого походження (у тому числі соєві) фактично не є гіпоалергенними, і їх недоцільно використовувати як профілактичні або лікувальні продукти.
Таким чином, підсумовуючи особливості проблеми харчової алергії і алергії до БКМ у дітей раннього віку, слід враховувати доволі значну поширеність цієї патології і необхідність використання додаткових досліджень для встановлення кінцевого діагнозу.
Сучасна стратегія годування дітей з групи ризику або дітей на грудному вигодовуванні з клінічними ознаками непереносимості БКМ передбачає таке:
— продовжити грудне вигодовування, якщо немовля годували груддю;
— призначити елімінаційну дієту матері (коров’яче молоко, яйця, соя тощо) + препарати Ca (1 г/добу) 2–4 тижні;
— відмінити продукти прикорму на 2–4 тижні або до досягнення 6 міс. або відмінити основні алергенні продукти;
— при покращенні припинити/відновити дієту, використовувати суміш зі значним гідролізом білків після закінчення грудного годування протягом мінімум 6 міс.;
— тяжкий активний алергічний ентероколіт з анемією і гіпоальбумінемією, відсутність позитивної динаміки, недостатність молока є показаннями до проведення додаткового диференціального діагнозу і лікування сумішами зі значним гідролізом білків (Nutrilon Лікування алергії) або елементними сумішами.
Дітям, які знаходяться на штучному годуванні:
— з профілактичною метою, дітям з групи ризику призначати суміші з частковим гідролізом білка і пребіотичним комплексом олігосахаридів — Nutrilon Гіпоалергенний;
— дітям з клінічними проявами алергії на БКМ призначати суміші зі значним гідролізом білків (напівелементні) — Nutrilon Лікування алергії;
— у тяжких випадках дитину необхідно госпіталізувати, перевести на повне парентеральне харчування протягом 2 тижнів або призначити амінокислотну суміш з подальшим призначенням напівелементної або елементної суміші;
— тривалість лікування — щонайменше до 12– 18 міс. життя або протягом не менше 6 міс.
1. Halken S. Prevention of allergic disease in childhood: clinical and epidemiological aspects of primary and secondary allergy prevention // Pediatric Allergy and Immunology. — 2004. — Vol. 15 (Suppl. 16). — P. 4-5.
2. Prescott S., Tang M. The Australasian Society of Clinical Immunology and Allergy position statement: Summary of allergy prevention in children // Medical Journal of Australia. — 2005. — Vol. 182. — P. 464-467.
3. Mills E.N., Mackie A.R. et al. The prevalence, cost and basis of food allergy across Europe // Allergy. — 2007. — 62 (7). — Р. 717-22.
4. Sampson H.A. Update on food allergy // Journal of Allergy and Clinical Immunology. — 2004. — Vol. 113. — P. 805-819.
5. Osterballe M., Hansen T.K., Mortz C.G., Host A., Bindslev-Jensen C. The prevalence of food hypersensitivity in an unselected population of children and adults // Pediatric Allergy and Immunology. — 2005. — Vol. 16. — P. 567-573.
6. Warner J.O., Kaliner M.A., Crisci C.D., Del Giacco S.D. et al. Allergy Practice Worldwide: A Report by the World Allergy Organization Specialty and Training Council // Int. Arch. Allergy Immunol. — 2006. — Vol. 139. — P. 166-174.
7. Branum A.M., Lukacs S.L. Food allergy among U.S. children: Trends in prevalence and hospitalizations. NCHS data brief, no 10. Hyattsville, MD: National Center for Health Statistics. 2008.
8. Arshad S.H., Kurukulaaratchy R.J., Fenn M., Matthews S. Early life risk factors for current wheeze, asthma, and bronchial hyperresponsiveness at 10 years of age // Chest. — 2005. — Vol. 127. — P. 502-508.
9. Osborn D.A., Sinn J.H. Probiotics in infants for prevention of allergic disease and food hypersensitivity (Review) The Cochrane Library. — 2009. — Issue 4.
10. Hill D.J., Firer M.A., Shelton M.J. et al. Manifestations of milk allergy in infancy: clinical and immunologic findings // J. Pediatr. — 1986. — 109. — Р. 270-6.
11. Host A. Frequency of cow’s milk allergy in childhood // Ann. Allergy Immunol. — 2002. — 89 (Suppl. 1). — Р. 33-7.
12. Anne Des Roches. Food Allergy and Very Early Allergy Prevention in Neonates. 3rd Congress of the EAPS, 2010. Cophenhagen, Denmark // www.nestlenutrition-institute.org
13. Muraro A., Roberts G. et al. The management of anaphylaxis in childhood: position paper of the European Academy of Allergology and Clinical Immunology // Allergy. — 2007. — Vol. 62. — P. 857-871.
14. Sampson H.A. Update on food allergy // J. Allergy Clin. Immunol. — 2004 Jul. — 114 (1). — Р. 127-30.
15. Muraro S., Dreborg S., Halken S., Host A. et al. Dietary prevention of allergic diseases in infants and small children. Part II. Evaluation of methods in allergy prevention studies and sensitization markers. Definitions and diagnostic criteria of allergic diseases // Pediatr. Allergy Immunol. — 2004 Jun. — 15 (3). — 196-205.
16. Чоп’як В.В., Головін Р.Р. та ін. Харчова алергія // Клин. иммунология. Аллергология. Инфектология. — 2008. — № 17. — С. 45-51.
17. Boehm G., Fanaro S., Jelinek J. et al. Prebiotic concept for infant nutrition //Acta Paediatrica. — 2003. — Vol. 441. — P. 64-76.
18. Moro G., Arslanoglu S. Reproducing the bifidogenic effect of human milk in formula-fed infants: why and how? // Acta Paediatr. — 2005. — Vol. 94. — P. 14-17.
19. Sertac Arslanoglu, Guido E. Moro, Joachim Schmitt, Laura Tandoi, Silvia Rizzardi, and Gunther Boehm. Early Dietary Intervention with a Mixture of Prebiotic Oligosaccharides Reduces the Incidence of Allergic Manifestations and Infections during the First Two Years of Life // J. Nutr. — 2008. — 138. — Р. 1091-1095.
20. Moro G., Arslanoglu S., Stahl B., Jelinek J., Wahn U., Boehm G. Mixture of prebiotic oligosaccharides reduces the incidence of atopic dermatitis during the first six months of age // Archives of Disease in Childhood. — 2006. — Vol. 91. — P. 814-819.