Журнал «Болезни и антибиотики» 2 (2) 2009
Вернуться к номеру
Диарея путешественников
Авторы: Богун Л.В., к.м.н., доцент кафедры терапии Харьковской медицинской академии последипломного образования
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
В настоящее время поездки на большие расстояния, не обязательно международные, доступны каждому, и, наверное, трудно найти человека, хотя бы раз в жизни не совершавшего такую поездку. Благодаря достижениям современного транспорта в самые отдаленные уголки планеты можно добраться менее чем за двое суток [1]. Традиционно под категорией путешествующих рассматриваются лица, совершающие поездки деловые или с целью отдыха, однако существует еще две группы лиц, которых также формально следует относить к этой категории, по крайней мере в медицинском аспекте. Сюда относятся иностранцы, которые временно или постоянно проживают на территории Украины, но могут совершать поездки в страну своего происхождения. При этом зачастую их иммунитет против эндемических заболеваний на их родине преувеличивается, и они выпадают из поля зрения медицинского персонала [1–4]. Особенно актуальна эта проблема для выходцев из стран Африки, расположенных к югу от Сахары, Азии и Латинской Америки [5]. Ко второй категории вышеупомянутых лиц относятся военнослужащие, дислоцирующиеся в странах, неблагополучных по инфекционным заболеваниям (например, малярия в Афганистане, острая эозинофильная пневмония в Ираке, лейшманиоз в ЮгоЗападной Азии, диарея повсеместно) [6]. Вопросы медицинского обслуживания военнослужащих (в отличие от других категорий путешествующих), в том числе по профилактике и лечению инфекционных заболеваний, в Украине жестко регламентированы и далее в этой статье рассматриваться не будут.
К какой бы категории ни относились лица, совершающие путешествия, риск развития заболеваний, ассоциированных с путешествием, у них достаточно высок — они возникают у 15–70 % туристов. Большая часть этих заболеваний носит инфекционный характер [7, 8], причем наиболее частым инфекционным заболеванием у путешествующих является диарея [9, 10]. Особенно часто диарея путешественников (ДП) развивается при поездках в развивающиеся страны: так, по данным ряда исследований, острая диарея возникала у 20–60 % лиц за 2 недели пребывания в развивающихся странах [11–13]. С учетом различий в этиологии, клинической картине и, главное, с точки зрения риска развития осложнений целесообразно выделить две основные формы ДП — острую и персистирующую.
Острая форма ДП
Классическое определение ДП подразумевает три и более эпизода неоформленного стула в течение 24 часов в сочетании как минимум с еще одним из нижеследующих признаков: лихорадка, тошнота, рвота, колики в животе, тенезмы, лихорадка или примесь крови в кале [13].
Частота ДП значительно варьирует в зависимости от региона поездки, и, безусловно, основным фактором, определяющим вероятность ее развития, является социальноэкономический статус страны, в которую выезжает турист [14]. Риск заболевания особенно высок в странах Южной Азии и в Индии (риск заболеть ДП в Индии составляет 60 % за 2 недели пребывания), несколько ниже в странах Африки, расположенных к югу от Сахары, и еще ниже в Южной Америке (в Бразилии и в странах Карибского бассейна соответствующий риск составляет 40 %) [11]. В среднем ДП развивается на 4–5й день пребывания за рубежом [11]. Большинство эпизодов ДП характеризуется нетяжелым течением: частота дефекации превышает 6 раз в сутки не более чем у 1/4 больных, свыше 10 раз — у 8,4 % больных, только у 1–7 % заболевших отмечается лихорадка и/или примесь крови в кале [11]. В наблюдении, охватившем 73 630 путешествующих, всего лишь 14 больных с ДП нуждались в госпитализации и не было зарегистрировано ни одного летального исхода [11]. Тем не менее, хотя подавляющее большинство случаев ДП не несет серьезной угрозы здоровью заболевших, примерно 1/3 больных вынуждена ограничивать свою активность и отказываться от запланированных мероприятий [15].
Этиология и диагноз острой ДП
Исходя из результатов многочисленных исследований, этиологию ДП можно коротко охарактеризовать следующим образом: наблюдается четкое преобладание бактериальных возбудителей, среди которых лидирующую позицию занимает Escherichia coli (энтерогеморрагический и энтеротоксикогенный типы) [13, 16–19].
Следующими по частоте бактериальными возбудителями ДП являются Campylobacter jejuni, Salmonella spp., Shigella spp. и Plesiomonas spp. Исключение составляют страны ЮгоВосточной Азии и Индия, где на первом месте по частоте стоит Campylobacter spp., на его долю приходится до 64 % всех случаев ДП [20]. Вирусы вызывают примерно 1/3 всех случаев ДП, чаще всего выделяют норовирусы, которые являются наиболее распространенными возбудителями ДП на круизных кораблях [21]. Случаи острой ДП паразитарной этиологии (преимущественно Giardia lamblia и Entamoeba histolytica) встречаются еще реже.
Благоприятный прогноз и склонность к нетяжелому течению ДП делают бактериологическое исследование кала необязательным. Только при наличии сильной лихорадки, признаках колита, сопутствующих воспалительных заболеваниях кишечника и при тяжелых сопутствующих заболеваниях, при которых повышается риск развития осложнений, такое исследование показано. Перспективен микробиологический метод выделения бактериальной или вирусной ДНК в образцах кала, что позволяет идентифицировать возбудителя [22]. Хотя такой метод используется в настоящее время исключительно для научных целей, но вполне реален его выход в клиническую практику в ближайшие годы.
Лечение острой диареи путешественников
Симптоматическое лечение. Антидиарейным препаратом выбора, угнетающим перистальтику кишечника, является синтетический опиоид лоперамид. Препарат разрешен к применению Администрацией по контролю за пищевыми продуктами и лекарствами (FDA) США у взрослых и детей старше 2 лет. Препарат противопоказан для приема при беременности (относится к категории риска С по классификации FDA, при которой риск для плода исключить нельзя) и лактации. Лоперамид обладает выраженным антидиарейным эффектом — частота стула на фоне его применения по сравнению с плацебо уменьшается на 60 % — и безопасен при большинстве видов диареи, но его применение не рекомендуется при инвазивных формах ДП (наличие примесей крови в кале или лихорадка свыше 38,5 °С) [23, 24]. К редким нежелательным лекарственным явлениям (НЛЯ) на фоне приема лоперамида относятся запор, иногда вздутие и дискомфорт в животе. При ДП препарат эффективен как в монотерапии, так и в качестве дополнения к антибактериальной терапии [25] (табл. 1). Рекомендуемый режим приема лоперамида представлен в табл. 2.

Другие препараты с антисекреторной активностью — висмута субсалицилат — обладают менее выраженной антидиарейной активностью: они способны снижать частоту дефекаций на 40 % [26] (табл. 2).
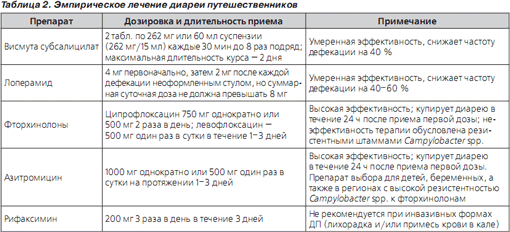
Антимикробные препараты. Антимикробные препараты четко доказали свою способность уменьшать длительность и тяжесть ДП, но за их эффективность в ряде случаев пациент расплачивается НЛЯ. Поэтому адекватная антибактериальная терапия ДП требует избегать избыточного их применения, т.е. не назначать той категории больных ДП, у которых можно предвидеть самостоятельное выздоровление [27]. Рекомендуемые препараты и их дозировки представлены в табл. 2.
Фторхинолоны (ФХ) являются средством выбора эмпирической антибактериальной терапии в большинстве регионов земного шара. Сдерживающим фактором их широкого применения является повсеместный рост резистентности возбудителей к ним, достигший 58 % только за период 1999–2003 гг. [28], причем в некоторых регионах эти цифры еще выше — например, в странах ЮгоВосточной Азии до 98 % всех штаммов Campylobacter spp. устойчивы к ципрофлоксацину [20]. Вторым фактором, ограничивающим их широкое применение, является относительно высокая частота НЛЯ, в силу чего эти препараты не рекомендуются для приема в период беременности (категория риска С по классификации FDA) и лактации, а также детям младше 18 лет. Наиболее типичными НЛЯ являются (в порядке убывания частоты) расстройства со стороны пищеварительного тракта (анорексия, тошнота, рвота, дискомфорт в животе) и со стороны нервной системы (головная боль, головокружение, бессонница, колебания настроения). Реже встречаются тендиниты, удлинение интервала QT на ЭКГ, повышение уровня трансаминаз.
Азитромицин — представитель класса макролидов с высокой активностью в отношении Campylobacter spp. и в отношении других ведущих возбудителей ДП в различных регионах. Является препаратом выбора для лечения ДП у детей, беременных женщин (класс В по классификации FDA, отсутствие доказательств риска у человека) и ДП в регионах с высокой распространенностью Campylobacter spp. [23]. Наиболее частые НЛЯ — желудочнокишечные расстройства (легкая тошнота), кожный зуд, высыпания на коже, повышенный риск вагинита.
Рифаксимин — пероральный невсасывающийся антибиотик, производное рифампина, разрешен для лечения ДП, вызванной неинвазивными штаммами E.сoli, у взрослых и детей старше 12 лет. Антибиотик широкого спектра действия, является полусинтетическим производным рифамицина SV. Необратимо связывает βсубъединицы фермента бактерий, ДНКзависимой РНКполимеразы и, следовательно, ингибирует синтез РНК и белков бактерий. В результате необратимого связывания с ферментом рифаксимин проявляет бактерицидные свойства в отношении чувствительных бактерий. Препарат обладает широким спектром антибактериальной активности, включающим большинство грамотрицательных и грамположительных, аэробных и анаэробных бактерий, вызывающих желудочнокишечные инфекции, включая диарею путешественников. Активен в отношении грамотрицательных аэробных бактерий: Salmonella spp., Shigella spp., энтеропатогенных штаммов Escherichia coli, Proteus spp., Campylobacter spp., Pseudomonas spp., Yersinia spp., Enterobacter spp., Klebsiella spp., Helicobacter pylori; грамотрицательных анаэробов: Bacteroides spp., включая Bacteroides fragilis, Fusobacterium nucleatum; грамположительных аэробов: Streptococcus spp., Enterococcus spp., включая Enterococcus fecalis, Staphylococcus spp.; грамположительных анаэробов: Clostridium spp., включая Clostridium difficile и Clostridium perfrigens, Peptostreptococcus spp. Преимущества рифаксимина заключаются прежде всего в очень низкой абсорбции в ЖКТ (< 0,5 % от пероральной дозы), высокой безопасности, что наряду с широким спектром антимикробной активности делает его препаратом выбора для лечения многих кишечных инфекций, в том числе и ДП. При лечении ДП препарат показал эффективность, сопоставимую с эффективностью ципрофлоксацина, но в отличие от него вызывал гораздо меньше НЛЯ [29]. Однако рифаксимин не получил одобрения для лечения инвазивных форм диареи путешественников (протекающей с лихорадкой и/или примесью крови в кале), частота которых составляет порядка 5 % в странах Америки и Африки и порядка 10 % в странах Азии, а также при диарее, вызванной Shigella spp., Salmonella spp. или Campylobacter spp. [30].
Нифуроксазид — производное 5нитрофурана; практически не абсорбируется из пищеварительного тракта и действует в просвете кишечника. Препарат активен в отношении большинства возбудителей кишечных инфекций (в том числе штаммовмутантов, устойчивых к другим противомикробным средствам): грамположительных (Staphylococcus spp.) и грамотрицательных (семейство Enterobacterіаceae: Escherichia spp., Citrobacter spp., Enterobacter spp., Klebsiella spp., Salmonella spp., Shigella spp., Proteus spp., Yersinia spp.), а также Vibrio cholerae. Не активен в отношении бактерий рода Pseudomonas и рода Proteus (вид Proteus inconstans), а также штаммов подгруппы A вида Providentia alcalifaciens. При применении в терапевтических дозах оказывает бактериостатическое действие, в высоких дозах — бактерицидное. При применении нифуроксазида в терапевтических дозах практически не отмечают нарушения равновесия сапрофитной микрофлоры толстого кишечника, что означает, что этот противомикробный препарат не обладает отрицательным действием на микрофлору кишечника. Кроме того, нифуроксазид не вызывает развития резистентных штаммов патогенных микроорганизмов и перекрестной устойчивости микроорганизмов к другим антибактериальным средствам, что позволяет при необходимости назначать его в комплексной терапии [31].
Общие вопросы лечения ДП. Поскольку клинические проявления ДП не имеют какихлибо черт, характерных для того или иного возбудителя ДП, и в подавляющем большинстве случаев показаний к микробиологическому исследованию кала нет, то выбор терапии обычно осуществляется на эмпирической основе [16]. В большинстве случаев ДП имеет благоприятное течение, что позволяет или вообще отказаться от ее медикаментозной терапии, или ограничиться симптоматическим лечением. При признаках дегидратации рекомендуется возмещение потерь жидкости солевыми растворами и глюкозой, хотя в большинстве случаев для регидратации можно ограничиться пероральным приемом растворов.
Антибактериальные препараты назначаются при тяжелом течении ДП, как правило, при наличии лихорадки и/или примесей крови в кале [32]. В нескольких прямых сравнительных исследованиях была продемонстрирована возможность однократного назначения антибактериального препарата, сравнимого по эффективности с 3дневным курсом антибактериальной терапии [33]. Однако до получения более доказательных результатов однократное назначение антибиотика всетаки рекомендуется только для больных с умеренной тяжестью ДП при отсутствии лихорадки и примесей крови в кале. В противном случае показан классический трехдневный курс антимикробной терапии. В настоящий момент какоголибо специфического лечения для ДП вирусной этиологии нет.
Персистирующая ДП
Персистирование диареи после эпизода острой ДП встречается относительно редко — по результатам двух крупных исследований ДП, сохранение диареи свыше 1 мес. отмечалось менее чем у 2 % больных [34, 35]. Хотя традиционно персистирующая ДП считается заболеванием с инфекционной этиологией, существует еще две возможные причины ее развития: постинфекционные осложнения и клиническая манифестация существовавших ранее хронических заболеваний [36].
Персистирующая ДП инфекционной этиологии
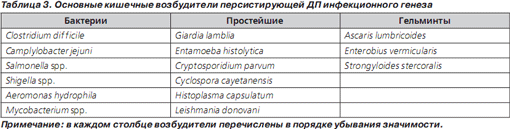
Основные возбудители, вызывающие персистирующую ДП, представлены в табл. 3. Очевидно, что персистирующую форму ДП могут вызывать те же возбудители, которые вызывают и острую ДП (Escherichia coli, Shigella spp., Campylobacter spp., Aeromonas hydrophila). Однако следует подчеркнуть, что бактериальные возбудители редко вызывают ДП длительностью свыше 2 недель. Единственным исключением является Clostridium difficile, вызывающая антибиотикоассоциированную диарею (ААД) — типичное осложнение любой антибактериальной терапии, в том числе и антибактериальной терапии, проводимой по поводу предшествовавшей острой ДП [37]. Длительность ААД в отсутствие лечения может достигать нескольких недель. Типичными возбудителями персистирующей ДП являются простейшие, чаще всего Giardia lamblia, Cryptosporidium parvum и Cyclospora cayetanensis, роль которой неуклонно возрастает [38]. Isospora belli и Cryptosporidium parvum у лиц без нарушений иммунитета вызывают ДП редко. Диагноз при подозрении на протозойный генез ДП подтверждается при микроскопическом исследовании, если обнаружены цисты и трофозоиты в трех отдельных образцах кала. На смену этому классическому методу исследования приходят иммунологические методы, сопоставимые по чувствительности и точности с классической микроскопией [39]. Диагноз лямблиоза ставится при выявлении трофозоитов и цист в дуоденальном биоптате; данный инвазивный метод в силу своей травматичности применяется редко. При гистологическом исследовании биоптата слизистой тонкого кишечника у больных лямблиозом обычно не обнаруживается какихлибо патологических изменений [40].
Препаратами выбора для лечения лямблиоза являются метронидазол, назначаемый перорально в дозе 250 мг трижды в день в течение 5 дней, или тинидазол — 2 г однократно [41].
Амебы (Entamoeba histolytica) — классические возбудители колита в тропических странах, клинические проявления которого во многом напоминают дизентерию: отмечаются примеси слизи и крови в кале, боли в животе. Современные методы исследования позволяют отличить патогенные виды амеб (Entamoeba histolytica) от непатогенных (Entamoeba dispar и Entamoeba moshkovskii), чего нельзя сделать при помощи обычной световой микроскопии. Хотя возможность колита амебной этиологии не подвергается сомнению, вполне вероятно, что в прошлом многие случаи расстройств пищеварительного тракта ошибочно относили на счет амебиаза при обнаружении в кале при микроскопии видов амеб, в настоящее время считающихся непатогенными, что привело к преувеличению роли амебиаза в этиологии колита. В настоящее время подвергается серьезной критике подход, согласно которому любой колит с доказанной недизентерийной этиологией должен трактоваться как колит амебной этиологии [42].
Метод, основанный на выявлении амебных антигенов в кале, позволяет с высокой вероятностью не только подтвердить наличие амеб, но и типировать их отдельные виды [43]. Серологические методы хотя и обладают меньшей чувствительностью по сравнению с предыдущим методом, но также позволяют поставить диагноз амебиаза. При инфицировании пищеварительного тракта Entamoeba histolytica в отличие от колонизации происходит образование соответствующих антител, которые могут быть обнаружены уже спустя 5–7 дней от начала инфицирования и сохраняются в течение нескольких лет. Лечение инвазивного амебного колита проводится метронидазолом в дозе 500–750 мг трижды в день в течение 7–10 дней, частота излечения составляет около 90 % [44].
Кишечные гельминты (главным образом аскариды, острицы, угрицы) вызывают диарею крайне редко [45]. К редким возбудителям диареи также можно отнести туберкулезное поражение кишечника, лейшманиоз, гистоплазмоз, инфицирование атипичными микобактериями [46]. Описаны единичные случаи ДП при тропической спру — заболевании с неустановленной этиологией, протекающем с диареей, мальабсорбцией и атрофией ворсинок слизистой двенадцатиперстной кишки [47]. Это заболевание обычно регистрируется у жителей тропических регионов и очень редко отмечается у туристов, посещающих эти регионы [48].
Постинфекционные осложнения, вызывающие персистирующую ДП
Под постинфекционными осложнениями подразумевается персистирующая диарея, которая продолжается после эпизода острой ДП, но не имеет инфекционных возбудителей.
Временное нарушение всасывания лактозы является прямым следствием повреждения слизистой оболочки тонкого кишечника, которое часто развивается при гастроэнтеритах бактериальной или вирусной этиологии. Употребление в пищу лактозы в этой ситуации сопровождается метеоризмом и, реже, диареей [49]. Для диареи вследствие нарушения всасывания лактозы характерна короткая длительность, обычно всего несколько дней после прекращения эпизода инфекционной диареи. При обследовании больного с непереносимостью лактозы необходим тщательный сбор анамнеза для установления описанной выше причинноследственной связи, а также оценка связи между симптомами и количеством употребленной лактозы. Согласно результатам слепого перекрестного исследования Suarez и соавт. (1995 г.), у больных с полной непереносимостью лактозы пороговой величиной, при которой появляются симптомы непереносимости лактозы, является употребление свыше 240 мл коровьего молока (что соответствует 12 г лактозы — в коровьем молоке содержится 5 % лактозы) [50]. Таким образом, если у здоровых в остальном отношении взрослых (то есть без гастрэктомии или состояний, приводящих к укорочению кишечника) симптомы, характерные для непереносимости лактозы, появляются при употреблении меньшего количества молока, то диагноз временной непереносимости лактозы очень сомнителен.
Постинфекционный синдром раздраженного кишечника (ПИСРК). Возможность развития функциональных кишечных расстройств после эпизода острой инфекционной диареи хорошо описана несколько десятилетий назад [51] и подтверждается современными исследованиями [52]. Более того, ПИСРК возникает довольно часто и является причиной большинства случаев персистирующей ДП [53]. Согласно данным литературы, ПИСРК как следствие кишечных инфекций диагностируется у 4–32 % больных с типичным (согласно Римским критериям III) синдромом раздраженного кишечника (СРК). ПИСРК развивается после острой диареи любой этиологии — бактериальной, вирусной, протозойной, гельминтной, в том числе и после ДП [54]. Факторы риска ПИСРК были идентифицированы в исследовании Spiller и Garsed (2009 г.) и включают длительность первоначальной диареи, табакокурение, женский пол, депрессию, ипохондрический синдром и наличие неблагоприятных жизненных ситуаций в предшествующие 3 месяца [55]. Отчетливой зависимости риска развития ПИСРК от вида микробного агента выявлено не было. Только в одном ретроспективном исследовании было показано возрастание риска развития ПИСРК после инфекции, обусловленной Campylobacter jejuni, в сравнении с Salmonella spp. [56]. Результаты стандартных биологических, эндоскопических и гистологических исследований у больных ПИСРК, так же как и у больных СРК, не выявляют патологических изменений. Тем не менее в патогенез ПИСРК может вовлекаться воспалительный процесс, о чем свидетельствует выявление незначительных воспалительных изменений в слизистой пищеварительного тракта у больных ПИСРК, преимущественное увеличение количества лимфоцитов и серотонинпродуцирующих энтерохромаффинных клеток, интерлейкина1β и повышение проницаемости стенки тонкого кишечника [57, 58]. Никаких специфических методов профилактики и лечения ПИСРК не существует, и лечение этого состояния аналогично обычному СРК [59].
Особый интерес вызывает возможность применения пробиотиков для лечения СРК, эффективность которых была продемонстрирована в двух рандомизированных контролируемых исследованиях [60].
Манифестация хронических заболеваний как причина персистирующей ДП
Не так уж редко хронические заболевания, сопровождающиеся диареей, манифестируют после эпизода острого гастроэнтерита. Типичным примером может служить целиакия [61]. В настоящий момент точно не известно, имеется ли причинноследственная связь между персистирующей диареей и развитием целиакии или имеет место простое совпадение во времени этих двух заболеваний. Всетаки большинство исследователей склоняется к мнению, что целиакия, протекающая бессимптомно, манифестирует после воздействия на пищеварительный тракт различных повреждающих факторов. Как бы то ни было, при обследовании больного с персистирующей ДП требуется исключение целиакии [62].
Отдельного рассмотрения требуют случаи воспалительных заболеваний кишечника (ВЗК). В типичных случаях ВЗК развивается после острой инфекционной диареи, и этот феномен подтвержден в нескольких ретроспективных исследованиях, хотя механизмы развития ВЗК после острой инфекции не ясны [63, 64].
И наконец, редко встречаются случаи диареи у больных с психическими заболеваниями, при так называемом синдроме Мюнхгаузена [65].
Общие вопросы ведения больных с персистирующей ДП
У туриста с персистирующей ДП помимо проведения стандартных методов исследования (тщательный сбор анамнеза, физикальное обследование, общеклинические анализы) обязательно проведение биохимического и серологического исследования крови и микробиологического исследования кала. При исследовании крови обращают внимание на наличие анемии, эозинофилии, признаков системного воспаления, гипертиреоидизма и наличие IgAантител к тканевой трансглютаминазе (маркер целиакии) [66]. При микробиологическом исследовании кала обращают внимание на наличие классических возбудителей кишечных инфекций, проводят трехкратное микроскопическое исследование на предмет обнаружения цист и трофозоитов простейших, при подозрении на антибиотикоассоциированную диарею рекомендуется исследование кала на наличие токсина А Clostridium difficile. При исследовании кала на простейшие Giardia lamblia и Entamoeba histolytica предпочтение следует отдавать иммунологическим методам, основанным на выявлении антигенов этих простейших в кале. При отрицательных результатах нельзя исключать ложноотрицательные результаты исследований на простейшие, и в таких случаях проводится курс лечения метронидазолом (500 мг внутрь трижды в день длительностью 7 дней).
В случае сохранения диареи при отсутствии нарушений общего самочувствия, отсутствии отклонений в результатах лабораторных методов исследований и при отсутствии примесей крови в кале наиболее вероятным диагнозом является ПИСРК и дальнейшее обследование такого больного можно отложить. В других случаях при сохранении диареи показана эндоскопия верхних отделов пищеварительного тракта и кишечника с проведением биопсии.
Таким образом, хотя острая ДП развивается часто и приводит к нарушению трудоспособности больного, но заболевание характеризуется благоприятным течением. Антибиотикотерапия показана при тяжелом течении острой ДП и проводится на эмпирической основе. Персистирующая ДП является более серьезным состоянием, причиной которого могут быть постинфекционный синдром раздраженного кишечника, персистирование возбудителя, причем высок риск протозойной инфекции или манифестации хронических заболеваний пищеварительного тракта.
1. Blair J.E. Evaluation of fever in the international traveler: unwanted «souvenir» can have many causes // Postgrad. Med. — 2004; 116 (1): 13-20.
2. Hill D.R., Ericsson C.D., Pearson R.D. et al, for the Infectious Diseases Society of America. The practice of travel medicine: guidelines by the Infectious Diseases Society of America // Clin. Infect. Dis. — 2006; 43 (12): 1499-1539.
3. Bacaner N., Stauffer B., Boulware D.R. et al. Travel medicine considerations for North American immigrants visiting friends and relatives // JAMA. — 2004; 291 (23): 2856-2864.
4. Ryan E.T., Wilson M.E., Kain K.C. Illness after international travel // N. Engl. J. Med. — 2002; 347 (7): 505-516.
5. Wilson M.E., Weld L.H., Boggild A. et al. Fever in returned travelers: results from the GeoSentinel Surveillance Network // Clin. Infect. Dis. — 2007; 44 (12): 1560-1568.
6. Zapor M.J., Moran K.A. Infectious diseases during wartime // Curr. Opin. Infect. Dis. — 2005; 18 (5): 395-399.
7. Hill D.R. Health problems in a large cohort of Americans traveling to developing countries // J. Travel. Med. — 2000; 7 (5): 259-266.
8. Ryan E.T., Kain K.C. Health advice and immunizations for travelers // N. Engl. J. Med. — 2000; 342 (23): 1716-1725.
9. Von Sonnenburg F., Tornieporth N., Waiyaki P., Lowe B., Peruski L.F. Jr, DuPont H.L. et al. Risk and aetiology of diarrhoea at various tourist destinations // Lancet. — 2000; 356: 133-134.
10. Castelli F., Pezzoli C., Tomasoni L. Epidemiology of travelers’ diarrhea // J. Travel. Med. — 2001; 8, Suppl. 2: S26-S30.
11. Steffen R., Tornieporth N., Clemens S.A., Chatterjee S., Cavalcanti A.M., Collard F. et al. Epidemiology of travelers’ diarrhea: details of a global survey // J. Travel. Med. — 2004; 11: 231-237.
12.Hill D.R. Occurrence and self-treatment of diarrhea in a large cohort of americans traveling to developing countries // Am. J. Trop. Med. Hyg. — 2000; 62: 585-589.
13.Von Sonnenburg F., Tornieporth N., Waiyaki P., Lowe B., Peruski L.F. Jr, Dupont H.L. et al. Risk and aetiology of diarrhoea at various tourist destinations // Lancet. — 2000; 356: 133-134.
14. Greenwood Z., Black J., Weld L., O’Brien D., Leder K., Von Sonnenburg F. et al. Gastrointestinal infection among international travelers globally // J. Travel. Med. — 2008; 15: 221-228.
15. Steffen R. Epidemiology of traveler’s diarrhea // Clin. Infect. Dis. — 2005; 41, Suppl. 8: S536-S540.
16. Svenungsson B., Lagergren A., Ekwall E., Evengard B., Hedlund K.O., Karnell A. et al. Enteropathogens in adult patients with diarrhea and healthy control subjects: a 1-year prospective study in a Swedish clinic for infectious diseases // Clin. Infect. Dis. — 2000; 30: 770-778.
17. Ansdell V.E., Ericsson C.D. Prevention and empiric treatment of traveler’s diarrhea // Med. Clin. North Am. — 1999; 83: 945-973.
18. Jiang Z.D., Lowe B., Verenkar M.P., Ashley D., Steffen R., Tornieporth N. et al. Prevalence of enteric pathogens among international travelers with diarrhea acquired in Kenya (Mombasa), India (Goa), or Jamaica (Montego Bay) // J. Infect. Dis. — 2002; 185: 497-502.
19. Adachi J.A., Jiang Z.D., Mathewson J.J., Verenkar M.P., Thompson S., Martinez-Sandoval F. et al. Enteroaggregative Escherichia coli as a major etiologic agent in traveler’s diarrhea in 3 regions of the world // Clin. Infect. Dis. — 2001; 32: 1706-1709.
20. Tribble D.R., Sanders J.W., Pang L.W., Mason C., Pitarangsi C., Baqar S. et al. Traveler’s diarrhea in Thailand: randomized, double-blind trial comparing single-dose and 3-day azithromycin-based regimens with a 3-day levofloxacin regimen // Clin. Infect. Dis. — 2007; 44: 338-346.
21. Chapin A.R., Carpenter C.M., Dudley W.C., Gibson L.C., Pratdesaba R., Torres O. et al. Prevalence of norovirus among visitors from the United States to Mexico and Guatemala who experience traveler’s diarrhea // J. Clin. Microbiol. —2005; 43: 1112-1117.
22. Grimes K.A., Mohamed J.A., Dupont H.L., Padda R.S., Jiang Z.D., Flores J. et al. PCR-based assay using occult blood detection cards for detection of diarrheagenic escherichia coli in specimens from U.S. travelers to Mexico with acute diarrhea // J. Clin. Microbiol. — 2008; 46: 2227-2230.
23. Hill D.R., Ericsson C.D., Pearson R.D., Keystone J.S., Freedman D.O., Kozarsky P.E. et al. The practice of travel medicine: guidelines by the Infectious Diseases Society of America // Clin. Infect. Dis. — 2006; 43: 1499-1539.
24.Keystone J.S., Tessier D. A national survey of travel medicine clinics in Canada // J. Travel. Med. — 2003;10: 247.
25. Riddle M.S., Arnold S., Tribble D.R. Effect of adjunctive loperamide in combination with antibiotics on treatment outcomes in traveler’s diarrhea: a systematic review and meta-analysis // Clin. Infect. Dis. — 2008; 47: 1007-1014.
26. Hill D.R., Behrens R.H. A survey of travel clinics throughout the world // J. Travel. Med. — 1996;3: 46–51.
27. Genton B., D’Acremont V. Evidence of efficacy is not enough to develop recommendations: antibiotics for treatment of traveler’s diarrhea // Clin. Infect. Dis. — 2007; 44: 1520; author reply 1521-1522.
28. Ruiz J., Marco F., Oliveira I., Vila J., Gascon J. Trends in antimicrobial resistance in Campylobacter spp. causing traveler’s diarrhea // Apmis. — 2007; 115: 218-224.
29. Dupont H.L., Jiang Z.D., Belkind-Gerson J., Okhuysen P.C., Ericsson C.D., Ke S. et al. Treatment of travelers’ diarrhea: randomized trial comparing rifaximin, rifaximin plus loperamide, and loperamide alone // Clin. Gastroenterol. Hepatol. — 2007; 5: 451-456.
30. Xifaxan (rifaximin) tablets (package insert). Raleigh, NC: Salix Pharmaceuticals, 2004.
31. Ершова И.Б., Осипова Т.Ф., Осычнюк Л.М., Косенко В.С., Мочалова А.А. Диарея во время поездок в другие регионы и страны // Новости медицины и фармации. — 2009. — № 11-12(285-286).
32. Al-Abri S.S., Beeching, N.J., Nye F.J. Traveller’s diarrhoea // Lancet Infect. Dis. — 2005; 5: 349-360.
33. Ericsson C.D., Dupont H.L., Mathewson J.J. Optimal dosing of ofloxacin with loperamide in the treatment of non-dysenteric travelers’ diarrhea // J. Travel. Med. — 2001; 8: 207-209.
34. Addiss D.G., Tauxe R.V., Bernard K.W. Chronic diarrhoeal illness in US peace corps volunteers // Int. J. Epidemiol. — 1990; 19: 217-218.
35. Steffen R., Rickenbach M., Wilhelm U., Helminger A., Schar M. Health problems after travel to developing countries // J. Infect. Dis. — 1987; 156: 84-91.
36. Dupont H.L., Capsuto E.G. Persistent diarrhea in travelers // Clin. Infect. Dis. — 1996; 22: 124-128.
37. Norman F.F., Perez-Molina J., Perez De Ayala A., Jimenez B.C., Navarro M., Lopez-Velez R. Clostridium difficile-associated diarrhea after antibiotic treatment for traveler’s diarrhea // Clin. Infect. Dis. — 2008; 46: 1060-1063.
38. Goodgame R. Emerging causes of traveler’s diarrhea: cryptosporidium, cyclospora, isospora, and microsporidia // Curr. Infect. Dis. Rep. — 2003; 5: 66-73.
39. Aziz H., Beck C.E., Lux M.F., Hudson M.J. A comparison study of different methods used in the detection of Giardia lamblia // Clin. Lab. Sci. — 2001; 14: 150-154.
40. Oberhuber G., Kastner N., Stolte M. Giardiasis: a histologic analysis of 567 cases // Scand. J. Gastroenterol. — 1997; 32: 48-51.
41. Gardner T.B., Hill D.R. Treatment of giardiasis // Clin. Microbiol. Rev. — 2001; 14: 114-128.
42. Anand A.C., Reddy P.S., Saiprasad G.S., Kher S.K. Does non-dysenteric intestinal amoebiasis exist? // Lancet. — 1997; 349: 89-92.
43. Haque R., Ali I.K., Akther S., Petri W.A. Jr. Comparison of PCR, isoenzyme analysis, and antigen detection for diagnosis of entamoeba histolytica infection // J. Clin. Microbiol. — 1998; 36: 449-452.
44. Li E., Stanley S.L. Jr. Protozoa. Amebiasis // Gastroenterol. Clin. North Am. — 1996; 25: 471-492.
45. MacPherson D.W. Intestinal parasites in returned travelers // Med. Clin. North. Am. — 1999; 83: 1053-1075.
46. Goulet C.J., Moseley R.H., Tonnerre C., Sandhu I.S., Saint S. Clinical problem-solving. the unturned stone // N. Engl. J. Med. — 2005; 352: 489-494.
47. Lo A., Guelrud M., Essenfeld H., Bonis P. Classification of villous atrophy with enhanced magnification endoscopy in patients with celiac disease and tropical sprue // Gastrointest. Endosc. — 2007; 66: 377-382.
48. Macaigne G., Boivin J.F., Auriault M.L., Deplus R. Tropical sprue: two cases in the Paris area // Gastroenterol. Clin. Biol. — 2004; 28: 913-916.
49. Beyerlein L., Pohl D., Delco F., Stutz B., Fried M., Tutuian R. Correlation between symptoms developed after the oral ingestion of 50 g lactose and results of hydrogen breath testing for lactose intolerance // Aliment. Pharmacol. Ther. — 2008; 27: 659-665.
50. Suarez F.L., Savaiano D.A., Levitt M.D. A comparison of symptoms after the consumption of milk or lactose-hydrolyzed milk by people with self-reported severe lactose intolerance // N. Engl. J. Med. — 1995; 333: 1-4.
51. Chaudhary N.A., Truelove S.C. The irritable colon syndrome. a study of the clinical features, predisposing causes, and prognosis in 130 cases // Q. J. Med. — 1962; 31: 307-322.
52. Dupont A.W. Postinfectious irritable bowel syndrome // Clin Infect Dis. — 2008; 46: 594-599.
53. Connor B.A. Sequelae of traveler’s diarrhea: focus on postinfectious irritable bowel syndrome // Clin. Infect. Dis. — 2005; 41, Suppl. 8: S577-S586.
54. Marshall J.K., Thabane M., Borgaonkar M.R., James C. Postinfectious irritable bowel syndrome after a food-borne outbreak of acute gastroenteritis attributed to a viral pathogen // Clin. Gastroenterol. Hepatol. — 2007; 5: 457-460.
55. Spiller R., Garsed K. Postinfectious irritable bowel syndrome // Gastroenterology. — 2009; 136: 1979-1988.
56. Neal K.R., Hebden J., Spiller R. Prevalence of gastrointestinal symptoms six months after bacterial gastroenteritis and risk factors for development of the irritable bowel syndrome: postal survey of patients // BMJ. — 1997; 314: 779-782.
57. Dunlop S.P., Jenkins D., Neal K.R., Spiller R.C. Relative importance of enterochromaffin cell hyperplasia, anxiety, and depression in postinfectious IBS // Gastroenterology. — 2003; 125: 1651-1659.
58. Marshall J.K., Thabane M., Garg A.X., Clark W., Meddings J., Collins S.M. Intestinal permeability in patients with irritable bowel syndrome after a waterborne outbreak of acute gastroenteritis in Walkerton, Ontario // Aliment. Pharmacol. Ther. — 2004; 20: 1317-1322.
59. Dalrymple J., Bullock I. Diagnosis and management of irritable bowel syndrome in adults in primary care: summary of NICE guidance // BMJ. — 2008; 336: 556-558.
60. Brenner D.M., Moeller M.J., Chey W.D., Schoenfeld P.S. The utility of probiotics in the treatment of irritable bowel syndrome: a systematic review // Am. J. Gastroenterol. — 2009; 104: 1033-1049, quiz 1050.
61. Landzberg B.R., Connor B.A. Persistent diarrhea in the returning traveler: think beyond persistent infection // Scand. J. Gastroenterol. — 2005; 40: 112-114.
62. Schiller L.R. Chronic diarrhea // Gastroenterology. — 2004; 127: 287-293.
63. Porter C.K., Tribble D.R., Aliaga P.A., Halvorson H.A., Riddle M.S. Infectious gastroenteritis and risk of developing inflammatory bowel disease // Gastroenterology. — 2008; 135: 781-786.
64. Irving P.M., Gibson P.R. Infections and IBD // Nat. Clin. Pract. Gastroenterol. Hepatol. — 2008; 5: 18-27.
65. Gill C.J., Hamer D.H. «Doc, there’s a worm in my stool»: Munchausen parasitosis in a returning traveler // J. Travel. Med. — 2002; 9: 330-332.
66. De Saussure P., Joly F., Bouhnik Y. Contribution of autoantibody assays to the diagnosis of adulthood celiac disease // Joint Bone Spine. — 2005; 72: 279-282.
